随着高分辨磁共振血管壁成像在缺血性卒中病因评估中的广泛应用,对于非狭窄(管腔狭窄程度<50%)高危斑块的识别越来越多。非狭窄高危斑块在影像和病理上具有一定的特征性,其与卒中发生的相关性在既往研究中也多次被证实。目前对于非狭窄高危斑块的评估手段主要包括超声、磁共振成像、CT和PET。然而,关于非狭窄高危斑块的评估操作规范及如何判定检出斑块是否为本次卒中的责任斑块仍然缺乏统一标准,关于高危斑块相关卒中的最佳治疗方案也缺乏高质量的循证医学证据。未来关于非狭窄高危斑块与临床卒中事件的相关性仍需要大样本前瞻性研究进一步证实,同时需要进一步借助影像明确高危斑块动态演变规律,开展高质量随机对照研究,进一步比较抗凝或抗血小板治疗的优劣及最佳时机,寻找简易评估标准辅助早期治疗。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
经全国继续医学教育委员会批准,本刊开设继教专栏,文后附5道单选题,读者阅读后可扫描标签二维码答题,每篇可免费获得Ⅱ类继教学分0.5分,全年最多可获5分
高分辨磁共振血管壁成像的应用提高了临床医师对于颅内外血管病变病因的认识,也增加了对动脉粥样硬化斑块的早期识别,其不仅可以在管腔狭窄前识别动脉粥样硬化斑块,还可以对斑块负荷进行定量评估及对斑块性质进行判断,也为临床卒中病因分型提供了极大的帮助。非狭窄高危斑块与卒中事件的相关性也在多个研究中被证实。本文将对非狭窄高危斑块相关卒中进行回顾,重点对其目前在临床上的评估手段、与卒中事件的关系及治疗现状进行系统综述。
非狭窄高危斑块相关卒中最初作为不明原因栓塞性卒中(embolic stroke of underteminted source,ESUS)的一个亚型逐渐被认识。ESUS概念的提出挑战了传统的TOAST(trial of Org 10 172 in acute stroke treatment)卒中分型。TOAST分型是1993年提出的最早适用于缺血性卒中的病因分型[1],随后在很多关于卒中治疗的临床试验中也广为应用。其将缺血性卒中分为大动脉粥样硬化型、心源性栓塞型、小血管病变型、其他原因和不明原因型[1]。在对不明原因栓塞性卒中的病因和发病机制探索中,研究者发现栓塞性卒中在隐源性卒中中占据绝大多数,2014年隐源性卒中国际工作组提出了ESUS的概念,并将其诊断标准定义为非腔隙性缺血性卒中,不合并颅内外大动脉>50%的狭窄,没有主要的心源性栓塞证据,卒中非特定原因导致,如夹层、血管炎、血管痉挛等。ESUS概念的提出旨在进一步明确针对该类人群进行抗凝治疗是否能够降低卒中复发风险。其实际上包含了一系列不同栓塞来源的疾病谱,主要包括:可能心源性(如心脏瓣膜病变、心房结构异常、心室活动异常等);肿瘤相关高凝状态,动脉源性栓塞(主要包括主动脉弓的动脉粥样硬化、颅内外动脉的非狭窄高危斑块等)及反常栓塞(如卵圆孔未闭、房间隔缺损、肺动静脉瘘等)及相应评估流程[2]。鉴于其他栓塞性卒中的发病率较低,以及多种影像手段用于颅内外血管壁病变评估的增加,临床医师对于非狭窄高危斑块的检出率也越来越高,对于其与卒中关系的认识也越来越多。
目前对于非狭窄高危斑块的评估手段主要包括超声、磁共振成像、CT和PET。对于主动脉弓斑块的识别主要是经食管超声[3]和CT血管成像,颈动脉主要是依靠高分辨磁共振血管壁成像、颈动脉超声及CT血管成像,也有利用PET/MRI针对颈动脉的斑块内新生血管进行评估的报道。颅内血管由于活体病理检测存在一定困难,目前仍依赖于高分辨磁共振血管壁成像。
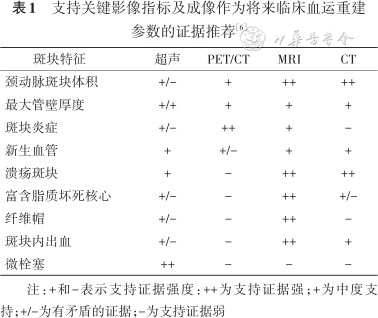
病理上的高危斑块是指那些具有较大的脂质核心、纤维帽破裂、斑块内出血等特征的斑块。与之相对应,影像上的高危斑块是指与心脑血管事件相关的斑块,目前临床上常用的主要评价指标包括斑块体积、最大管壁厚度、斑块内新生血管、斑块形态(表面不规则)、斑块成分(大脂质核心和薄纤维帽、斑块内出血)等。目前针对颈动脉和颅内动脉斑块的评估,高分辨磁共振血管壁成像的研究较多,然而各个研究又存在一些异质性,如成像的参数、扫描的序列、覆盖的范围等。近年来,国内外的磁共振放射学组针对血管壁成像扫描的一些规范也进行了推荐[4, 5],国际颈动脉斑块专家组针对用于识别颈动脉斑块易损性的影像方法进行了梳理和推荐(表1)[6],为今后开展更高质量的卒中干预研究奠定了基础。
颈动脉非狭窄高危斑块与卒中事件的相关性在多个研究中被证实。来自2011—2015年康奈尔急性卒中数据登记的研究提示,在纳入的完善颈动脉高分辨磁共振血管壁成像的579例前循环卒中患者中,斑块内出血在不同TOAST分型均可出现,且在梗死同侧较对侧发生的比例更高,在大动脉粥样硬化卒中的RR= 3.7,95%CI:2.2~6.1,隐源性卒中患者中RR= 2.1,95%CI:1.4~3.1,心源性栓塞卒中患者中RR= 1.7,95%CI:1.1~2.4。基于上述结果,作者提出基于磁共振血管壁成像的检查可以将卒中亚型进行重新分类[7]。另一个在隐源性卒中患者中利用磁共振黑血成像技术针对颈动脉高危斑块进行成像的研究,发现在检测的梗死同侧的颈动脉中,37.5%(12/32)出现美国心脏学会(American Heart Association,AHA)Ⅳ型斑块(特征为斑块内出血、血栓形成及纤维帽破裂),最常见的为斑块内出血,其次为斑块表面纤维帽破裂[8]。一项荟萃分析纳入了8个报告颈动脉斑块的ESUS研究(共计323例卒中患者),结果发现梗死同侧颈动脉出现高危斑块(斑块表面不规则、溃疡斑块、斑块内出血、纤维帽破裂等)的风险是对侧的5倍,提示可能的卒中风险[9]。此外,联合PET/MRI针对颈动脉斑块性质的研究也提示,在既往被定义为隐源性卒中的人群中,梗死同侧的颈动脉非狭窄高危斑块的发生率要显著高于对侧[8,10],进一步提示颈动脉易损斑块在卒中发生中的潜在作用。也有研究比较了颈动脉斑块内出血和管腔狭窄程度与卒中事件的相关性,结果发现,管腔狭窄程度与斑块内出血独立相关,管腔狭窄程度越重,斑块内出血的发生率越高,OR =1.02,95%CI:1.01~1.03。然而,斑块内出血与卒中事件的相关性在轻度狭窄组(狭窄程度<30%)更显著(OR =5.68,95%CI:1.49~21.69),提示在非狭窄颈动脉病变卒中人群识别易损斑块的重要性[11]。另外一项荟萃分析纳入了31个关于颈动脉非狭窄高危斑块与卒中或短暂性脑缺血发作(transient ischemic attack,TIA)出现及复发关系的研究,其中25个研究(13 428 例患者)为首次卒中或TIA,6项研究(122例患者)为卒中或TIA复发,结果提示,卒中或TIA复发率在合并非狭窄高危斑块人群为2.6/100人年,如果合并斑块内出血,其复发率可上升至4.9/100人年[12]。关于颅内动脉非狭窄症状性斑块与卒中事件的荟萃分析纳入了21项研究,结果也提示,非狭窄高危斑块与卒中事件及预后相关,其中斑块增强、阳性重塑、斑块内出血与急性卒中事件密切相关[13]。
既往多数关于非狭窄高危斑块相关卒中的研究均为横断面研究,只有少部分为前瞻性研究,非狭窄高危斑块导致卒中事件的因果关系仍需要大样本的前瞻性研究进一步证实。此外,斑块内出血持续时间可以很长,是在卒中发生前还是后,不容易判定,需要动态随访,同时其与卒中事件的相关性还需要借助其他手段进一步判断,如经颅多普勒超声(TCD)栓子监测、梗死分布等。再次,动脉粥样硬化斑块的破裂和修复是一个动态变化的过程[14]。有学者提出根据斑块表面形态,斑块是否在梗死区域的责任血管,及是否合并心源性栓塞来源证据等将颈动脉的非狭窄斑块分为确定的、很可能的及可能的责任病变(即所谓的症状性非狭窄颈动脉病变)[15],如表2。其主要缺陷在于如果作为指导早期卒中治疗的分型,临床不易操作,依赖于一系列检查的完善和排除诊断。

症状性非狭窄颈动脉病变的定义[15]
症状性非狭窄颈动脉病变的定义[15]
| 定义 | 需满足条件 |
|---|---|
| 确定的症状性非狭窄颈动脉病变 | 如果没有其他的卒中病因,需满足以下所有条件: |
| (1)非狭窄(<50%)的颈动脉高危斑块及形态改变(至少2种检查在同一时间点证实,如超声、DSA、CTA或MRI) | |
| (2)头颅MRI影像检查证实复发性栓塞性卒中,局限于相应颈内动脉供血区的新旧梗死灶并存 | |
| (3)没有在其他血管供血区出现急性或慢性梗死灶 | |
| 很可能的症状性非狭窄颈动脉病变 | 如果没有其他的卒中病因,需满足以下所有条件: |
| (1)非狭窄(<50%)的颈动脉高危斑块(超声、DSA、CTA或MRI上证实) | |
| (2)头颅MRI影像证实的急性栓塞性卒中,局限于相应的颈内动脉供血区 | |
| (3)其他血管供血区域没有出现新发或陈旧的梗死灶 | |
| 在有可能出现心源性栓塞的条件下,需满足以下条件: | |
| (1)非狭窄(<50%)的颈动脉高危斑块及形态改变(至少2种检查在同一时间点证实,如超声、DSA、CTA或MRI) | |
| (2)头颅MRI影像证实的急性栓塞性卒中,局限于相应的颈内动脉供血区 | |
| (3)其他血管供血区域没有出现新发或陈旧的梗死灶 | |
| 在有可能出现心源性栓塞的条件下,需满足以下条件: | |
| (1)非狭窄(<50%)的颈动脉高危斑块(超声、DSA、CTA或MRI上证实) | |
| (2)头颅MRI影像检查证实复发性栓塞性卒中,局限于相应颈内动脉供血区的新旧梗死灶并存 | |
| (3)其他血管供血区域没有出现新发或陈旧的梗死灶 | |
| 可能的症状性非狭窄颈动脉病变 | 在有可能出现心源性栓塞的条件下,需满足以下条件: |
| (1)非狭窄(<50%)的颈动脉高危斑块(超声、DSA、CTA或MRI上证实) | |
| (2)头颅MRI影像证实的急性栓塞性卒中,局限于相应的颈内动脉供血区 | |
| (3)其他血管供血区域没有出现新发或陈旧的梗死灶 |
治疗方面,尽管高分辨磁共振越来越多地用于血管壁斑块评估,对于非狭窄高危斑块的识别率逐渐提高,但是目前尚无针对非狭窄高危斑块的随机对照干预试验。主要原因在于,针对卒中的治疗大多以临床结局作为观察终点,且非狭窄高危斑块与卒中事件的相关性临床难以在早期确定,未来仍需要更大规模更严谨的前瞻性研究明确非狭窄高危斑块与卒中事件的关系。
关于非狭窄高危斑块相关卒中的治疗可以从既往关于ESUS治疗的亚组中获得一些证据。而ESUS中的非狭窄动脉可能涵盖了来自于主动脉弓的易损斑块,同时也包括来源于颈动脉的非狭窄斑块[16, 17]。既往关于ESUS治疗的随机对照研究发现,对于非狭窄高危斑块的卒中人群进行抗凝治疗与抗血小板治疗比较,并没有显著降低卒中复发风险[18]。另一个比较替格瑞洛和阿司匹林治疗ESUS的研究结果提示,在所有人群中替格瑞洛疗效不优于阿司匹林,但是在同侧脑动脉狭窄<50%的人群及主动脉弓粥样硬化人群亚组,替格瑞洛可能在减少主要终点事件方面(90 d的卒中复发、心肌梗死和死亡)优于阿司匹林[19]。
首先,关于非狭窄高危斑块与临床卒中事件的相关性需要大样本前瞻性研究进一步证实,如栓子监测、优化分层、设立标准规范。在鉴别诊断中,对于合并其他可能栓塞来源的病因如何判定是否症状相关也很重要。其次,需要进一步明确斑块演变规律,斑块的破裂和修复是一个动态反复的过程[20],需要了解其自然病史。既往研究提示颅内斑块增强可持续数月,症状性与非症状性斑块的预后及信号演变可能存在差异[21],但为小样本研究,需要进一步证实。斑块内出血可以持续较长时间,目前的影像评估不能鉴别出现时机[6]。再次,临床完善的评估需要一定的时间,针对这些易损斑块导致动脉到动脉的栓塞,既往研究提示TCD监测所得到的栓子阳性率在早期较高,待完善的病因评估后再启动抗凝或抗栓治疗是否能够满足临床需求?是否有临床简易可替代的评估标准决定早期的治疗方案?这一系列问题仍有待于进一步研究。
所有作者均声明不存在利益冲突
1、目前最佳评估颅内动脉粥样硬化斑块内出血的影像检查为()
A. CTA;
B. 磁共振血管壁成像;
C. 经颅多普勒;
D. PET
2、影像上的高危斑块特征不包括()
A. 斑块体积大;
B. 斑块表面不规则;
C. 斑块纤维帽薄;
D. 斑块长度
3、下列哪项不是确定非狭窄高危斑块是否症状相关的标准()
A. 斑块所在血管是否梗死灶的责任血管;
B. 斑块内出血的信号强度;
C. 斑块表面不规则;
D. 梗死灶分布及形态
4、对于非狭窄高危斑块导致的卒中,TOAST分型为()
A. 大动脉粥样硬化型;
B. 心源性栓塞型;
C. 小动脉闭塞型;
D. 其他原因型
5、目前对于不明原因栓塞性卒中的最佳抗凝治疗方案为()
A. 抗凝;
B. 抗血小板;
C. 抗凝+抗血小板;
D. 尚不明确