
维布妥昔单抗(BV)是一种抗体-药物偶联物,于2020年5月在我国获批上市,目前已经被批准用于成年CD30阳性淋巴瘤患者,包括复发难治经典型霍奇金淋巴瘤、复发难治系统性间变性大细胞淋巴瘤、既往接受过系统性治疗的原发性皮肤间变性大细胞淋巴瘤或蕈样霉菌病。目前BV在临床实践中的应用数据尚待完善。为了进一步规范BV在CD30阳性淋巴瘤患者中的临床应用,专家组成员结合BV应用现状及已经公布的BV相关研究数据,制定了该临床应用指导原则,供临床医生参考。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
目前淋巴瘤治疗已经进入了精准治疗时代,CD30已成为帮助淋巴瘤诊断及制订治疗决策的重要标志物。维布妥昔单抗(BV)作为靶向CD30的抗体-药物偶联物(ADC),属于首创新药。本共识将从CD30阳性淋巴瘤诊断、治疗原则、治疗方案与药物选择等方面,基于现有的临床研究证据提出指导原则,旨在为临床医师提供参考。
CD30是属于肿瘤坏死因子受体超家族的相对分子质量为120×103的跨膜糖蛋白受体,最初发现于经典型霍奇金淋巴瘤(cHL),通过核因子-κB(NF-κB)、促分裂原活化蛋白激酶(MAPK)等途径参与细胞内信号转导,使其在肿瘤细胞中具有多种抗细胞凋亡和促进存活的效应[1]。除cHL外,CD30也表达于某些激活的淋巴细胞或肿瘤性淋巴细胞,后者包括间变性大细胞淋巴瘤(ALCL)、部分外周T细胞淋巴瘤[外周T细胞淋巴瘤-非特指型(PTCL-NOS)、血管免疫母细胞性T细胞淋巴瘤(AITL)、结外NK/T细胞淋巴瘤]、弥漫大B细胞淋巴瘤(DLBCL)等[2]。由于CD30在非造血良性组织或静止的淋巴细胞和单核细胞中不表达,因此被认为是CD30阳性淋巴瘤的最佳治疗靶点[3]。
B细胞淋巴瘤(BCL)各亚型中CD30阳性率分别为:经典型霍奇金淋巴瘤(cHL)接近100%,原发性纵隔(胸腺)大B细胞淋巴瘤(PMBL)>80%,弥漫大B细胞淋巴瘤-非特指型(DLBCL-NOS)10%~20%,结节性淋巴细胞为主型霍奇金淋巴瘤(NLPHL)<10%,富于T细胞/组织细胞的大B细胞淋巴瘤(THRLBCL)<10%,间变性淋巴瘤激酶阳性大B细胞淋巴瘤(ALK+ LBCL)通常为阴性[4]。外周T细胞淋巴瘤各亚型中CD30阳性率分别为:ALCL接近100%[4,5],肠病相关T细胞淋巴瘤(EATL)50%~100%[5,6],结外NK/T细胞淋巴瘤30%~80%[4,5,6],AITL 51%~76%[5,6],PTCL-NOS 58%~64%[5,6]、成年人T细胞白血病/淋巴瘤(ATLL)0~56%[5,7,8]。皮肤T细胞淋巴瘤各亚型中CD30阳性率分别为:原发性皮肤间变性大细胞淋巴瘤(pcALCL)≥75%~100%[4,6,9],淋巴瘤样丘疹病(LyP)≥75%[9],转化型蕈样霉菌病(MF)40%~100%[6,10],MF/Sezary综合征(SS)10%~15%,原发性皮肤CD8阳性肢端T细胞淋巴瘤(pc CD8+ ATCL)常为阴性[4],原发性皮肤CD4阳性小/中T细胞淋巴组织增生性疾病(pc CD4+小/中T-LPD)常为阴性[4]。
淋巴瘤诊断中CD30常用的检测方法包括免疫组织化学(IHC)及流式细胞术。CD30不仅是诊断标志物,也是指导治疗的标志物,建议将CD30纳入各亚型淋巴瘤的检测组合中,尤其是PTCL、皮肤T细胞淋巴瘤(CTCL)、DLBCL等。CD30检测存在方法和技术的差异性,目前国内尚无统一的CD30检测和报告标准,以下几方面应着重关注。
分析前样本制备,分析时使用的抗体试剂盒、染色方法及流程均应有明确的操作规范,建议可进行基于IHC方法的一致性评价,并根据淋巴瘤CD30临床病理检测规范和IHC染色判读相关共识进行检测及结果判读。
一般将靶细胞膜、细胞质和细胞核旁高尔基区出现棕色着色信号判读为阳性。对于cHL和ALCL患者,由于其稳定一致表达CD30,存在任意比例的CD30阳性细胞均为可报告为"阳性";其他类型淋巴瘤的染色结果判读需进行定量分析,建议列出所有肿瘤细胞中CD30阳性者所占的具体比例,从而为临床医师提供更确切的参考。对于炎性浸润较丰富,难以区分CD30阳性细胞是肿瘤细胞还是反应性细胞的情形,则计算CD30阳性细胞占所有淋巴样细胞的百分比。阳性细胞比例计量单位建议如下:低于5%、5%、10%、20%、30%……90%、100%,原则上以整张切片为基准,如有较大区域异质性,亦可备注热点区域数值,如30%(70%),指整张切片阳性细胞比例为30%,热点区域高达70%。除经典的组织学IHC检测CD30方法外,细针吸取活组织检查样本结合流式细胞术在评估CD30时也表现可靠,可推荐有此技术基础的单位酌情使用或联合IHC使用,以提高CD30检测结果的可靠性。由于病理检测可能存在判读界值的不同,建议临床医生必要时可与病理科医生沟通以了解具体的判读标准,以便为临床治疗决策的制订提供依据。
BV通过ADC技术将细胞毒药物单甲基澳瑞他汀E(MMAE)引入细胞内,从而阻滞细胞周期,诱导细胞凋亡,已在多种亚型的CD30阳性淋巴瘤中显示出良好的疗效。
BV是一种ADC,可输送抗肿瘤药物至病灶,靶向诱导表达CD30的肿瘤细胞凋亡,其分子式为C6860H10532N1740O2168S40,相对分子质量为153×103,化学结构式见图1。
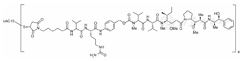

BV由三部分组成:(1)嵌合IgG1抗体cAC10,是人源性CD30特异性抗体;(2)微管破坏剂MMAE;(3)一个将MMAE共价附着在cAC10上的蛋白酶可裂解连接桥。临床前数据显示,BV通过多步骤过程发挥生物活性。ADC与细胞表面的CD30结合后,ADC-CD30复合物由细胞内吞进入溶酶体腔。在细胞内,通过蛋白酶裂解,释放单一活性物质MMAE。MMAE与微管蛋白结合,破坏细胞内的微管网络,诱导细胞周期阻滞,导致表达CD30的肿瘤细胞凋亡。此外,体外实验表明其有抗体依赖性细胞介导的吞噬作用(ADCP)。
BV的药代动力学在血液系统恶性肿瘤患者的单药治疗和联合化疗中进行了评估,结果显示联合化疗的药代动力学与单药治疗方案相似。总抗体和ADC具有相似的药代动力学特征。通常在输注结束或最接近输注结束的采样时间点可观察到BV ADC的最高浓度。与剂量大致成比例暴露在1.2~2.7 mg/kg(最高批准推荐剂量的1.5倍)。还观察到ADC的血清浓度呈多指数性递减,半衰期4~6 d。暴露量与剂量大致成正比。MMAE是BV的主要代谢产物。在输注结束后1~3 d观察到MMAE的最大浓度。随着BV持续给药,暴露量减少,在随后的剂量中观察到50%~80%的第1剂暴露量,MMAE消除呈单指数下降,半衰期为3~4 d。MMAE的消除受限于其从ADC释放的速率。
BV在我国获批的适应证为治疗CD30阳性淋巴瘤成年患者,包括复发或难治系统性间变性大细胞淋巴瘤(sALCL)、复发或难治cHL、既往接受过系统性治疗的pcALCL或MF。其在国外获批的适应证还包括:用于复发或进展高风险cHL患者接受自体造血干细胞移植(ASCT)后的巩固治疗;BV联合化疗治疗初始Ⅲ或Ⅳ期cHL;BV联合化疗治疗初治sALCL或其他表达CD30的外周T细胞淋巴瘤(PTCL)。BV在不同适应证中的用法、用量见表1。
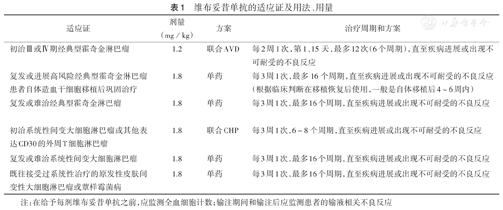
维布妥昔单抗的适应证及用法、用量
维布妥昔单抗的适应证及用法、用量
| 适应证 | 剂量(mg/kg) | 方案 | 治疗周期和方案 |
|---|---|---|---|
| 初治Ⅲ或Ⅳ期经典型霍奇金淋巴瘤 | 1.2 | 联合AVD | 每2周1次,第1、15天,最多12次(6个周期),直至疾病进展或出现不可耐受的不良反应 |
| 复发或进展高风险经典型霍奇金淋巴瘤患者自体造血干细胞移植后巩固治疗 | 1.8 | 单药 | 每3周1次,最多16个周期,直至疾病进展或出现不可耐受的不良反应(根据临床判断在移植恢复后使用,一般是自体移植后4~6周内) |
| 复发或难治经典型霍奇金淋巴瘤 | 1.8 | 单药 | 每3周1次,最多16个周期,直至疾病进展或出现不可耐受的不良反应 |
| 初治系统性间变大细胞淋巴瘤或其他表达CD30的外周T细胞淋巴瘤 | 1.8 | 联合CHP | 每3周1次,6~8个周期,直至疾病进展或出现不可耐受的不良反应 |
| 复发或难治系统性间变大细胞淋巴瘤 | 1.8 | 单药 | 每3周1次,最多16个周期,直至疾病进展或出现不可耐受的不良反应 |
| 既往接受过系统性治疗的原发性皮肤间变性大细胞淋巴瘤或蕈样霉菌病 | 1.8 | 单药 | 每3周1次,最多16个周期,直至疾病进展或出现不可耐受的不良反应 |
注:在给予每剂维布妥昔单抗之前,应监测全血细胞计数;输注期间和输注后应监测患者的输液相关不良反应
BV治疗成熟T细胞和NK细胞肿瘤的主要研究见表2。
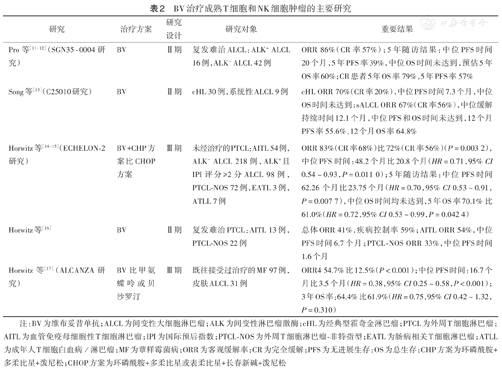
BV治疗成熟T细胞和NK细胞肿瘤的主要研究
BV治疗成熟T细胞和NK细胞肿瘤的主要研究
| 研究 | 治疗方案 | 研究设计 | 研究对象 | 重要结果 |
|---|---|---|---|---|
| Pro等[11,12](SGN35-0004研究) | BV | Ⅱ期 | 复发难治ALCL:ALK+ ALCL 16例,ALK- ALCL 42例 | ORR 86%(CR率57%);5年随访结果:中位PFS时间20个月,5年PFS率39%,中位OS时间未达到,预估5年OS率60%;CR患者5年OS率79%,5年PFS率57% |
| Song等[13](C25010研究) | BV | Ⅱ期 | cHL 30例,系统性ALCL 9例 | cHL ORR 70%(CR率20%),中位PFS时间7.3个月,中位OS时间未达到;sALCL ORR 67%(CR率56%),中位缓解持续时间12.1个月,中位PFS和OS时间未达到,12个月PFS率55.6%,12个月OS率64.8% |
| Horwitz等[14,15](ECHELON-2研究) | BV+CHP方案比CHOP方案 | Ⅲ期 | 未经治疗的PTCL:AITL 54例,ALK- ALCL 218例,ALK+且IPI评分≥2分ALCL 98例,PTCL-NOS 72例,EATL 3例,ATLL 7例 | ORR 83%(CR率68%)比72%(CR率56%)(P=0.003 2),中位PFS时间:48.2个月比20.8个月(HR=0.71,95% CI 0.54~0.93,P=0.011 0);5年随访结果:中位PFS时间62.26个月比23.75个月(HR=0.70,95% CI 0.53~0.91,P=0.007 7),中位OS时间均未达到,5年OS率70.1%比61.0%(HR=0.72,95% CI 0.53~0.99,P=0.042 4) |
| Horwitz等[16] | BV | Ⅱ期 | 复发难治PTCL:AITL 13例,PTCL-NOS 22例 | 总体ORR 41%,疾病控制率59%;AITL ORR 54%,中位PFS时间6.7个月;PTCL-NOS ORR 33%,中位PFS时间1.6个月 |
| Horwitz等[17](ALCANZA研究) | BV比甲氨蝶呤或贝沙罗汀 | Ⅲ期 | 既往接受过治疗的MF 97例,皮肤ALCL 31例 | ORR4 54.7%比12.5%(P<0.001);中位PFS时间:16.7个月比3.5个月(HR=0.38,95% CI 0.25~0.58,P<0.001);3年OS率:64.4%比61.9%(HR=0.75,95% CI 0.42~1.32,P=0.310) |
注:BV为维布妥昔单抗;ALCL为间变性大细胞淋巴瘤;ALK为间变性淋巴瘤激酶;cHL为经典型霍奇金淋巴瘤;PTCL为外周T细胞淋巴瘤;AITL为血管免疫母细胞性T细胞淋巴瘤;IPI为国际预后指数;PTCL-NOS为外周T细胞淋巴瘤-非特指型;EATL为肠病相关T细胞淋巴瘤;ATLL为成年人T细胞白血病/淋巴瘤;MF为蕈样霉菌病;ORR为客观缓解率;CR为完全缓解;PFS为无进展生存;OS为总生存;CHP方案为环磷酰胺+多柔比星+泼尼松;CHOP方案为环磷酰胺+多柔比星或表柔比星+长春新碱+泼尼松
基于BV在复发难治sALCL患者中开展的关键Ⅱ期研究SGN35-0004和C25010[11,12],我国批准BV用于复发难治sALCL患者。Pro等[12]使用BV治疗复发难治sALCL的Ⅱ期临床研究SGN35-0004结果显示,首次治疗后随访5年,中位总生存(OS)未达到,5年OS率约为60%,66%完全缓解(CR)患者中位无进展生存(PFS)和OS时间均未达到,提示BV单药方案是一种潜在的治愈性治疗选择。Song等[13]在我国开展的一项Ⅱ期注册研究(C25010)结果提示,BV在我国cHL和sALCL患者治疗中具有积极的风险收益比,随访12.4个月时中位PFS时间为13.5个月,随访16.6个月时中位OS时间未达到,为我国cHL和sALCL患者提供了新的治疗选择。
基于一项针对初治CD30阳性PTCL患者的随机双盲、安慰剂对照Ⅲ期研究ECHELON-2[14,15],美国和欧盟等国家或地区批准BV用于治疗初治sALCL或其他表达CD30的PTCL患者。该研究5年随访结果显示,相比CHOP(环磷酰胺、多柔比星或表柔比星、长春新碱、泼尼松)方案组,BV+CHP(环磷酰胺+多柔比星+泼尼松)方案组OS改善,死亡风险降低28%,超过50%的CD30阳性PTCL患者获得持续缓解,在sALCL患者中,PFS的HR为0.55(95% CI 0.39~0.79,P=0.000 9),约60%的患者持续缓解[18]。与标准治疗相比,BV+CHP方案有效改善患者治疗结局,可能是临床更优的治疗选择。
一项Ⅱ期研究评估了复发CD30阳性PTCL中BV的疗效,受试者中不包括ALCL。共纳入35例患者,包括13例AITL和22例PTCL-NOS。研究结果显示,ORR为41%(AITL的ORR为54%,中位PFS时间为6.7个月;PTCL-NOS的ORR为33%,中位PFS时间为1.6个月),疾病控制率为59%[16]。
基于ALCANZA Ⅲ期研究针对CD30阳性CTCL的结果[17],我国批准BV用于既往接受过系统性治疗的pcALCL或MF。ALCANZA Ⅲ期研究是首个在CTCL人群中开展的Ⅲ期随机对照临床研究,结果显示针对CD30阳性CTCL,BV与甲氨蝶呤或贝沙罗汀相比具有更持久的治疗反应和更长的PFS,疾病进展风险降低62%[17]。
(1)对于初治患者,与ECHELON-2研究一致,推荐ALK- ALCL及国际预后指数(IPI)评分≥2分的ALK+ ALCL初始治疗选择BV联合环磷酰胺、多柔比星、泼尼松(BV+CHP方案),其他CD30阳性细胞比例≥10%的PTCL亦可选择BV+CHP方案。适用于CD30阳性的组织学亚型PTCL,包括但不限于sALCL、PTCL-NOS、AITL、ATLL、EATL。建议所有接受BV+CHP方案治疗的患者进行粒细胞集落刺激因子(G-CSF)一级预防。(2)对于复发或难治患者:与SGN035-0004研究一致,BV是CD30阳性复发难治PTCL患者的挽救治疗选择之一。无论ALK状态或既往治疗线数,ALCL患者均适合接受BV治疗。(3)对于CTCL患者,与ALCANZA研究一致,既往经治的CD30阳性CTCL患者可考虑BV治疗,包括pcALCL、CD30阳性的MF等。pcALCL伴区域淋巴结的患者可考虑采用BV+CHP方案作为初始治疗。
BV治疗cHL的主要研究见表3。
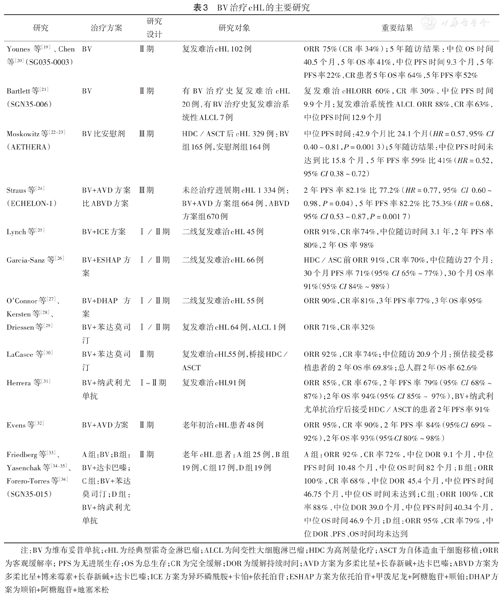
BV治疗cHL的主要研究
BV治疗cHL的主要研究
| 研究 | 治疗方案 | 研究设计 | 研究对象 | 重要结果 |
|---|---|---|---|---|
| Younes等[19]、Chen等[20](SG035-0003) | BV | Ⅱ期 | 复发难治cHL 102例 | ORR 75%(CR率34%);5年随访结果:中位OS时间40.5个月,5年OS率41%,中位PFS时间9.3个月,5年PFS率22%,CR患者5年OS率64%,5年PFS率52% |
| Bartlett等[21](SGN35-006) | BV | Ⅱ期 | 有BV治疗史复发难治cHL 20例,有BV治疗史复发难治系统性ALCL 7例 | 复发难治cHLORR 60%,CR率30%,中位PFS时间9.9个月;复发难治系统性ALCL ORR 88%,CR率63%,中位PFS时间12.9个月 |
| Moskowitz等[22,23](AETHERA) | BV比安慰剂 | Ⅲ期 | HDC/ASCT后cHL 329例:BV组165例,安慰剂组164例 | 中位PFS时间:42.9个月比24.1个月(HR=0.57,95% CI 0.40~0.81,P=0.001 3);5年随访结果:中位PFS时间未达到比15.8个月,5年PFS率59%比41%(HR=0.52,95% CI 0.38~0.72) |
| Straus等[24](ECHELON-1) | BV+AVD方案比ABVD方案 | Ⅲ期 | 未经治疗进展期cHL 1 334例:BV+AVD方案组664例,ABVD方案组670例 | 2年PFS率82.1%比77.2%(HR=0.77,95% CI 0.60~0.98,P=0.04),5年PFS率82.2%比75.3%(HR=0.68,95% CI 0.53~0.87,P=0.001 7) |
| Lynch等[25] | BV+ICE方案 | Ⅰ/Ⅱ期 | 二线复发难治cHL 45例 | ORR 91%,CR率74%,中位随访时间3.1年,2年PFS率80%,2年OS率98% |
| Garcia-Sanz等[26] | BV+ESHAP方案 | Ⅰ/Ⅱ期 | 二线复发难治cHL 66例 | HDC/ASC前ORR 91%,CR率70%,中位随访27个月:30个月PFS率71%(95% CI 65%~77%),30个月OS率91%(95% CI 84%~98%) |
| O'Connor等[27]、Kersten等[28]、Driessen等[29] | BV+DHAP方案BV+苯达莫司汀 | Ⅰ/Ⅱ期Ⅰ/Ⅱ期 | 二线复发难治cHL 55例复发难治cHL 64例,ALCL 1例 | ORR 90%,CR率81%,3年PFS率77%,3年OS率95%ORR 71%,CR率32% |
| LaCasce等[30] | BV+苯达莫司汀 | Ⅱ期 | 复发难治cHL55例,桥接HDC/ASCT | ORR 92%,CR率74%;中位随访20.9个月:预估接受移植患者的2年OS率69.8%;总人群2年OS率62.6% |
| Herrera等[31] | BV+纳武利尤单抗 | Ⅰ~Ⅱ期 | 复发难治cHL91例 | ORR 85%,CR率67%,2年PFS率79%(95% CI 68%~87%);2年OS率94%(95% CI 85%~ 97%),BV+纳武利尤单抗治疗后接受HDC/ASCT的患者2年PFS率91% |
| Evens等[32] | BV+AVD方案 | Ⅱ期 | 老年初治cHL患者48例 | ORR 95%,CR率90%,2年PFS率84%(95%CI 69%~92%),2年OS率93%(95%CI 80%~98%) |
| Friedberg等[33]、Yasenchak等[34,35]、Forero-Torres等[36](SGN35-015) | A组:BV;B组:BV+达卡巴嗪;C组:BV+苯达莫司汀;D组:BV+纳武利尤单抗 | Ⅱ期 | 老年cHL患者:A组25例,B组19例,C组17例,D组19例 | A组:ORR 92%,CR率72%,中位DOR 9.1个月,中位PFS时间10.48个月,中位OS时间82个月;B组:ORR 100%,CR率68%,中位DOR 45.4个月,中位PFS时间46.75个月,中位OS时间未达到;C组:ORR 100%,CR率88%,中位DOR 39.0个月,中位PFS时间40.34个月,中位OS时间46.9个月;D组:ORR 95%,CR率79%,中位DOR、PFS、OS时间均未达到 |
注:BV为维布妥昔单抗;cHL为经典型霍奇金淋巴瘤;ALCL为间变性大细胞淋巴瘤;HDC为高剂量化疗;ASCT为自体造血干细胞移植;ORR为客观缓解率;PFS为无进展生存;OS为总生存;CR为完全缓解;DOR为缓解持续时间;AVD方案为多柔比星+长春新碱+达卡巴嗪;ABVD方案为多柔比星+博来霉素+长春新碱+达卡巴嗪;ICE方案为异环磷酰胺+卡铂+依托泊苷;ESHAP方案为依托泊苷+甲泼尼龙+阿糖胞苷+顺铂;DHAP方案为顺铂+阿糖胞苷+地塞米松
基于BV在复发难治cHL患者中开展的关键Ⅱ期研究SGN35-0003、C25010[19,20],我国批准BV用于复发难治cHL患者。Younes等[19]、Chen等[20]的研究结果确认了BV对于复发难治cHL患者的疗效,首次治疗后随访5年,使用BV获得CR的复发难治cHL患者5年OS率为64%,达到潜在临床治愈[20]。一项Ⅱ期、开放标签、多中心试验SGN35-006[21]评估了既往BV治疗后出现缓解[CR或部分缓解(PR)]的患者再治疗的效果,结果显示对既往有BV治疗史的复发难治cHL患者,接受BV再治疗依然可以临床获益。
基于AETHERA研究的结果[22,23],美国和欧盟等国家或地区批准BV用于复发或进展高风险cHL患者接受ASCT后的巩固治疗。AETHERA研究显示cHL患者接受高剂量化疗(HDC)/ASCT后,使用BV与安慰剂相比,疾病进展风险下降48%,BV巩固治疗显著延迟了后续治疗的开始时间[22,23],ASCT已明确对cHL有治愈作用,使用BV巩固治疗后能进一步增加患者获得治愈的机会[20]。
基于ECHELON-1研究结果[24],美国和欧盟等国家或地区批准BV联合化疗用于初治的Ⅲ~Ⅳ期cHL患者。ECHELON-1研究5年随访结果证实,在初治Ⅲ~Ⅳ期cHL患者中,应用BV+AVD(多柔比星、长春新碱和达卡巴嗪)方案较ABVD(多柔比星、博来霉素、长春新碱、达卡巴嗪)方案PFS获益更显著,且无论PET-2阴性或阳性,在5年的随访中,超过80%接受BV+AVD方案治疗的患者持续缓解,与ABVD方案相比,发生疾病进展和死亡事件的风险降低32%(HR=0.68,P=0.002)[24]。
常规挽救疗法对复发难治cHL的ORR为62%~89%,CR率只有10%~41%。几项研究证实了BV联合方案在二线治疗HDC/ASCT之前使用,有利于获得更高的CR率,使更多患者获得移植的机会,如BV+ICE(异环磷酰胺、卡铂、依托泊苷)方案[37]、BV+ESHAP(依托泊苷、甲泼尼龙、阿糖胞苷、顺铂)方案[26]、BV+DHAP(顺铂、阿糖胞苷、地塞米松)方案[38]、BV+苯达莫司汀以及BV+纳武利尤单抗。
老年cHL患者(通常年龄>60岁)占cHL的20%~30%,5年PFS和OS率分别为30%~48%和40%~58%。相较于年轻患者,老年患者预后差的部分原因是存在合并疾病、治疗相关不良反应及博来霉素相关肺部不良反应发生率很高。Evens等[32]的研究及SGN35-015研究(NCT01716806)[33,34,35,36]结果显示,在老年cHL患者中BV单药或联合治疗显示出高缓解率、持久治疗时间以及可耐受的不良反应。
(1)对于复发难治cHL,与SGN035-0003研究一致,BV单药治疗是复发难治cHL患者二线及以上治疗的安全有效选择。与SGN35-006研究一致,对于既往BV治疗后出现缓解(CR或PR)的患者再治疗仍然有效。(2)对于ASCT后巩固治疗,与AETHERA研究一致,BV较安慰剂对照,可降低高危患者的复发或进展风险。部分携带高危因素的复发患者在ASCT后可选择BV巩固治疗。(3)对于BV联合方案用于二线挽救治疗,与表2中多个研究一致,BV+程序性死亡受体1(PD-1)单抗、BV+化疗、BV+苯达莫司汀可以考虑作为复发难治cHL的挽救治疗选择,使得更多患者达到CR,能有机会接受ASCT巩固,但是与化疗联合需要注意不良反应的监测及处理。(4)对于初治Ⅲ~Ⅳ期cHL患者,与ECHELON-1研究一致,该类患者可选择BV+AVD方案。建议所有接受BV+AVD方案治疗患者进行G-CSF一级预防;不良反应周围神经病变随时间改善明显。(5)对于老年患者,与SGN35-015研究一致,>60岁cHL患者的初治治疗,可选择如下方案:BV+DTIC(达卡巴嗪);BV序贯AVD方案,若BV用药后患者达CR或PR,则后续继续BV治疗。
一项多中心、开放标签、Ⅱ期临床试验(SGN35-012)旨在评估BV治疗复发难治非霍奇金淋巴瘤(NHL)的疗效和安全性,已证实BV单药在复发难治DLBCL中疗效良好,48例DLBCL患者ORR为44%,CR率为17%[14]。一项探索纳武利尤单抗联合BV治疗PMBL的Ⅱ期研究结果显示,ORR为73%,CR率为37%,中位PFS时间为26个月[39]。根据前期结果,目前一项针对CD30阳性DLBCL的Ⅲ期ECHELON-3研究正在进行中,该研究比较BV+来那度胺+利妥昔单抗联合方案与安慰剂+来那度胺+利妥昔单抗方案在复发难治DLBCL患者中的疗效[40]。
BV目前尚未获批CD30阳性BCL的适应证,此次给出的具体治疗建议主要参考美国国立综合癌症网络(NCCN)指南,建议如下:与SGN35-012研究一致,对于不适合移植、二线及以上治疗的CD30阳性DLBCL患者可考虑BV治疗;对于原发纵隔大B细胞淋巴瘤(PMBL)患者可选择BV联合PD-1单抗治疗;对于其他CD30阳性淋巴瘤患者,可招募适合的患者纳入靶向CD30单药或联合治疗的临床研究。
在关键Ⅱ~Ⅲ期研究中,接受BV单药治疗患者最常见(≥10%)的不良反应是感染、周围神经病变、恶心、疲劳、腹泻、发热、上呼吸道感染、中性粒细胞减少、皮疹、咳嗽、呕吐、关节痛、输液相关反应、瘙痒、便秘、呼吸困难、体质量减轻、肌痛和腹痛,大多数不良反应可控[11,12,14,15,17,19,20]。
在BV联合治疗的关键Ⅲ期研究中,最常见(≥10%)的不良反应为感染、中性粒细胞减少症、周围感觉神经病变、恶心、便秘、呕吐、腹泻、疲劳、发热、脱发、贫血、体质量下降、口腔炎、发热性中性粒细胞减少症、腹痛、食欲下降、失眠、骨痛、皮疹、咳嗽、呼吸困难、关节痛、肌痛、背痛、周围运动神经病变、上呼吸道感染和眩晕。
导致BV治疗停止的最常见的不良反应是周围神经病变[14,15,24],处理建议见表4。中性粒细胞减少症的处理建议见表5。

维布妥昔单抗相关周围神经病变的处理建议
维布妥昔单抗相关周围神经病变的处理建议
| 分级 | CTCAE标准 | 单药治疗 | 联合AVD方案治疗 | 联合CHP方案治疗 |
|---|---|---|---|---|
| 1 | 感觉异常和(或)反射丧失,但无功能丧失 | 继续采用相同剂量和给药方案 | 继续采用相同剂量和给药方案 | 继续采用相同剂量和给药方案 |
| 2 | 影响功能,但不影响日常生活活动 | 暂停给药,直至不良反应恢复至≤1级或基线水平,然后重新开始治疗并将剂量降至1.2 mg/kg,每3周1次 | 剂量降至0.9 mg/kg,最高90 mg,每2周1次 | 感觉神经病变:以相同剂量水平继续治疗;运动神经病变:剂量降至1.2 mg/kg,最多120 mg每3周1次 |
| 3 | 影响日常生活活动 | 暂停给药,直至不良反应恢复至≤1级或基线水平,然后重新开始治疗并将剂量降至1.2 mg/kg,每3周1次 | 暂停给药,直至不良反应恢复到≤2级或基线水平,然后重新开始治疗并将剂量降至0.9 mg/kg,双周方案 | 感觉神经病变:将剂量降至1.2 mg/kg,最多120 mg每3周1次;运动神经病变:停止治疗 |
| 4 | 致残的感觉神经病或危及生命或导致瘫痪的运动神经病 | 停止治疗 | 停止治疗 | 停止治疗 |
注:根据美国国家癌症研究所不良事件通用术语标准(CTCAE)v4.O3分级;AVD方案为多柔比星+长春新碱+达卡巴嗪;CHP方案为环磷酰胺+多柔比星+泼尼松

维布妥昔单抗相关中性粒细胞减少症处理建议
维布妥昔单抗相关中性粒细胞减少症处理建议
| 分级 | CTCAE标准 | 单药治疗 | 联合AVD或CHP方案治疗 |
|---|---|---|---|
| 1 | ≥1 500/mm3且<正常值下限(≥1.5×109/L且<正常值下限) | 继续采用相同剂量和给药方案 | 继续采用相同剂量和给药方案;建议所有接受联合治疗的患者从第1剂开始预防使用G-CSF |
| 2 | ≥1 000/mm3且<1 500/mm3(≥1.0×109/L且<1.5×109/L) | 继续采用相同剂量和给药方案 | 继续采用相同剂量和给药方案;建议所有接受联合治疗的患者从第1剂开始预防使用G-CSF |
| 3 | ≥500/mm3且<1 000/mm3(≥0.5× 109/L且<1.0×109/L) | 暂停给药,直至不良反应恢复至≤2级或基线水平,然后采用相同剂量和给药方案a重新开始治疗;若出现3或4级b中性粒细胞减少症,应在后续周期中考虑使用G-CSF支持治疗 | 建议之前未接受G-CSF治疗的所有患者在后续治疗中使用G-CSF |
| 4 | <500/mm3(<0.5 ×109/L) | 暂停给药,直至不良反应恢复至≤2级或基线水平,然后采用相同剂量和给药方案a重新开始治疗;若出现3或4级b中性粒细胞减少症,应在后续周期中考虑使用G-CSF支持治疗 | 建议之前未接受G-CSF治疗的所有患者在后续治疗中使用G-CSF |
注:根据美国国家癌症研究所不良事件通用术语标准(CTCAE)v4.03分级;G-CSF为粒细胞集落刺激因子;a未发展为3或4级淋巴细胞减少症的患者可继续治疗而无需中断;对于接受G-CSF治疗的患者,再次发生4级中性粒细胞减少症时,考虑暂停给药或将剂量降至1.2 mg/kg,最多120 mg每3周1次;AVD方案为多柔比星+长春新碱+达卡巴嗪;CHP方案为环磷酰胺+多柔比星+泼尼松
BV诱导的周围神经病变为BV累积暴露的典型效应,且在大部分患者中可逆。在临床研究中,大多数患者的症状有所改善或缓解。应对患者的神经病变症状进行监测,如触觉减退、感觉过敏、感觉异常、不适、烧灼感、神经病性疼痛或虚弱。新发周围神经病变或周围神经病变加重的患者可能需要延迟BV给药或降低剂量或中止治疗。
如果发生输液相关反应,应立即中断输液,并采取适当的治疗。在症状缓解后,可低速恢复输液。对于既往发生过输液相关反应的患者,应在后续输液前采取预防用药。预防用药包括对乙酰氨基酚、抗组胺药物和糖皮质激素。
肿瘤增殖迅速和肿瘤负荷高的患者存在发生肿瘤溶解综合征的风险。应对上述患者进行密切监测,并根据最佳医疗实践进行治疗。治疗措施包括:强制水化、肾功能监测、纠正电解质异常、抗高尿酸血症治疗和支持性治疗。
警惕患者可能存在未注意到的进行性多灶性白质脑病提示症状(如认知、神经或精神症状)。
应密切监测新发腹痛或腹痛加剧患者。患者评估可包括体格检查、血清淀粉酶和血清脂肪酶的实验室评估以及腹部影像学检查。
实验室检查:氨基转移酶酶和(或)胆红素升高;患者自述:疲劳、厌食、右上腹部不适、尿色深或黄疸。如果出现新的、恶化的或复发的肝脏不良反应,建议延迟给药、改变剂量或停药。
咳嗽、呼吸困难、肺部X线和CT发现的间质浸润和(或)间质性肺炎。如果出现新的或恶化的肺部症状,在评估期间暂停给药直至症状改善。禁止BV与博来霉素联合使用。
在维布妥昔单抗治疗中,有发生Stevens-Johnson综合征(SJS)、中毒性表皮坏死松解症(TEN)及包括致死性结局的报告。若发生SJS或TEN,应终止维布妥昔单抗给药,并提供适当治疗。
重度肾损害(肌酐清除率<30 ml/min)患者避免使用BV。中度(Child Pugh B级)或重度(Child Pugh C级)肝损害患者避免使用BV治疗。根据群体药代动力学分析,老年患者安全性特征与成年患者一致,因此≥65岁患者的给药建议与成年人相同。
淋巴瘤威胁着人类健康,传统治疗手段存在局限性,非选择性带来的细胞毒性和耐药等限制了其进一步效用。随着基因组和生物标志物检测技术的飞速发展及新型抗肿瘤药物的研发与应用,淋巴瘤治疗已经迈入了精准治疗时代,CD30阳性已从淋巴瘤诊断标志物逐渐转变为治疗决策制订相关标志物,本共识专家组成员希望基于现有临床研究证据和病理、血液、肿瘤专家的临床经验,针对我国人群,为临床治疗提供依据,帮助大部分医疗机构中的CD30阳性淋巴瘤诊断与治疗进一步规范化,改善我国CD30阳性淋巴瘤患者的诊治现状,提高患者生存率和生命质量。
主要执笔者 李小秋、赵东陆、林宁晶
主编 马军、朱军、吴德沛、宋玉琴
主审专家 沈志祥、黄晓军、王建祥
专家组成员(按姓氏汉语拼音排列) 白鸥(吉林大学第一医院)、鲍慧铮(吉林省肿瘤医院)、蔡清清(中山大学肿瘤防治中心)、曹军宁(复旦大学附属肿瘤医院)、岑宏(广西医科大学附属肿瘤医院)、崔国惠(华中科技大学同济医学院附属协和医院)、丁凯阳(安徽省肿瘤医院)、郝思国(上海交通大学医学院附属新华医院)、黄慧强(中山大学肿瘤防治中心)、黄晓军(北京大学人民医院)、姜志平(中南大学湘雅医院)、金洁(浙江大学医学院附属第一医院)、李建勇(江苏省人民医院)、李文瑜(广东省人民医院)、李小秋(复旦大学附属肿瘤医院)、李志铭(中山大学肿瘤防治中心)、梁蓉(空军军医大学西京医院)、林宁晶(北京大学肿瘤医院)、林桐瑜(四川省肿瘤医院研究所)、刘爱春(哈尔滨医科大学附属肿瘤医院)、刘丽宏(河北医科大学第四医院东院)、刘澎(复旦大学附属中山医院)、马军(哈尔滨血液病肿瘤研究所)、牛挺(四川大学华西医院)、钱文斌(浙江大学医学院附属第二医院)、邱录贵(中国医学科学院血液学研究所血液病医院)、沈建箴(福建医科大学附属协和医院)、沈志祥(上海交通大学医学院附属瑞金医院)、宋永平(郑州大学第一附属医院)、宋玉琴(北京大学肿瘤医院)、苏丽萍(山西省肿瘤医院)、陶荣(复旦大学附属肿瘤医院)、王建祥(中国医学科学院北京协和医学院血液病医院)、王鲁群(山东大学齐鲁医院)、吴德沛(苏州大学附属第一医院)、徐卫(江苏省人民医院)、薛宏伟(青岛大学附属医院)、杨申淼(北京大学人民医院)、张会来(天津市肿瘤医院)、张明智(郑州大学第一附属医院)、张薇(北京协和医院)、张延清(哈尔滨医科大学附属第二医院)、赵东陆(哈尔滨血液病肿瘤研究所)、赵维莅(上海交通大学医学院附属瑞金医院)、周道斌(北京协和医院)、周辉(湖南省肿瘤医院)、周生余(中国医学科学院肿瘤医院)、朱军(北京大学肿瘤医院)、邹德慧(中国医学科学院血液学研究所血液病医院)、邹立群(四川大学华西医院)
所有作者均声明不存在利益冲突


























