
探讨多靶点粪便DNA与粪便潜血(FIT-DNA)联合检测技术对结直肠癌及进展期腺瘤的临床诊断价值。
纳入中国医学科学院肿瘤医院2021年4月至2022年1月拟行肠镜检查的门诊筛查患者及结直肠外科待手术的肠癌患者235例,其中男141例,女94例,年龄22~86(55±13)岁。包括初诊未治疗组215例(结直肠癌患者86例、进展期腺瘤患者12例、非进展期腺瘤患者25例、一般性息肉患者8例、表观健康人84名)和干扰组20例(既往行结直肠癌根治术患者2例、既往行内镜黏膜剥离术患者6例、非肠癌的特殊疾病患者4例以及行新辅助放化疗的肠癌患者8例)。取肠道准备前的新鲜粪便样本进行FIT-DNA联合检测,样本处理和核酸纯化采用FIT-DNA 检测试剂盒;采用荧光探针法检测KRAS突变和BMP3、NDRG4基因甲基化;采用免疫法检测便潜血。以结直肠镜或病理活检结果为金标准,采用受试者工作特征(ROC)曲线评估FIT-DNA联合检测技术对结直肠癌及进展期腺瘤的筛查及诊断效能。
FIT-DNA联合检测技术对早期结直肠癌和进展期腺瘤的筛查灵敏度分别为7/7和8/12,阴性预测值分别为98.1%(104/106)和93.7%(104/111);对早期结直肠癌和进展期腺瘤的总体筛查灵敏度为15/19,阴性预测值为96.3%(104/108);曲线下面积(AUC)分别为0.982(95%CI:0.960~1.000,P<0.05)、0.758(95%CI:0.592~0.924,P<0.05)和0.841(95%CI:0.724~0.957,P<0.05)。FIT-DNA联合检测技术对结直肠癌的诊断灵敏度为98.8%(85/86),对进展期腺瘤的诊断灵敏度为8/12,对结直肠癌和进展期腺瘤的总体诊断灵敏度为94.9%(93/98),特异度为88.9%(104/117);AUC分别为0.968(95%CI:0.937~0.997,P<0.05)、0.758(95%CI:0.592~0.924,P<0.05)和0.942(95%CI:0.905~0.979,P<0.05)。纳入干扰组后,FIT-DNA 联合检测技术的总体诊断灵敏度为91.6%(98/107),特异度为89.1%(114/128)。
FIT-DNA 联合检测技术对结直肠癌具有较高的早期筛查效能和诊断效能。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
结直肠癌(colorectal cancer,CRC)是最常发生的恶性肿瘤之一,在所有新发恶性肿瘤中占10 %,居全球第三,而死亡率仅次于肺癌,占9.4%[1]。随着我国社会经济发展、居民生活方式转变以及人口老龄化的加剧,我国CRC发病率和死亡率呈现明显上升趋势。2019年国家癌症中心发布的中国肿瘤登记年报显示,2015年我国CRC每年新发病例达38.8万例,年新增死亡病例达18.7万例[2]。CRC普遍由大肠息肉和(或)腺瘤等癌前病变演变而来[3, 4],其发展过程相对缓慢(10~15年),为癌前病变的早诊早治和阻止癌变提供了较长的窗口期。相关研究提示,越早期发现CRC或癌前病变,患者的生存率越高[5]。然而,CRC早期症状并不特异,80%以上CRC患者发现时已是中晚期,近50%的CRC患者会出现复发转移,5年生存率不到20%[6]。因此,在结直肠肿瘤的预防管理方面,早期筛查、早期发现和及时干预治疗将有助于发现CRC及早期病变,从而降低死亡率。
CRC发生发展是一个多因素、多步骤、多阶段的病变进程[7]。携带肿瘤突变信号的异常细胞会脱落到粪便中,粪便中含有足量DNA可供捕获到肿瘤信号,通过检测粪便里的脱落细胞可以有效捕获肿瘤的突变基因,为早期大肠癌的分子检测提供了理论基础[8]。CRC的早期DNA标志物众多。原癌基因KRAS突变是CRC发生的重要早期事件,基因突变发生率高达45%[9]。而抑癌基因启动子高甲基化也是肿瘤发生的另一重要机制,已有研究证实肿瘤抑制因子BMP3、NDRG4高度甲基化是CRC早期的重要生物学特征[10]。因此,联合检测多个相关基因要比单个突变更加敏感[11, 12]。
结直肠镜检查及病理活组织检查虽然是诊断CRC的金标准,但由于其具有侵入性,加之繁琐的肠道准备、患者恐惧心理及医疗资源不足等因素,其无法成为常规的筛查方法[13]。近年来,多靶点粪便DNA与粪便潜血(multi-target stool fecal immunochemical test-DNA,FIT-DNA)联合检测技术应运而生,相较于侵入性的结肠镜检查,其具有无创简便的优点[14]。尽管之前有部分研究报道了FIT-DNA联合检测技术对于CRC患者的筛查效能评估,但尚未见明确区分该技术对早期诊断和早期筛查的临床价值评估,尤其是对于伺机性筛查高危人群的分类[15, 16, 17]。本研究采用盲法,前瞻性地纳入伺机筛查患者进行 FIT-DNA联合检测技术的临床预测效能评估,旨在探索CRC早期筛查与辅助诊断的实施模式。
1.对象:本研究通过中国医学科学院肿瘤医院伦理委员会批准(伦理审批号:22/139-3340),所有受试者均签署知情同意书。前瞻性地纳入中国医学科学院肿瘤医院2021年4月至2022年1月拟行肠镜检查的门诊筛查患者及结直肠外科待手术的CRC患者315例,进行伺机性筛查。其中235例为有效受试者,均接受了肠镜确诊和(或)病理确诊,包括男141例,女94例,年龄22~86(55±13)岁;另有80例因未接受FIT-DNA联合检测或肠镜/病理确诊,被剔除本研究。在本研究中,早期CRC(简称早癌)定义为局限于结直肠黏膜层及黏膜下层、未累及固有肌层的癌[18],包括1例0期和6例Ⅰ期患者。结直肠进展期新生物定义为CRC和进展期腺瘤。进展期腺瘤诊断依据为:(1)直径≥1 cm;(2)高级别上皮内瘤变;(3)具有25%以上绒毛成分;满足以上任意1条即可。
2.初诊且未治疗组:215例,包括CRC患者86例、进展期腺瘤患者12例、非进展期腺瘤患者25例、一般性息肉患者8例、表观健康人84名。(1)纳入标准:年龄>18岁,性别不限;受检指征为体检或具有非特异性症状,例如:腹痛、腹泻、便血、体重下降、肿瘤标志物升高等;待行内镜手术或外科手术;(2)排除标准:既往有结直肠肿瘤手术史或已行新辅助放化疗治疗者;过去1个月内有结肠镜检查史;半年内有急性心肌梗死病史,有严重的心肺功能不全等不适宜肠镜检查的疾病状态;正在服用抗凝药物、黄连素药物、甲基化药物等;明显血便、柏油便者。
3.干扰组:20例,包括其他疾病的非CRC患者4例、肠病治疗史患者6例(既往行内镜黏膜剥离术)以及具有CRC治疗史的患者10例(包括既往行CRC根治术患者2例与新辅助放化疗的CRC患者8例)。与初诊未治疗组为同一队列,但入选标准更为宽泛。包括非肠病的其他疾病患者,以及经过治疗的肠病患者。治疗方式包括:在粪便检测前已行CRC或癌前病变切除术、新辅助放化疗等。
1. 样本处理及检测:取肠道准备前的新鲜粪便样本进行FIT-DNA联合检测,所有粪便样本在检测过程中,其个人信息和临床诊断结果均为盲态,所有样本检测结束后集体揭盲。样本处理和核酸纯化采用FIT-DNA 检测试剂盒(常卫清®,杭州诺辉健康科技有限公司)。样本采集后1 h内进行处理,采用荧光探针法检测KRAS突变和BMP3、NDRG4基因甲基化;采用免疫法检测便潜血。核酸扩增采用Applied Biosystems®7500实时荧光定量PCR仪(美国赛默飞公司)。
2. 结果判定:采用配套的分析软件进行综合评分,该分析软件作为该试剂盒注册资料的一部分,已被中国国家医药管理局批准为二类软件(浙械注准20202210848),算法和权重因子已被锁定其中。具体计算公式是基于机器学习中的逻辑回归模型确定,阈值为165分。分值≥165分为阳性,表示受检者体内可能有CRC或进展期腺瘤,需要进一步接受肠镜检查;反之,分值<165分为阴性,表示受检者体内有CRC和进展期腺瘤的可能性低,但并不能完全排除疾病风险。
采用IBM SPSS 26.0软件进行数据分析。计数资料以频数及百分率表示。以结直肠镜或病理活检结果为金标准,采用受试者工作特征(receiver operator curves,ROC)曲线评估FIT-DNA联合检测技术对CRC及进展期腺瘤的筛查和诊断效能。双侧检验,检验水准α=0.05。
初诊未治疗组患者性别、年龄与相关的FIT-DNA联合检测结果如表1所示。86例CRC(包括早癌)患者中,FIT-DNA阳性占98.8%(85/86);其中,69.8%(60/86)为腺癌,8.1%(7/86)是黏液癌,22.1%(19/86)为其他组织学类型。大部分患者的肿瘤位置在直肠(53.5%,46/86)和乙状结肠(18.6%,16/86),少部分患者的肿瘤位置为右半结肠(升结肠和横结肠),占11.6%(10/86)。中、低分化CRC分别占59.3%(51/86)和29.1%(25/86)。此外,0期CRC有1例,Ⅰ期CRC有15例,Ⅱ期CRC有28例,Ⅲ期CRC有36例,Ⅳ期CRC有6例,除Ⅲ期CRC的FIT-DNA阳性检出率为97.2%(35/36)外,其他分期的CRC患者中FIT-DNA阳性检出率为100.0%(50/50)。早癌组中FIT-DNA阳性检出率为7/7,其中1例分期为0期,另外6例为Ⅰ期。进展期腺瘤患者中,FIT-DNA阳性检出率为8/12。息肉患者(包括一般性息肉及非进展期腺瘤)中,FIT-DNA阳性检出率为75.8%(25/33)。表观健康组中,FIT-DNA阳性检出率为6.0%(5/84)。86例CRC患者的临床信息详见表2。
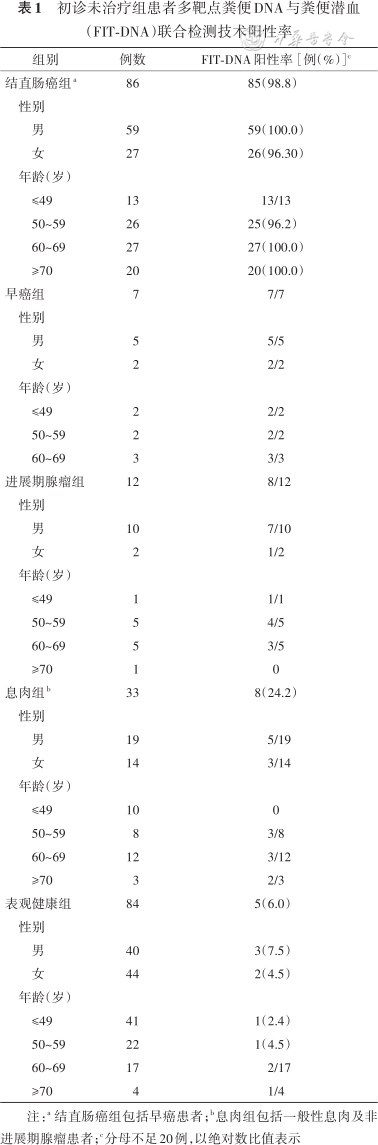
初诊未治疗组患者多靶点粪便DNA与粪便潜血(FIT-DNA)联合检测技术阳性率
初诊未治疗组患者多靶点粪便DNA与粪便潜血(FIT-DNA)联合检测技术阳性率
| 组别 | 例数 | FIT-DNA阳性率[例(%)]c |
|---|---|---|
| 结直肠癌组a | 86 | 85(98.8) |
| 性别 | ||
| 男 | 59 | 59(100.0) |
| 女 | 27 | 26(96.30) |
| 年龄(岁) | ||
| ≤49 | 13 | 13/13 |
| 50~59 | 26 | 25(96.2) |
| 60~69 | 27 | 27(100.0) |
| ≥70 | 20 | 20(100.0) |
| 早癌组 | 7 | 7/7 |
| 性别 | ||
| 男 | 5 | 5/5 |
| 女 | 2 | 2/2 |
| 年龄(岁) | ||
| ≤49 | 2 | 2/2 |
| 50~59 | 2 | 2/2 |
| 60~69 | 3 | 3/3 |
| 进展期腺瘤组 | 12 | 8/12 |
| 性别 | ||
| 男 | 10 | 7/10 |
| 女 | 2 | 1/2 |
| 年龄(岁) | ||
| ≤49 | 1 | 1/1 |
| 50~59 | 5 | 4/5 |
| 60~69 | 5 | 3/5 |
| ≥70 | 1 | 0 |
| 息肉组b | 33 | 8(24.2) |
| 性别 | ||
| 男 | 19 | 5/19 |
| 女 | 14 | 3/14 |
| 年龄(岁) | ||
| ≤49 | 10 | 0 |
| 50~59 | 8 | 3/8 |
| 60~69 | 12 | 3/12 |
| ≥70 | 3 | 2/3 |
| 表观健康组 | 84 | 5(6.0) |
| 性别 | ||
| 男 | 40 | 3(7.5) |
| 女 | 44 | 2(4.5) |
| 年龄(岁) | ||
| ≤49 | 41 | 1(2.4) |
| 50~59 | 22 | 1(4.5) |
| 60~69 | 17 | 2/17 |
| ≥70 | 4 | 1/4 |
注:a 结直肠癌组包括早癌患者;b息肉组包括一般性息肉及非进展期腺瘤患者;c分母不足20例,以绝对数比值表示
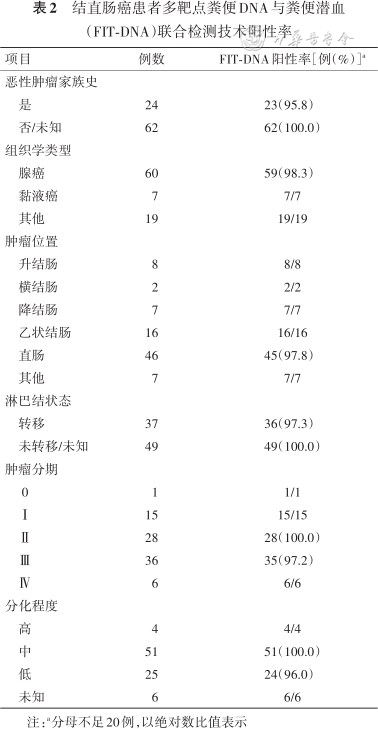
结直肠癌患者多靶点粪便DNA与粪便潜血(FIT-DNA)联合检测技术阳性率
结直肠癌患者多靶点粪便DNA与粪便潜血(FIT-DNA)联合检测技术阳性率
| 项目 | 例数 | FIT-DNA阳性率[例(%)]a |
|---|---|---|
| 恶性肿瘤家族史 | ||
| 是 | 24 | 23(95.8) |
| 否/未知 | 62 | 62(100.0) |
| 组织学类型 | ||
| 腺癌 | 60 | 59(98.3) |
| 黏液癌 | 7 | 7/7 |
| 其他 | 19 | 19/19 |
| 肿瘤位置 | ||
| 升结肠 | 8 | 8/8 |
| 横结肠 | 2 | 2/2 |
| 降结肠 | 7 | 7/7 |
| 乙状结肠 | 16 | 16/16 |
| 直肠 | 46 | 45(97.8) |
| 其他 | 7 | 7/7 |
| 淋巴结状态 | ||
| 转移 | 37 | 36(97.3) |
| 未转移/未知 | 49 | 49(100.0) |
| 肿瘤分期 | ||
| 0 | 1 | 1/1 |
| Ⅰ | 15 | 15/15 |
| Ⅱ | 28 | 28(100.0) |
| Ⅲ | 36 | 35(97.2) |
| Ⅳ | 6 | 6/6 |
| 分化程度 | ||
| 高 | 4 | 4/4 |
| 中 | 51 | 51(100.0) |
| 低 | 25 | 24(96.0) |
| 未知 | 6 | 6/6 |
注:a分母不足20例,以绝对数比值表示
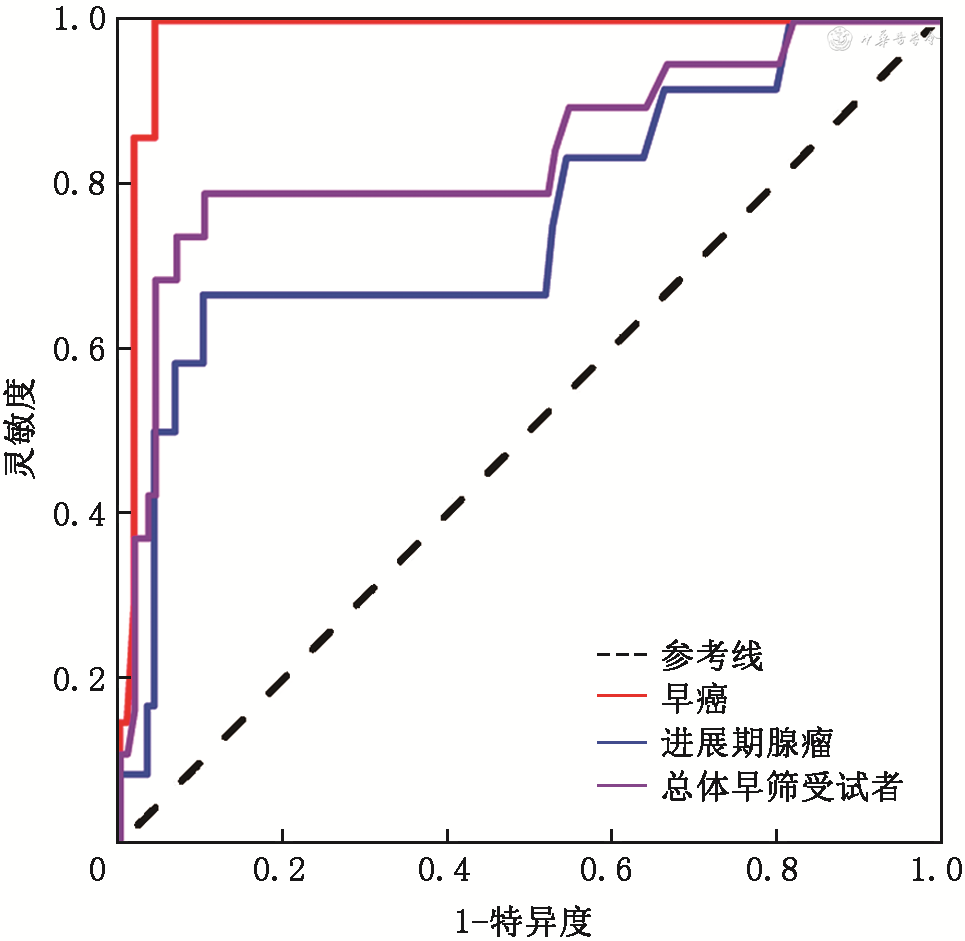
评估筛查效能主要针对7例早癌患者和12例进展期腺瘤患者,这两类患者发病隐匿,无明显特异性症状,是重点高危筛查对象。FIT-DNA联合检测技术对7例早癌患者和12例进展期腺瘤患者的筛查灵敏度为78.95%(15/19),阴性预测值为96.30%(104/108)。针对早癌和进展期腺瘤的灵敏度分别为100.00%(7/7)和66.67%(8/12),阴性预测值分别为98.11%(104/106)和93.69%(104/111)。通过ROC曲线分析,FIT-DNA 联合检测技术对早癌、进展期腺瘤及总体早筛受试者的诊断效能评估,曲线下面积(area under curve,AUC)分别为0.982(95%CI:0.960~1.000,P<0.05)、0.758(95%CI:0.592~0.924,P<0.05)和0.841(95%CI:0.724~0.957,P<0.05)(图1),提示FIT-DNA联合检测技术对早癌的筛查能力较好。

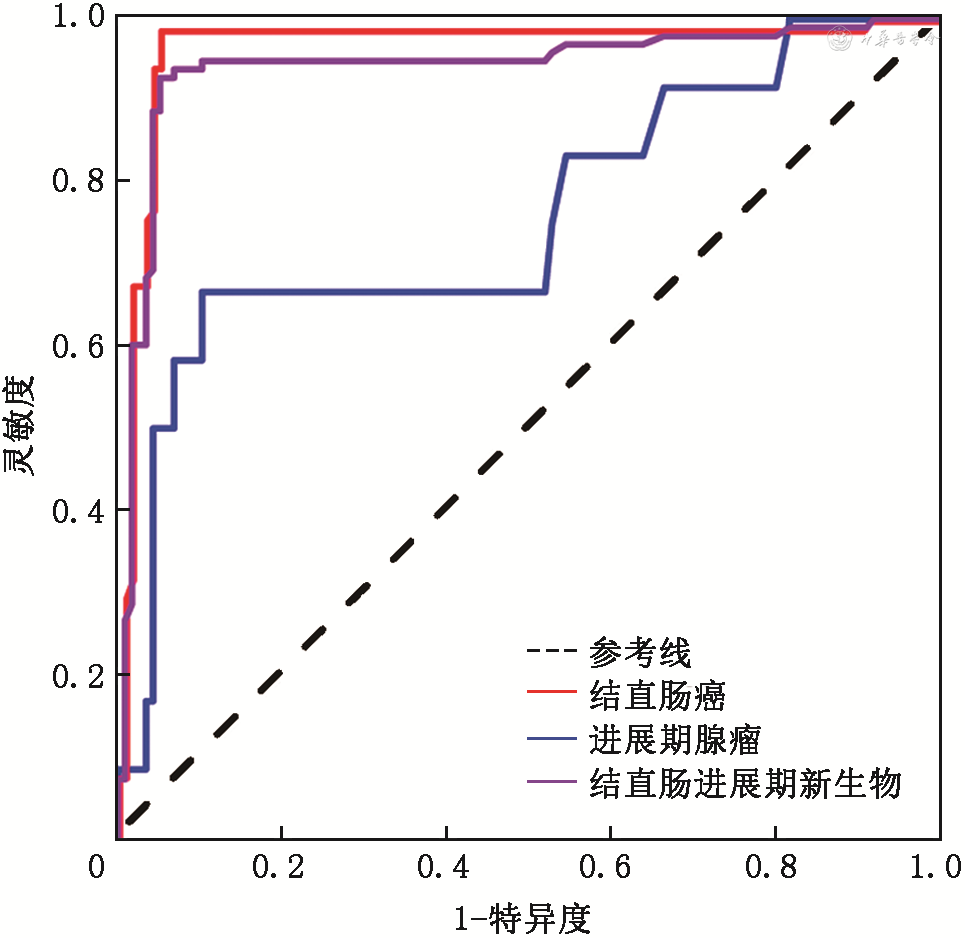
1.结直肠进展期新生物患者:包括86例CRC患者及12例进展期腺瘤患者。FIT-DNA联合检测技术诊断结直肠进展期新生物的灵敏度为94.90%(93/98),特异度为88.89%(104/117);其中对于CRC患者的诊断灵敏度为98.84%(85/86),对于进展期腺瘤的诊断灵敏度为66.67%(8/12)。通过ROC曲线分析,FIT-DNA 联合检测技术对CRC、进展期腺瘤和结直肠进展期新生物的诊断效能,AUC分别为0.968(95%CI:0.939~0.997,P<0.05)、0.758(95%CI:0.592~0.924,P<0.05)和0.942(95%CI:0.905~0.979,P<0.05)(图2)。提示FIT-DNA 联合检测技术对结直肠进展期新生物具有较强的诊断效能,其中对CRC的诊断效能优于进展期腺瘤。

2.纳入干扰组:为进一步分析FIT-DNA联合检测技术的诊断效能,本研究纳入了20例干扰组患者。纳入干扰组后,FIT-DNA 对结直肠进展期新生物诊断的总特异度为89.1%(114/128),对CRC和结直肠进展期新生物的诊断灵敏度分别为94.7%(90/95)、91.6%(98/107)。
在全球范围内,CRC是第三大常见癌症和第四大癌症相关死亡病因[19]。我国的CRC综合发病率和死亡率分别排第三位和第五位,且总体仍呈上升趋势[20]。研究显示,CRC在诊断时已有约 1/4 患者发生远处转移,接受治疗的患者中仍有约一半患者发生转移[21]。目前,结直肠镜与组织病理学检查是术前确诊CRC的金标准,但是由于其侵入性高,患者接受度差,导致肠镜依从性差,不能够及时有效地在早期阶段介入,从而干预癌症的发生发展[22]。FIT-DNA联合检测技术是CRC早期筛查领域的重要突破,以其无创性、高敏感性和特异性为主要优势,成为近年来该领域的热点话题。
从筛查角度分析,本研究纳入的阴性对照组、早癌和进展期腺瘤患者属于伺机性筛查人群(本院腔镜科门诊预约患者)。从辅助诊断角度分析,本研究主要纳入了CRC及经过治疗的肠病患者(结直肠外科病房待手术患者)。本研究结果为FIT-DNA联合检测技术的临床性能评估提供了重要的数据,其中对早癌和进展期腺瘤的阴性预测值分别为98.1%(104/106)和93.7%(104/111),验证了该检测技术对检测早癌及其高危癌前病变的效能,可有效帮助早期筛查,以尽早采用医疗手段干预癌症的发生发展,改善患者的预后,降低死亡率,减少国家卫生经济负担。本研究对于CRC、进展期腺瘤的诊断灵敏度分别为98.8%(85/86)和66.7%(8/12),特异度为88.9%(104/117),表明该检测技术对于辅助诊断早癌也具有较好的临床应用价值。
较既往CRC非侵入性标志物的灵敏度研究,FIT-DNA 联合检测技术在基因检测的设计上采用中国CRC患者特有的BMP3和NDRG4基因甲基化位点,能更加准确地代表中国患者的分子特征[15,23]。除了KRAS突变及BMP3/NDRG4甲基化位点的联合检测外,Lin等[24]发现,单独使用KRAS/BRAF/APC突变的CRC检出率为46.7%,对进展期腺瘤的阳性率为28.3%;SDC2/SFRP2基因位点甲基化试验发现的CRC检出率为83.8%,进展期腺瘤阳性率为72.8%;而当二者联合检测时,对CRC的诊断灵敏度为88.6%,进展期腺瘤的灵敏度为75.0%。此外,最近的报道提出粪便来源的真核RNA联合FIT试验(RNA-FIT)也可作为生物标志物,无创检测CRC及进展期腺瘤[25]。Barnell等[26]发现RNA-FIT联合检测对CRC的灵敏度为95.0%,对进展期腺瘤的灵敏度为62.0%。以上结果表明 FIT-DNA联合检测技术仍是目前CRC筛查和诊断的最具潜力的非侵入性检测工具。
此外,KRAS突变、BMP3/NDRG4甲基化试验联合FIT试验在 CRC 和进展期腺瘤中的疗效诊断中尚未见报道。本研究结果显示,一些术后患者,包括CRC根治术、早癌或进展期腺瘤的内镜下手术患者共计8例,其中6例术后治疗后转归,粪便检测结果也为阴性,1例术后治疗后复发(检测结果阳性),另外1例发生肝转移(检测结果阴性)。综合这8例患者的治疗结局,提示FIT-DNA联合检测技术对于患者的术后监测管理有一定的参考价值,可做进一步验证。本研究还观察到,在7例CRC术前新辅助放化疗的患者中,有3例患者检测结果为阴性,综合结果趋势,提示放化疗可能会影响检测结果。综合既往文献分析推断影响原因,可能与新辅助化疗后肿瘤代谢状态受到抑制有关。Zhou等[27]进行了一项前瞻性多中心研究,比较了新辅助化疗对局部晚期直肠癌患者血液中循环DNA(serial circulating tumor DNA,ctDNA)含量的影响。分析该试验数据结果,在新辅助化疗1个周期后,ctDNA阳性患者的比例明显下降,这表明新辅助化疗可以有效抑制肿瘤代谢,从而在循环系统中可检测到的肿瘤脱落DNA减少。Tie等[28]的研究结果同样证实了新辅助化疗后,局部晚期直肠癌患者ctDNA阳性的比例减少。而粪便DNA检测技术是通过检测粪便中肿瘤脱落细胞的DNA,从而得出有无癌前病变或肿瘤的结论。目前尚未有研究证实新辅助化疗后肿瘤细胞脱落进入肠道的DNA是否会减少,从上述研究推测,干扰组中经过新辅助治疗后的癌症患者,其肿瘤代谢活跃度降低,粪便中脱离的DNA片段减少,因此检测率也降低。
综上所述,本研究对多靶点粪便FIT-DNA联合检测技术进行了CRC筛查和辅助诊断的效能评估,显示其诊断效能优于筛查效能,但尚需通过后续扩大样本量进一步验证其筛查能力。
所有作者均声明不存在利益冲突



























