
疟疾是疟原虫感染所致的地方性传染病,主要在热带和亚热带地区流行。尽管世界卫生组织在2021年6月宣布我国通过了消除疟疾认证,但随着国际交流的日益频繁,我国面临的输入性疟疾威胁将长期存在。为促进临床医师深入了解并合理治疗疟疾,提高疟疾诊治的水平,国内感染病及寄生虫病领域相关专家共同编写了《疟疾诊疗指南》。该指南对疟疾的病原学、流行病学、发病机制、临床表现、实验室检查、诊断及鉴别诊断、治疗、护理、预防等方面进行介绍,并重点强调了应对不同临床状况时的治疗方案,以便临床医师合理应用。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
疟疾(malaria)是由疟原虫感染所致的地方性传染病,主要流行于热带和亚热带地区,典型的临床表现为周期性的寒战、发热、大汗等症状,可伴脾肿大和贫血等体征。恶性疟发热不规则,病死率较高,间日疟和卵形疟常有复发。2021年6月30日,WHO宣布中国通过消除疟疾认证,成为WHO西太平洋区域30多年来第1个获得无疟疾认证的国家[1]。然而,中国消除疟疾并不意味着没有疟疾,随着国际交流合作的日益频繁,国际旅行入境人员的增加,我国面临的输入性疟疾威胁将长期存在[2,3,4]。输入性疟疾的防治已经成为我国保持消除疟疾状态的工作重点,而提高临床医师的诊治能力,对于输入性疟疾的及时发现和有效防治至关重要[5,6,7]。
目前,WHO的疟疾治疗指南是全世界疟疾治疗的共同规范[8],具有一定的普适性,但不一定符合各国实际情况。欧美一些非疟疾流行国家已经根据本国的具体情况发布了本国的疟疾诊治指南[9,10]。我国现有的《疟疾的诊断》[11]和《抗疟药使用规范》[12]在控制和消除疟疾进程中发挥了重要作用,但消除疟疾后临床医师面对的是来自全球不同流行区输入的疟疾病例,不仅输入的虫种与我国本土曾经流行的疟原虫不尽相同,而且其临床症状和治疗需求与我国本土疟疾病例也有较大差异。因此,临床医师迫切需要有适合我国的指南。为此,国家传染病医学中心(浙江大学医学院附属第一医院、复旦大学附属华山医院、首都医科大学附属北京地坛医院)、国家卫生健康委员会重症疟疾救治专家组、WHO消除疟疾研究与培训合作中心和中华医学会感染病学分会、中华医学会热带病与寄生虫病学分会、传染病诊治国家重点实验室等组织相关专家共同制订《疟疾诊疗指南》,以供临床医师参考执行。
人体疟原虫分为间日疟原虫(Plasmodium vivax)、恶性疟原虫(Plasmodium falciparum)、三日疟原虫(Plasmodium malariae)、卵形疟原虫(Plasmodium ovale),以及人猴共患的诺氏疟原虫(Plasmodium knowlesi)(诺氏疟原虫主要经猴→蚊→人传播)。几种疟原虫的生活史基本相同,其完整的生活史需要在人体内和蚊体内两个阶段发育才能完成。
疟原虫在人体内的发育分为在肝细胞内的红外期和红细胞内的红内期两个阶段。
具有传染性的雌性按蚊叮咬人体时,子孢子随按蚊的唾液进入人体血液。子孢子随血流侵入肝细胞,在肝细胞内进行裂体增殖发育,最终发育成裂殖子。裂殖子增殖时间不等,恶性疟原虫为5~6 d,间日疟原虫8 d,卵形疟原虫9 d,三日疟原虫11~12 d。裂殖体成熟后,从受染肝细胞内释放出裂殖子进入血液,并侵入红细胞。
间日疟与卵形疟原虫的子孢子进入肝细胞后,除部分速发型子孢子按上述裂体增殖过程发育成裂殖子并进入血液,另有部分子孢子则进入休眠状态,被称为休眠子或迟发型子孢子,经一段时间(1个月至1年)后被激活并继续发育为成熟裂殖体。间日疟原虫和卵形疟原虫的休眠子或迟发型子孢子与间日疟和卵形疟的复发有关。恶性疟原虫和三日疟原虫无休眠子或迟发型子孢子,因此恶性疟和三日疟不会复发。
侵入红细胞的疟原虫裂殖子继续进行红内期裂体增殖,含成熟裂殖子的红细胞崩解,引起临床发作。所释放出的裂殖子则继续侵入其他红细胞并重复红内期增殖过程,使临床症状呈现周期性发作。经过3~6代的裂体增殖后,部分疟原虫转而发育为配子体,具有传染性。
当患者及无症状带虫者被雌性按蚊叮咬吸血时,配子体随之进入蚊胃内进行配子发育。雌雄配子结合形成合子,合子逐渐发育为动合子,动合子穿过胃壁形成卵囊。卵囊成熟破裂后,子孢子进入按蚊涎腺,待其叮咬人体吸血时,子孢子即被输入至被叮咬者的体内,开始下一轮的感染。
疟疾患者及无症状带虫者是传染源。恶性疟原虫在人体存活一般不超过1年,间日疟原虫可在人体存活约2年,三日疟原虫则可在人体存活超过10年。
以经按蚊叮咬传播为主,少数可经输血传播,偶有患病孕妇经胎盘感染胎儿。诺氏疟原虫可通过猴→蚊→人传播。尽管实验室发现诺氏疟原虫存在人→蚊→人传播的可能,但目前尚缺乏持续人→蚊→人传播的流行病学证据。
除了某些具有遗传特质的人群,不同种族、性别、年龄和职业人群对疟原虫普遍易感。
疟疾分布于全球北纬60°和南纬45°之间的广泛地域。据WHO报道,2020年全球有超过2亿例疟疾病例,60多万例死亡,其中非洲撒哈拉沙漠以南地区疟疾流行最为严重,每年疟疾发病数和死亡数均占全球的90%以上,绝大多数是恶性疟。间日疟是非洲之外的南美洲、东南亚和东地中海地区分布最广泛的疟疾种类,但在东非的埃塞俄比亚等国亦有分布。三日疟和卵形疟多见于非洲和东南亚地区。诺氏疟主要见于马来西亚、印度尼西亚。
我国已消除本土疟疾,但每年仍有4 000余例境外输入性病例,数百例重症疟疾,数十例因疟疾死亡病例,输入来源主要为非洲(撒哈拉沙漠以南国家)和东南亚国家,各种疟疾均有输入,以恶性疟为主,间日疟次之,部分患者可为混合感染[13,14,15,16,17,18,19,20]。
疟原虫侵入血液循环后,除疟原虫本身对机体的损伤外,机体对抗疟原虫的免疫反应,以及产生的多种细胞因子对机体也有损伤,导致一系列临床症状和体征的出现。
疟原虫寄生在红细胞并大量破坏红细胞,使患者迅速出现贫血。贫血的轻重与疟原虫种类和原虫密度有关。间日疟原虫和卵形疟原虫常侵犯年幼的红细胞,受染红细胞一般不超过2%,故贫血较轻;三日疟原虫侵犯衰老红细胞,受染红细胞一般不超过1%,故贫血较不明显。恶性疟原虫能侵犯不同年龄的红细胞,且感染密度较高,故贫血出现较早且显著。诺氏疟原虫在红细胞内的裂体增殖周期为24 h,在短时间内可生成大量的裂殖子,且裂殖子对寄生红细胞的要求不严格,不同发育阶段的红细胞都可受到侵袭,与感染恶性疟原虫相似。为清除疟原虫、代谢排泄物和红细胞碎片,单核吞噬细胞系统细胞增生活跃,故患者常出现脾肿大和脾功能亢进。
恶性疟原虫主要寄生在脑毛细血管内的红细胞中,其感染红细胞的表面有黏性凸起,可黏附于毛细血管的内皮细胞,并通过互相凝集与吸附导致局部毛细血管阻塞及细胞缺氧,可引起严重的水肿及脑细胞损伤,可伴发弥散性血管内凝血(disseminated intravascular coagulation,DIC)。
溶血性尿毒综合征又称黑尿热,主要由血红蛋白和抗原/抗体复合物等大分子物质堵塞肾小球基底膜并引起急性免疫变态反应所致,患者常出现酱油样黑尿、少尿/无尿,以及肌酐和尿素氮等指标急剧升高的急性肾衰竭表现。
潜伏期依疟原虫株的类别而不同。一般而言,恶性疟7~9 d,间日疟11~13 d,三日疟18~35 d,卵形疟11~16 d。但间日疟原虫温带株的潜伏期可长达数月。若系输血感染,各种疟原虫的潜伏期一般在1周左右。
可分为3期,初发者可有低热、乏力、头痛、纳差等前驱症状[21]。首次发作时,发热多不规则,而后逐渐转为有规律的周期性发作。
①发冷期:骤起畏寒、剧烈寒战、口唇发绀、皮肤苍白或带青紫,脉搏快而饱满,可有头痛、肌痛、乏力、恶心、呕吐、上腹部不适等。此期持续10~15 min。反复发作数次后,发冷期可逐渐延长,持续30~45 min。
②发热期:寒战停止,继而高热,常可达39~41 ℃。患者颜面潮红、头痛、口渴。严重者可谵妄、抽搐及昏迷。发热期一般持续2~6 h。
③出汗期:高热后突然大汗,体温骤降,患者感觉明显好转,但困倦思睡。此期持续2~3 h。
整个典型发作历时6~10 h,而间歇期一般无症状。间日疟和卵形疟的发作周期为隔天1次,常见典型的隔天发作现象。发作多始于中午前后至晚上9点以前,偶见于深夜。三日疟隔2 d发作1次,且较规律。恶性疟发热较不规律,发热常达39 ℃以上,且无明显的间歇发作现象。
包括热型不典型(发冷-发热-出汗症状不明显),且发作周期不规律。部分从非洲返回的患者以发热加呼吸系统症状,或发热加消化系统症状,或发热加神经系统症状等为主要表现,易出现误诊。妊娠期疟疾发作可致流产、早产、死产。胎盘屏障受损或分娩过程中母体血污染胎儿伤口可出现先天性疟疾,婴儿出生后不久即可有疟疾发作。年龄越小的儿童症状越不典型,另外可出现发育迟缓、营养不良、贫血、巨脾等表现。
多见于无免疫力人群感染疟疾,虽然4种疟原虫均可引起重症疟疾,但多数由恶性疟原虫所致。以脑型疟较多见。WHO把疟原虫检测阳性且出现下列临床表现之一者,判定为重症疟疾[22]。
成人格拉斯哥昏迷评分<11分,儿童布兰太尔昏迷评分<3分。
全身无力,无法坐、站或行走。
24 h内发作2次以上。
碳酸氢根盐<15 mmol/L或静脉血浆乳酸≥5 mmol/L。
血糖<2.2 mmol/L。
12岁以下儿童血红蛋白≤50 g/L,红细胞压积≤15%;成人血红蛋白<70 g/L;红细胞压积<20%。
血浆或血清肌酐>265 μmol/L或血尿素氮>20 mmol/L。
血浆或血清总胆红素>50 μmol/L。
静息状态下指脉氧饱和度<92%,呼吸频率>30次/min。
包括鼻出血、牙龈或静脉穿刺部位的反复或长期出血、呕血。
代偿性休克定义为毛细血管重新充血≥3 s,但无低血压。失代偿性休克定义为儿童收缩压<70 mmHg(1 mmHg=0.133 kPa)或成人<80 mmHg伴灌注受损表现。
与肝内疟原虫休眠子或迟发型子孢子有关。间日疟和卵形疟患者如仅采用抗红内期疟原虫药物进行治疗,当血液内疟原虫被清除后患者表现为临床治愈,但肝内疟原虫的休眠子或迟发型子孢子经一段时间休眠后可再次发育,进入血液并再次出现临床症状,因此间日疟和卵形疟患者的临床抗疟治疗除用抗红内期疟原虫药物外还需要加服抗肝内期疟原虫的药物。一般而言,间日疟原虫热带株复发间隔时间较短(常出现在临床治愈后1~2个月),间日疟原虫温带株复发间隔时间较长(可达1年以上)。恶性疟及三日疟没有复发。
与血液内残存的疟原虫有关。患者抗红内期疟原虫药物治疗不彻底,血液内残存的疟原虫可重新繁殖而再次发作。再燃常出现在临床治愈后1个月内,4种疟原虫均可出现。
血白细胞计数及中性粒细胞计数在急性发作时可增加,发作后则正常,多次发作后,则白细胞计数减少而单核细胞计数增多。有不同程度的血红蛋白下降和血小板计数减少。重症疟疾病例使用自动血细胞计数法出现外周白细胞异常升高时,需要人工镜检鉴别以排除仪器将感染红细胞误判为白细胞的可能性。
采用外周血涂制厚、薄血片,采用吉氏或瑞氏染色后,显微镜油镜检查疟原虫。目前,血涂片疟原虫显微镜检查是WHO推荐疟疾诊断的"金标准",其不仅能确定疟原虫感染和判别疟原虫株,还能识别疟原虫期和原虫密度,协助重症疟疾救治。部分缺乏外周血涂制厚、薄血片镜检能力的医疗机构也可采用骨髓片镜检的方法。
疟原虫抗原快速诊断试纸(rapid diagnostic test,RDT)条具有检测简便、快速的特点。不同快速诊断试纸条的灵敏性和特异性有很大差异。其中以富组氨酸蛋白(histidine rich protein, HRP)2/HRP3为靶抗原的诊断试纸条对恶性疟检测的灵敏性和特异性较高,但不能检测其他疟原虫株;以乳酸脱氢酶为靶抗原的诊断试纸条可检测恶性疟原虫或非恶性疟原虫,但不能区别间日疟原虫、卵形疟原虫和三日疟原虫,且对低原虫密度的检测灵敏性稍差。RDT不能监测抗疟治疗反应。
根据流行病学史(在非洲或东南亚疟疾流行区有夜间停留史或近2周内有输血史)、临床表现及实验室检查结果等予以诊断。
疟疾病原学检查阳性,但无临床表现者。
有流行病学史和疟疾临床表现,但疟疾病原学检查阴性。
疟疾病原学检查阳性,有临床表现(包括流行病学史)。
确诊病例,同时出现重症疟疾临床表现。
非典型的疟疾病例,临床表现错综复杂,易与其他发热性疾病混淆,应注意鉴别诊断。临床表现酷似疟疾,但反复检查血涂片均系阴性,需按规定作为疟疾临床诊断病例进行传染病报告,进行RDT检测,并留取抗凝血样本送当地疾病预防控制机构,通过镜检和核酸复核以确认或排除。
临床诊断应与以发热为主要症状的其他疾病,如急性上呼吸道感染、登革热、乙型脑炎、流行性脑脊髓膜炎、中毒性菌痢、败血症、肾综合征出血热、发热伴血小板减少综合征、急性肾盂肾炎、伤寒、钩端螺旋体病、恙虫病、巴贝虫病、内脏利什曼病、急性血吸虫病、旋毛虫病等相鉴别,同时需要与伴有发热、肝脾肿大等症状的溶血性疾病,淋巴瘤、白血病、噬血细胞性淋巴组织细胞增多症等非感染性疾病相鉴别。
疟疾治疗包括病因治疗(选用速效、不良反应较少的抗疟疾药物,迅速杀灭疟原虫及预防远期复发)、对症治疗(针对各种症状和并发症)和必要的支持疗法(保持酸碱平衡和重要脏器功能)[28]。
①磷酸氯喹:4-氨基喹啉类药物,对各种疟原虫的红内期无性体均有较强杀灭作用。该药口服吸收迅速且完全(2~3 h达血浆有效浓度),在红细胞内浓度比血浆内高10~20倍。在疟原虫寄生红细胞浓度比正常红细胞高20~25倍。氯喹代谢缓慢,半衰期约为74 h。主要不良反应包括头痛、恶心、呕吐、视力模糊等(停药后可恢复),偶见抑制心肌兴奋性和房室传导(心脏病患者慎用),大剂量使用可对视神经造成不可逆损伤。成人治疗总剂量为磷酸氯喹(基质)1.2 g,分3 d服用。由于大部分疟疾流行区的恶性疟原虫对氯喹已出现抗性,所以已不推荐用于恶性疟治疗。
②磷酸哌喹:也为4-氨基喹啉类药物,对各种疟原虫的红内期无性体均有较强杀灭作用,但与氯喹有交叉抗药性。该药口服吸收良好,先储积于肝脏,后逐渐释放入血,血浆半衰期可长达28 d。主要不良反应包括头昏、头痛、恶心、呕吐等(停药后可恢复),该药有肝内蓄积作用,可致血清ALT短期升高,不建议1个月内重复使用,肝病患者及孕妇慎用。成人治疗总剂量为磷酸哌喹(基质)1.2 g,分3 d服用。
③磷酸咯萘啶:为苯并萘啶类新型抗疟药物,对各种疟原虫的红内期无性体均有较强杀灭作用,与氯喹无交叉抗药性,可用于抗氯喹恶性疟的治疗。该药可口服、肌内注射和静脉滴注,吸收迅速(肌内注射0.75 h,口服1.4 h血浆浓度达高峰),半衰期较短(3 d)。不良反应一般较轻,对心脏无不良反应。目前,该药主要包括注射剂和与青蒿素类药物组成的复方口服片剂。
④青蒿素类药物:由我国传统中草药——黄花蒿提取的一种倍半萜内酯类新型抗疟药物,能杀灭各种疟原虫的红内期无性体,并可阻碍恶性疟原虫配子体的发育,广泛用于抗氯喹恶性疟的治疗。该类药口服1.3 h达浓度高峰,静脉注射2~3 min后达有效浓度,较易通过血脑屏障。该药代谢迅速,血浆半衰期仅2 h左右。目前主要包括青蒿琥酯、蒿甲醚注射剂和以青蒿素为基础的复方口服药物二大类。青蒿琥酯注射剂为青蒿素的水溶性衍生物,经静脉注射后在肝脏迅速代谢为双氢青蒿素并发挥杀虫作用。该药已被WHO推荐为重症疟疾的首选治疗药物。蒿甲醚注射剂为青蒿素的脂溶性衍生物,肌内注射吸收后也经肝脏代谢为双氢青蒿素,并发挥杀虫作用。该药已被WHO推荐为无青蒿琥酯注射剂地区重症疟疾的替代治疗药物之一。以青蒿素为基础的复方或联合用药(artemisinin-based combination therapy, ACT),为缩短青蒿素类药物治疗疗程并延缓抗药性产生,WHO强烈要求青蒿素类药物的口服制剂应采用青蒿素类药物与其他抗疟药物组合成复方或联合用药。目前,WHO推荐的ACT复方制剂包括蒿甲醚/本芴醇片、青蒿琥酯/阿莫地喹片、双氢青蒿素/磷酸哌喹片和青蒿琥酯/咯萘啶片;ACT联合用药包括青蒿琥酯-甲氟喹和青蒿琥酯-磺胺多辛-乙胺嘧啶。由于蒿甲醚-本芴醇、青蒿琥酯-甲氟喹和青蒿琥酯-磺胺多辛-乙胺嘧啶未在我国注册,我国《抗疟药使用规范》推荐双氢青蒿素/磷酸哌喹片、青蒿琥酯/阿莫地喹片和青蒿素/哌喹片[12]。基于青蒿素的联合疗法(WHO推荐剂量)见表1。
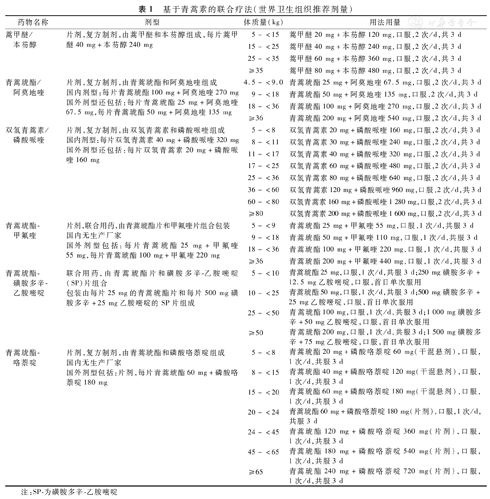
基于青蒿素的联合疗法(世界卫生组织推荐剂量)
基于青蒿素的联合疗法(世界卫生组织推荐剂量)
| 药物名称 | 剂型 | 体质量(kg) | 用法用量 |
|---|---|---|---|
| 蒿甲醚/本芴醇 | 片剂,复方制剂,由蒿甲醚和本芴醇组成,每片蒿甲醚40 mg+本芴醇240 mg | 5~<15 | 蒿甲醚20 mg+本芴醇120 mg,口服,2次/d,共3 d |
| 15~<25 | 蒿甲醚40 mg+本芴醇240 mg,口服,2次/d,共3 d | ||
| 25~<35 | 蒿甲醚60 mg+本芴醇360 mg,口服,2次/d,共3 d | ||
| ≥35 | 蒿甲醚80 mg+本芴醇480 mg,口服,2次/d,共3 d | ||
| 青蒿琥酯/阿莫地喹 | 片剂,复方制剂,由青蒿琥酯和阿莫地喹组成国内剂型:每片青蒿琥酯100 mg+阿莫地喹270 mg国外剂型还包括:每片青蒿琥酯25 mg+阿莫地喹67.5 mg,每片青蒿琥酯50 mg+阿莫地喹135 mg | 4.5~<9.0 | 青蒿琥酯25 mg+阿莫地喹67.5 mg,口服,2次/d,共3 d |
| 9~<18 | 青蒿琥酯50 mg+阿莫地喹135 mg,口服,2次/d,共3 d | ||
| 18~<36 | 青蒿琥酯100 mg+阿莫地喹270 mg,口服,2次/d,共3 d | ||
| ≥36 | 青蒿琥酯200 mg+阿莫地喹540 mg,口服,2次/d,共3 d | ||
| 双氢青蒿素/磷酸哌喹 | 片剂,复方制剂,由双氢青蒿素和磷酸哌喹组成国内剂型:每片双氢青蒿素40 mg+磷酸哌喹320 mg国外剂型还包括:每片双氢青蒿素20 mg+磷酸哌喹160 mg | 5~<8 | 双氢青蒿素20 mg+磷酸哌喹160 mg,口服,2次/d,共3 d |
| 8~<11 | 双氢青蒿素30 mg+磷酸哌喹240 mg,口服,2次/d,共3 d | ||
| 11~<17 | 双氢青蒿素40 mg+磷酸哌喹320 mg,口服,2次/d,共3 d | ||
| 17~<25 | 双氢青蒿素60 mg+磷酸哌喹480 mg,口服,2次/d,共3 d | ||
| 25~<36 | 双氢青蒿素80 mg+磷酸哌喹640 mg,口服,2次/d,共3 d | ||
| 36~<60 | 双氢青蒿素120 mg+磷酸哌喹960 mg,口服,2次/d,共3 d | ||
| 60~<80 | 双氢青蒿素160 mg+磷酸哌喹1 280 mg,口服,2次/d,共3 d | ||
| ≥80 | 双氢青蒿素200 mg+磷酸哌喹1 600 mg,口服,2次/d,共3 d | ||
| 青蒿琥酯-甲氟喹 | 片剂,联合用药,由青蒿琥酯片和甲氟喹片组合包装国内无生产厂家国外剂型包括:每片青蒿琥酯25 mg+甲氟喹55 mg,每片青蒿琥酯100 mg+甲氟喹220 mg | 5~<9 | 青蒿琥酯25 mg+甲氟喹55 mg,口服,1次/d,共服3 d |
| 9~<18 | 青蒿琥酯50 mg+甲氟喹110 mg,口服,1次/d,共服3 d | ||
| 18~<36 | 青蒿琥酯100 mg+甲氟喹220 mg,口服,1次/d,共服3 d | ||
| ≥36 | 青蒿琥酯200 mg+甲氟喹440 mg,口服,1次/d,共服3 d | ||
| 青蒿琥酯-磺胺多辛-乙胺嘧啶 | 联合用药,由青蒿琥酯片和磺胺多辛-乙胺嘧啶(SP)片组合包装由每片25 mg的青蒿琥酯片和每片500 mg磺胺多辛+25 mg乙胺嘧啶的SP片组成 | 5~<10 | 青蒿琥酯25 mg,口服,1次/d,共服3 d;250 mg磺胺多辛+12.5 mg乙胺嘧啶,口服,首日单次服用 |
| 10~<25 | 青蒿琥酯50 mg,口服,1次/d,共服3 d;500 mg磺胺多辛+25 mg乙胺嘧啶,口服,首日单次服用 | ||
| 25 ~<50 | 青蒿琥酯100 mg,口服,1次/d,共服3 d;1 000 mg磺胺多辛+50 mg乙胺嘧啶,口服,首日单次服用 | ||
| ≥50 | 青蒿琥酯200 mg,口服,1次/d,共服3 d;1 500 mg磺胺多辛+75 mg乙胺嘧啶,口服,首日单次服用 | ||
| 青蒿琥酯-咯萘啶 | 片剂,复方制剂,由青蒿琥酯和磷酸咯萘啶组成国内无生产厂家国外剂型包括:片剂,每片青蒿琥酯60 mg+磷酸咯萘啶180 mg | 5~<8 | 青蒿琥酯20 mg+磷酸咯萘啶60 mg(干混悬剂),口服,1次/d,共服3 d |
| 8~<15 | 青蒿琥酯40 mg+磷酸咯萘啶120 mg(干混悬剂),口服,1次/d,共服3 d | ||
| 15~<20 | 青蒿琥酯60 mg+磷酸咯萘啶180 mg(干混悬剂),口服,1次/d,共服3 d | ||
| 20~<24 | 青蒿琥酯60 mg+磷酸咯萘啶180 mg(片剂),口服,1次/d,共服3 d | ||
| 24~<45 | 青蒿琥酯120 mg+磷酸咯萘啶360 mg(片剂),口服,1次/d,共服3 d | ||
| 45~<65 | 青蒿琥酯180 mg+磷酸咯萘啶540 mg(片剂),口服,1次/d,共服3 d | ||
| ≥65 | 青蒿琥酯240 mg+磷酸咯萘啶720 mg(片剂),口服,1次/d,共服3 d |
注:SP-为磺胺多辛-乙胺嘧啶
目前,在国家药品监督管理局注册的唯一能杀灭肝内期疟原虫的药物为磷酸伯氨喹。磷酸伯氨喹能杀灭肝内期疟原虫防止复发,且能抑制成熟配子体在蚊体内发育,可减少疟疾传播,但对红内期疟原虫几乎无作用。该药口服吸收迅速而完全,血浆半衰期仅5~6 h。伯氨喹最严重的不良反应是可致6-磷酸葡萄糖脱氢酶(glucose-6-phosphate dehydrogenase,G6PD)缺陷,出现严重急性血管内溶血,其他不良反应包括厌食、呕吐、腹痛等胃肠道反应,偶有头晕、嗜中性粒细胞减少等[29]。因此,临床上伯氨喹常与杀红内期疟原虫药物联合用于间日疟和卵形疟的根治,但在G6PD缺乏人群中使用时应在医护人员的监护下进行,孕妇禁用。在恶性疟流行区,单剂低剂量伯氨喹也被推荐与青蒿素复方联合用于恶性疟治疗,以减少疟疾传播,且不受G6PD缺陷影响。
①磷酸氯喹/磷酸伯氨喹8日疗法:该方法适用于国内生产的磷酸伯氨喹。成人总剂量磷酸氯喹(基质)1.2 g,磷酸伯氨喹(基质)180 mg。磷酸氯喹第1天0.6 g,第2和3天1次/d,每次0.3 g;从服用磷酸氯喹第1天起,同时服用磷酸伯氨喹,1次/d,每次22.5 mg,连服8 d。
②磷酸氯喹/磷酸伯氨喹14日疗法:该方法适用于进口的磷酸伯氨喹。磷酸氯喹剂量和疗程同上,磷酸伯氨喹(基质)210 mg。从服用磷酸氯喹第1天起,同时服用磷酸伯氨喹,1次/d,15 mg/次,连服14 d。
③青蒿素复方+磷酸伯氨喹方案:不同青蒿素复方的治疗剂量和疗程不同,从服用青蒿素复方第1天起,同时服用磷酸伯氨喹(剂量和疗程同上),该方法也适用于恶性疟与间日疟混合感染。
①双氢青蒿素/磷酸哌喹片:成人总剂量8片。首剂2片,口服,8、24和32 h各服2片。
②青蒿琥酯/阿莫地喹片:成人总剂量6片。1次/d,2片/次,口服,连服3 d。
③青蒿素/哌喹片:成人总剂量4片。1次/d,2片/次,口服,连服2 d。
④蒿甲醚/萘酚喹片:成人总剂量8片。顿服。
由于重症疟疾病情凶险,病死率高,除抗疟治疗外需应用综合性急救措施[30]。患者应绝对卧床休息,保持全身和口腔清洁。注意水和电解质平衡。出现严重酸中毒,肺水肿或ARDS,肾功能衰竭及一般治疗无效时应该考虑转入ICU治疗。应坚持病因治疗和对症治疗并重的原则。
1.病因治疗。①首选青蒿琥酯注射剂静脉注射:成人0、12和24 h各1次,120 mg/次(2.4 mg/kg);体质量<20 kg的儿童3 mg/kg,以后1次/d,120 mg/次,连续至少7 d;如患者苏醒且能进食,可停止青蒿琥酯注射,改服复方青蒿素1个疗程继续治疗,如仍有疟原虫,可延长疗程至疟原虫消失。②如无青蒿琥酯注射剂:可采用蒿甲醚注射剂肌内注射。成人首剂160 mg,以后1次/d,80 mg/次;或首剂3.2 mg/kg,以后1.6 mg/kg;连续至少7 d;如患者苏醒且能进食,可停止蒿甲醚注射,改服复方青蒿素1个疗程继续治疗,必要时延长疗程至疟原虫消失。需注意蒿甲醚比水溶性青蒿琥酯吸收更慢,更不稳定,尤其是休克患者使用。③也可采用磷酸咯萘啶静脉滴注:成人1次/d,160 mg/次,连续3 d。
2.对症治疗。①高热的治疗:高热是疟疾最常见的临床症状,可采用物理降温,尽可能使体温降至38 ℃以下。对乙酰氨基酚等解热镇痛药可加快退热速度,对超高热患者可酌情应用肾上腺皮质激素。②脑水肿、抽搐的治疗:如患者处于昏迷状态,多有脑水肿的存在,可用脱水剂,如呋塞米(速尿)、甘露醇等。使用胶体液扩容、改善微循环,增加血容量降低血液黏度。对抽搐患者可用镇静剂,肌内注射或静脉注射地西泮,对频繁抽搐者可采用氯丙嗪联合异丙嗪肌内注射,必要时也可应用亚冬眠疗法。但不推荐使用苯巴比妥预防抽搐。③低氧血症或呼吸窘迫的治疗:按呼吸衰竭治疗原则采取适当的氧疗措施或呼吸功能支持。④酸中毒的治疗:原虫密度较高的患者较易出现酸中毒,脑型疟的酸中毒会更加严重。常规先给予5%的碳酸氢钠(NaHCO3)注射液125 mL,以后根据检验结果加以调整。随着抗疟药发挥作用,原虫被清除,酸中毒会得到改善[31]。⑤肝、肾功能严重损伤的治疗:肝、肾功能严重损伤是重症恶性疟严重的并发症之一,可选用甘草酸苷、多烯磷脂酰胆碱、腺苷蛋氨酸等护肝治疗,适当扩容、利尿,必要时血液净化治疗。⑥低血糖的治疗:疟疾患者需监测血糖水平,及时发现低血糖,低血糖时可用葡萄糖溶液快速补充,维持血糖在正常高限以上。⑦贫血的治疗:儿童血红细胞压积<15%,成人<20%时可输全血或浓缩红细胞。⑧血小板减少症的治疗:血小板计数<50×109/L时,必要时可输注血小板,或应用重组人血小板生成素(thrombopoietin,TPO)或TPO受体激动剂(如阿伐曲泊帕)治疗。⑨伴随细菌感染的治疗:重症疟疾可出现CRP及降钙素原增高,此时不应常规应用抗菌药物,但临床要注意监测,及时发现继发的细菌感染,必要时经验性应用抗菌药物[32]。
3.其他治疗。①肾上腺糖皮质激素治疗:对抑制炎症、改善脑水肿、减少血液有形成分破坏、减轻中毒症状有较好作用。可酌情短期应用中等剂量肾上腺糖皮质激素。②血液净化治疗:出现急性肾衰竭、高钾血症、代谢性酸中毒、高乳酸血症及进展迅速有高细胞因子炎症反应综合征等表现时,需尽快进行血液净化治疗,把握好血液净化治疗干预的时机对预后有较大影响[33]。血液净化治疗有助于减轻高原虫血症、抗疟治疗后的微循环障碍,对肝、肾功能障碍等具有积极作用。血液净化治疗模式首选血液滤过透析,但不限于此,必要时可以根据患者内环境状况、肝肾功能情况、微循环情况选择血浆置换、血液滤过、血液透析单独或联合应用。持续或间歇治疗1周左右。血液净化治疗应选择在抗疟药物特别是青蒿素类药物给药2 h后应用;对于需要持续血液净化治疗的患者,可酌情增加青蒿素类药物的给药剂量。
采取虫媒隔离措施,病室应防蚊、灭蚊;做好疟疾发作期休息、饮食及发热等对症护理的同时,严密观察病情变化,及时发现危急状况,积极预防和处理并发症的发生;血标本随时可采,但恶性疟在发热期或退热后数小时内进行可提高阳性率。遵医嘱安全、有效、合理、规范使用抗疟药物,并观察药物的疗效及不良反应。配置青蒿琥酯静脉注射时,需先将5%的碳酸氢钠注射液2 mL注入青蒿琥酯粉剂中,反复振荡2~3 min,待完全溶解后,再注入8 mL 5%的葡萄糖溶液或0.9%的氯化钠溶液溶解,混匀后缓慢静脉推注,推注时间为3~4 min。青蒿琥酯注射液应即配即用,配制后的溶液如发生混浊,则不能使用。蒿甲醚注射液需要深部肌内注射给药,必要时需局部热敷。关注患者的心理问题,并给予相应的心理指导和支持也很重要。
非重症疟疾或无严重并发症者,只要及时治疗,预后良好,无后遗症。但重症疟疾病死率较高,原虫密度越高,救治时间越晚,预后越差。
应了解目的地的疟疾流行状况,做好个人防护准备。
提倡使用蚊帐、纱门、纱窗、蚊虫趋避剂、穿长衣长袖等个人防蚊措施,长期居住者推荐采用长效杀虫剂处理蚊帐,以及杀虫剂室内滞留喷洒等,并加强居住地的环境治理,减少蚊虫孳生。
磷酸哌喹每次服600 mg,每个月1次,睡前服用(连续服用不超过3个月)。
回国后,如出现发冷、发热、出汗等不适症状,应及时就医,入境和就医时应主动告知旅行史,并按医嘱全程、足量服用抗疟药物。
撰写组
组长:李兰娟
副组长:张文宏、黄建荣、高琪
学术秘书:王新宇、俞亮
参与成员(排序不分先后):李兰娟(浙江大学医学院附属第一医院)、黄建荣(浙江大学医学院附属第一医院)、连江山(浙江大学医学院附属第一医院)、俞亮(浙江大学医学院附属第一医院)、王晓燕(浙江大学医学院附属第一医院)、朱彪(浙江大学医学院附属第一医院)、徐凯进(浙江大学医学院附属第一医院)、张文宏(复旦大学附属华山医院)、王新宇(复旦大学附属华山医院)、张福杰(首都医科大学附属北京地坛医院)、高琪(WHO消除疟疾研究与培训合作中心/江苏省寄生虫病防治研究所)、曹建平[中国疾病预防控制中心寄生虫病预防控制所(国家热带病研究中心)]、夏志贵[中国疾病预防控制中心寄生虫病预防控制所(国家热带病研究中心)]、姚立农(浙江省疾病预防控制中心)、阮卫(浙江省疾病预防控制中心)、沙新平(中南大学湘雅医院)、侯周华(中南大学湘雅医院)、耿嘉蔚(云南省第一人民医院)、肖安(云南省第一人民医院)、高海女[浙江树人大学树兰国际医学院附属树兰(杭州)医院]、张缭云(山西医科大学第一医院)、张立婷(兰州大学第一医院)、郑以山(南京市第二医院)、杨跃杰(河南省传染病医院)、邹洋(首都医科大学附属北京友谊医院)、郑昕(华中科技大学同济医学院附属协和医院)、朱月永(福建医科大学附属第一医院)、卢明芹(温州医科大学附属第一医院)、李用国(重庆医科大学附属第一医院)、宁琴(华中科技大学同济医学院附属同济医院)、韩梅芳(华中科技大学同济医学院附属同济医院)、黄琴(上海市公共卫生临床中心)、卢洪洲(深圳市第三人民医院)、黄长形(空军军医大学唐都医院)、廖柏明(广西医科大学第一附属医院)、李磊(中国科学技术大学附属第一医院)、邬小萍(南昌大学第一附属医院)、林炳亮(中山大学附属第三医院)、林锋(海南省人民医院)、谢青(上海交通大学医学院附属瑞金医院)、鲁晓擘(新疆医科大学第一附属医院)、范晶华(昆明医科大学第一附属医院)、王伟洪(湖州市中心医院)、夏乾峰(海南医学院)
所有作者均声明不存在利益冲突


























