
探讨累及C2椎体的颈椎后纵韧带骨化症(OPLL)对颈椎矢状面形态及其参数的影响。
回顾性研究。纳入2016年1月—2020年12月徐州医科大学附属医院脊柱外科颈椎OPLL患者97例,其中男68例、女29例,年龄37~80(59.0±9.6)岁。根据骨化物是否累及C2椎体将患者分为2组,OPLL累及C2椎体36例为C2阳性组,未累及C2椎体 61例为C2阴性组。在立位颈椎侧位X线片上测量C0~2及C2~7颈椎前凸角(CL)、C2倾斜角(C2S)、胸廓入口角(TIA)、T1倾斜角(T1S)、颈倾角(NT)、枕颈倾斜角(OCI)、C2~7矢状轴距离(SVA)等矢状面参数。观察项目:(1)对比2组患者性别、年龄、日本骨科协会(JOA)评分、颈椎功能障碍指数(NDI)评分等临床一般资料;(2)比较2组患者骨化物累及的颈椎节段、椎管侵占率、OPLL分型以及影像学上有无脊髓高信号、骨化物是否触及K线的情况;(3)比较2组间颈椎矢状面各项影像学参数的差异,分别对2组内矢状面各影像学参数进行相关性分析;(4)对OPLL累及C2的危险因素进行多因素logistic回归分析。
2组患者性别、年龄、JOA评分差异均无统计学意义(P值均>0.05)。C2阳性组骨化物累及颈椎节段数(4.6±1.2)个、椎管侵占率52.42%±9.96%、NDI评分(21.08±7.65)分,均高于C2阴性组的(3.1±0.9)个、45.87%±13.08%、(17.70±8.49)分,差异均有统计学意义(P值均<0.05)。在OPLL分型上,C2阳性组和C2阴性组分型构成比差异有统计学意义(P<0.001)。2组间骨化物触及K线率、脊髓高信号率差异均无统计学意义(P值均>0.05)。颈椎矢状面各项影像学参数中,仅C2阳性组C2S(11.25°±5.84°)高于C2阴性组(7.66°±5.65°),差异有统计学意义(t=2.99,P=0.004)。2组内颈椎矢状面影像参数相关性分析显示:C2阳性组中,C2S与C0~2CL、C2~7SVA呈正相关(r=0.52、0.80,P值均<0.05);C2阴性组中,C2S与C0~2 CL、C2~7SVA呈正相关,与C2~7CL呈负相关(r=0.43、0.71、-0.39,P值均<0.05)。多因素logistic回归显示,C2S增大[比值比(OR)=1.208,95%可信区间(CI)1.032~2.210,P=0.014]和骨化物累及颈椎节段数(OR=3.026,95% CI 2.136~5.076,P=0.001)为OPLL累及C2的独立性危险因素。
颈椎OPLL累及C2者以累及节段更多和椎管侵占率更高为特点,在颈椎矢状面影像学参数上表现为更高的C2S,且C2S和骨化物累及颈椎节段数为OPLL累及C2的独立危险因素。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
颈椎后纵韧带骨化症(ossification of posterior longitudinal ligament,OPLL)是由于后纵韧带组织发生异位骨化,而导致颈脊髓神经压迫的一类疾病[1],最早由日本学者Tsuyama于1984年报道[2]。有研究显示,OPLL好发于亚洲及男性人群[3, 4]。颈椎OPLL最常累及下颈椎C4~5节段,但临床上上颈椎区的病例亦不少见[5, 6]。有学者提出累及C2的OPLL患者常具有一定特殊的影像学特点,如Yin等[7]对是否累及C2的两组颈椎OPLL患者进行比较,发现累及C2者骨化节段数明显多于未累及者,且其中连续型OPLL为最常见类型。然而,对于以上相关结论目前尚未达成共识,且既往研究多限于对其骨化特点的描述上,缺少对OPLL累及C2时的生物力学与形成机制的进一步探讨[7, 8]。
近年来,颈椎矢状面形态与矢状面参数在颈椎外科领域受到越来越多的关注[9, 10, 11]。颈椎后纵韧带的异位骨化亦可显著影响颈椎矢状面形态和代偿功能。既往对OPLL与退变性颈椎病的比较研究显示,OPLL患者C2~7矢状轴距离(sagittal vertebral axis,SVA)更大,其矢状面形态常表现为更加平直或呈后凸畸形[12]。此外,Kim等[13]报道,颈椎OPLL患者T1倾斜角(T1 slope,T1S)与颈椎椎板成形术后颈椎前凸的丢失或颈椎后凸畸形的发生呈显著正相关,并影响术后颈部功能。然而,上颈椎区作为颈椎活动度与代偿潜能最大的部分,其后纵韧带骨化后可能对颈椎矢状面参数造成与其他颈椎OPLL不同的影响,但目前国内外尚无研究涉及OPLL累及上颈椎对颈椎矢状面参数的影响。因此,本研究中我们探讨颈椎OPLL是否累及C2在影像学特点和颈椎矢状面影像学参数上的差异,旨在为上颈椎OPLL患者的影像学和矢状面形态评估及手术策略选择提供参考依据。
纳入标准:(1)依据颈椎CT三维影像确诊为颈椎OPLL患者,表现为神经根或脊髓压迫症状;(2)影像学资料完整,包括术前立位颈椎正侧位X线片、颈椎CT三维成像及颈椎MRI,其中颈椎X线片为立位平视状态下拍摄,图片清晰。排除标准:(1)临床或影像学资料不齐全;(2)颈椎侧位X线图片质量差,各椎体及胸骨柄显示不清;(3)外伤或颈脊髓损伤表现者;(4)合并脊柱脊髓肿瘤、感染、颈椎畸形、其他中枢及外周神经系统疾患等。
回顾性研究。纳入2016年1月—2020年12月徐州医科大学附属医院脊柱外科颈椎OPLL患者97例。其中男68例,女29例;年龄37~80(59.0±9.6)岁;病程3~48(11.4±5.3)个月。患者行颈椎后路椎板成形术41例,颈椎椎板切除减压内固定术56例。本研究中,将骨化物头端位于C2下终板近端者定义为颈椎OPLL累及C2[14]。根据骨化物是否累及C2将患者分为2组,OPLL累及C2 36例为C2阳性组,未累及C2 61例为C2阴性组。
本研究符合《赫尔辛基宣言》的要求。
采用荷兰飞利浦Digital Diagnost 3 X线机摄片,侧位片患者取自然立位,目视前方并保持视线水平(颌眉角-10°~10°)。将颈椎侧位X线片由PACS(美国GE公司)导入Surgimap V2.3.2.1软件(美国Nemaris Inc公司)测量以下矢状面参数(图1)。
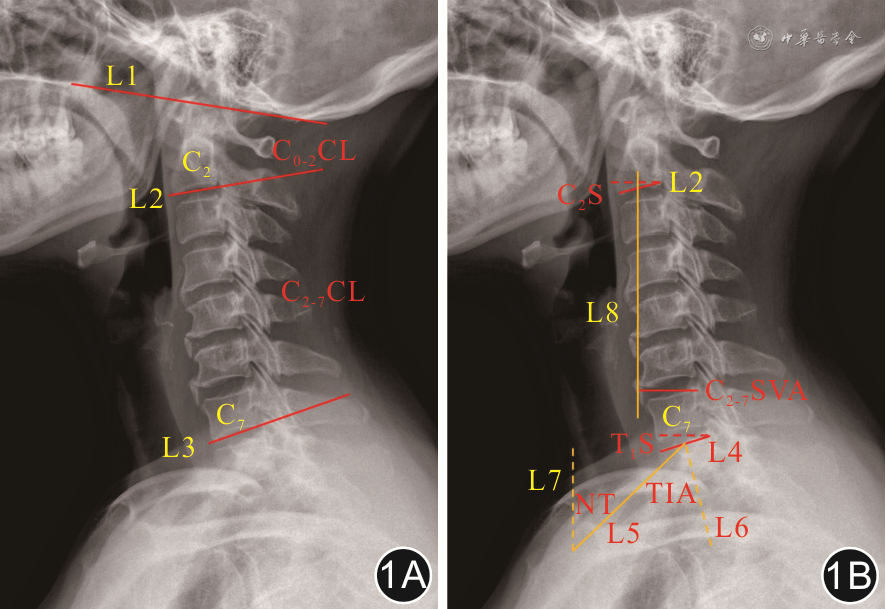

注:L1为McGregor线,即硬腭后缘和枕骨鳞部最低点的连线;L2为C2下终板切线;L3为C7下终板切线;L4为T1上终板切线;L5为胸骨柄近端上缘顶点与T1上终板中点连线;L6为T1上终板的中垂线;L7为通过胸骨柄上缘的垂线;L8为通过C2椎体中点的铅垂线;CL为颈椎前凸角;C2S为C2倾斜角;TIA为胸廓入口角;T1S为T1倾斜角;NT为颈倾角;C2~7 SVA为C2~7矢状轴距离
(1)C0~2及C2~7颈椎前凸角(cervical lordosis,CL):McGregor线(硬腭后缘至枕骨鳞部最低点的连线)与C2下终板切线间的夹角即C0~2 CL,C2下终板切线和C7下终板切线间的夹角即C2~7 CL;(2)C2倾斜角(C2 slope,C2S):C2下终板切线与水平线的夹角;(3)胸廓入口角(thoracic inlet angle,TIA):胸骨柄近端顶点与T1上终板中点间连线,该连线与T1上终板中垂线之间的夹角即TIA;(4)T1S:T1上终板切线与水平线间的夹角;(5)颈倾角(neck tilt,NT):胸骨柄近端上缘顶点与T1上终板中点间连线,该连线与通过胸骨柄上缘所做垂线之间的夹角即NT;(6)枕颈倾斜角(occipito-cervical inclination,OCI):McGregor线与C4椎体后缘切线间的夹角;(7)C2~7 SVA:通过C2椎体中点做铅垂线,C7椎体后上角与此铅垂线间的垂直距离。
(1)OPLL分型:在颈椎矢状面CT重建图像上,根据Tsuyama法[2]将OPLL骨化形态分为局灶型、节段型、连续型和混合型4型。(2)椎管侵占率:在颈椎横断面骨窗CT图像上,选取椎管狭窄程度最重的节段,使用PACS的测量工具测量骨化物厚度占相应骨性椎管前后径的百分比。(3)骨化物是否未触K线:在矢状面CT重建图像上做C2椎管中心与C7椎管中心的连线即为K线,当骨化物未触及该线时定义为K线(+),而当骨化物超过该线时则为K线(-)。(4)脊髓高信号区:在颈椎MR T2WI矢状面图像上评估是否存在脊髓高信号区。
影像学参数的测量由2名脊柱外科主治医生独立完成,首次测量后间隔1周再次测量,以评估测量结果的一致性。最终测量结果取2名医生2次测量结果的平均值。
(1)对比2组患者性别、年龄、JOA评分、颈椎功能障碍指数(neck disability index,NDI)评分等临床一般资料。(2)比较2组患者骨化物累及颈椎节段、OPLL分型、椎管侵占率以及骨化物是否触及K线、脊髓是否存在高信号等影像学特征。(3)比较2组间颈椎矢状面影像学参数,分别对2组内影像学参数进行相关性分析,并评估OPLL累及C2椎体的危险因素。
应用SPSS 24.0统计学软件进行数据分析。服从或近似服从正态分布的计量资料以±s表示,组间比较采用独立样本t检验;分类资料的组间比较采用χ2检验或Fisher确切概率法。采用Pearson相关分析C2阳性组与C2阴性组中影像学参数的相关性:r<0.3为无相关,0.3~0.8为弱相关,>0.8为强相关。对2组观察指标行单因素logistic回归分析,选择P<0.1的参数采用多因素logistic回归分析评估OPLL累及C2的危险因素。采用ICC评估观测者自身及观测者间测量结果的一致性:ICC>0.8,一致性优;ICC 0.4~0.8,一致性一般,ICC<0.4,一致性差。以P<0.05为差异有统计学意义。
观测者自身及观测者间测量结果的ICC值均>0.8,一致性优。
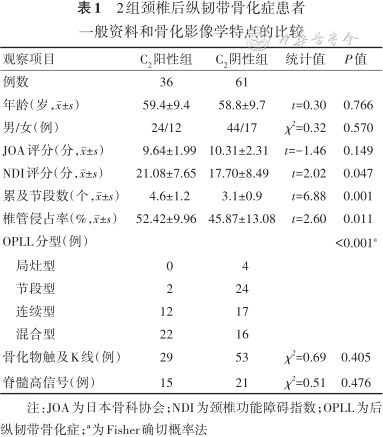
C2阳性组NDI评分大于C2阴性组,差异有统计学意义(P=0.047);而性别、年龄、JOA评分2组间差异均无统计学意义(P值均>0.05)。见表1。
2组颈椎后纵韧带骨化症患者一般资料和骨化影像学特点的比较
2组颈椎后纵韧带骨化症患者一般资料和骨化影像学特点的比较
| 观察项目 | C2阳性组 | C2阴性组 | 统计值 | P值 |
|---|---|---|---|---|
| 例数 | 36 | 61 | ||
| 年龄(岁,±s) | 59.4±9.4 | 58.8±9.7 | t=0.30 | 0.766 |
| 男/女(例) | 24/12 | 44/17 | χ2=0.32 | 0.570 |
| JOA评分(分,±s) | 9.64±1.99 | 10.31±2.31 | t=-1.46 | 0.149 |
| NDI评分(分,±s) | 21.08±7.65 | 17.70±8.49 | t=2.02 | 0.047 |
| 累及节段数(个,±s) | 4.6±1.2 | 3.1±0.9 | t=6.88 | 0.001 |
| 椎管侵占率(%,±s) | 52.42±9.96 | 45.87±13.08 | t=2.60 | 0.011 |
| OPLL分型(例) | <0.001a | |||
| 局灶型 | 0 | 4 | ||
| 节段型 | 2 | 24 | ||
| 连续型 | 12 | 17 | ||
| 混合型 | 22 | 16 | ||
| 骨化物触及K线(例) | 29 | 53 | χ2=0.69 | 0.405 |
| 脊髓高信号(例) | 15 | 21 | χ2=0.51 | 0.476 |
注:JOA为日本骨科协会;NDI为颈椎功能障碍指数;OPLL为后纵韧带骨化症;a为Fisher确切概率法
C2阳性组患者OPLL累及节段、椎管侵占率均高于C2阴性组,差异均有统计学意义(P值均<0.05)。在OPLL分型上,C2阳性组患者混合型病变最常见,其次为连续型和节段型;而C2阴性组中节段型OPLL最常见,其次为连续型和混合型,分型构成比差异有统计学意义(P=0.001)。两组患者骨化物触及K线率、脊髓高信号率差异均无统计学意义(P值均>0.05)。见表1。
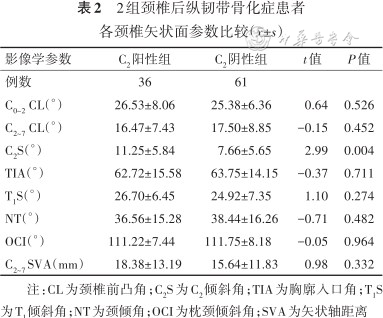
C2阳性组C2S大于C2阴性组,差异有统计学意义(P=0.004),其他参数2组间差异均无统计学意义(P值均>0.05)。见表2。
2组颈椎后纵韧带骨化症患者各颈椎矢状面参数比较(±s)
2组颈椎后纵韧带骨化症患者各颈椎矢状面参数比较(±s)
| 影像学参数 | C2阳性组 | C2阴性组 | t值 | P值 |
|---|---|---|---|---|
| 例数 | 36 | 61 | ||
| C0~2 CL(°) | 26.53±8.06 | 25.38±6.36 | 0.64 | 0.526 |
| C2~7 CL(°) | 16.47±7.43 | 17.50±8.85 | -0.15 | 0.452 |
| C2S(°) | 11.25±5.84 | 7.66±5.65 | 2.99 | 0.004 |
| TIA(°) | 62.72±15.58 | 63.75±14.15 | -0.37 | 0.711 |
| T1S(°) | 26.70±6.45 | 24.92±7.35 | 1.10 | 0.274 |
| NT(°) | 36.56±15.28 | 38.44±16.26 | -0.71 | 0.482 |
| OCI(°) | 111.22±7.44 | 111.75±8.18 | -0.05 | 0.964 |
| C2~7 SVA(mm) | 18.38±13.19 | 15.64±11.83 | 0.98 | 0.332 |
注:CL为颈椎前凸角;C2S为C2倾斜角;TIA为胸廓入口角;T1S为T1倾斜角;NT为颈倾角;OCI为枕颈倾斜角;SVA为矢状轴距离
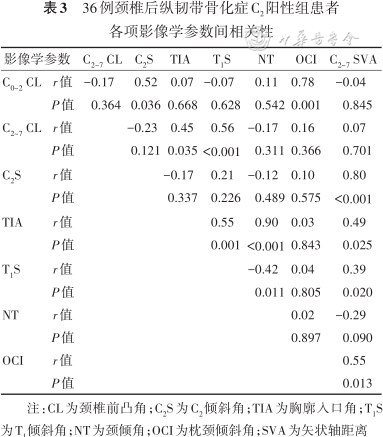
C2阳性组中:C2S与C0~2CL、C2~7SVA呈正相关(P值均<0.05),其中C2S与C2~7SVA间为强相关。其他参数中,呈正相关的参数有C0~2 CL与OCI,C2~7CL与TIA、T1S,TIA与T1S、NT、C2~7SVA,T1S与C2~7SVA,OCI与C2~7SVA,其中TIA与NT呈强正相关;呈负相关的参数为T1S与NT:差异均有统计学意义(P值均<0.05)。见表3。
36例颈椎后纵韧带骨化症C2阳性组患者各项影像学参数间相关性
36例颈椎后纵韧带骨化症C2阳性组患者各项影像学参数间相关性
| 影像学参数 | C2~7 CL | C2S | TIA | T1S | NT | OCI | C2~7 SVA | |
|---|---|---|---|---|---|---|---|---|
| C0~2 CL | r值 | -0.17 | 0.52 | 0.07 | -0.07 | 0.11 | 0.78 | -0.04 |
| P值 | 0.364 | 0.036 | 0.668 | 0.628 | 0.542 | 0.001 | 0.845 | |
| C2~7 CL | r值 | -0.23 | 0.45 | 0.56 | -0.17 | 0.16 | 0.07 | |
| P值 | 0.121 | 0.035 | <0.001 | 0.311 | 0.366 | 0.701 | ||
| C2S | r值 | -0.17 | 0.21 | -0.12 | 0.10 | 0.80 | ||
| P值 | 0.337 | 0.226 | 0.489 | 0.575 | <0.001 | |||
| TIA | r值 | 0.55 | 0.90 | 0.03 | 0.49 | |||
| P值 | 0.001 | <0.001 | 0.843 | 0.025 | ||||
| T1S | r值 | -0.42 | 0.04 | 0.39 | ||||
| P值 | 0.011 | 0.805 | 0.020 | |||||
| NT | r值 | 0.02 | -0.29 | |||||
| P值 | 0.897 | 0.090 | ||||||
| OCI | r值 | 0.55 | ||||||
| P值 | 0.013 | |||||||
注:CL为颈椎前凸角;C2S为C2倾斜角;TIA为胸廓入口角;T1S为T1倾斜角;NT为颈倾角;OCI为枕颈倾斜角;SVA为矢状轴距离
C2阴性组中:C2S与C0~2 CL、C2~7SVA呈正相关,与C2~7CL呈负相关(P值均<0.05)。其他参数中,呈正相关的参数有C0~2 CL与OCI,C2~7CL与TIA、T1S,TIA与T1S、NT、C2~7SVA,T1S与C2~7SVA,OCI与C2~7SVA,其中TIA与NT呈强正相关性;呈负相关的参数为C0~2 CL与C2~7CL,C2~7CL与NT,T1S与NT:差异均有统计学意义(P值均<0.05)。见表4。
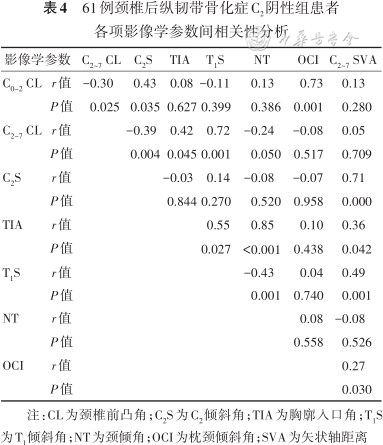
61例颈椎后纵韧带骨化症C2阴性组患者各项影像学参数间相关性分析
61例颈椎后纵韧带骨化症C2阴性组患者各项影像学参数间相关性分析
| 影像学参数 | C2~7 CL | C2S | TIA | T1S | NT | OCI | C2~7 SVA | |
|---|---|---|---|---|---|---|---|---|
| C0~2 CL | r值 | -0.30 | 0.43 | 0.08 | -0.11 | 0.13 | 0.73 | 0.13 |
| P值 | 0.025 | 0.035 | 0.627 | 0.399 | 0.386 | 0.001 | 0.280 | |
| C2~7 CL | r值 | -0.39 | 0.42 | 0.72 | -0.24 | -0.08 | 0.05 | |
| P值 | 0.004 | 0.045 | 0.001 | 0.050 | 0.517 | 0.709 | ||
| C2S | r值 | -0.03 | 0.14 | -0.08 | -0.07 | 0.71 | ||
| P值 | 0.844 | 0.270 | 0.520 | 0.958 | 0.000 | |||
| TIA | r值 | 0.55 | 0.85 | 0.10 | 0.36 | |||
| P值 | 0.027 | <0.001 | 0.438 | 0.042 | ||||
| T1S | r值 | -0.43 | 0.04 | 0.49 | ||||
| P值 | 0.001 | 0.740 | 0.001 | |||||
| NT | r值 | 0.08 | -0.08 | |||||
| P值 | 0.558 | 0.526 | ||||||
| OCI | r值 | 0.27 | ||||||
| P值 | 0.030 | |||||||
注:CL为颈椎前凸角;C2S为C2倾斜角;TIA为胸廓入口角;T1S为T1倾斜角;NT为颈倾角;OCI为枕颈倾斜角;SVA为矢状轴距离
单因素logistic回归分析结果见表5。选择P<0.1的参数进一步多因素logistic回归分析,结果显示,C2S增大和骨化物累及颈椎节段数为OPLL累及C2的独立性危险因素(P值均<0.05),见表6。
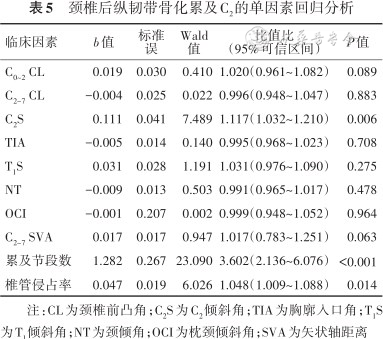
颈椎后纵韧带骨化累及C2的单因素回归分析
颈椎后纵韧带骨化累及C2的单因素回归分析
| 临床因素 | b值 | 标准误 | Wald值 | 比值比(95%可信区间) | P值 |
|---|---|---|---|---|---|
| C0~2 CL | 0.019 | 0.030 | 0.410 | 1.020(0.961~1.082) | 0.089 |
| C2~7 CL | -0.004 | 0.025 | 0.022 | 0.996(0.948~1.047) | 0.883 |
| C2S | 0.111 | 0.041 | 7.489 | 1.117(1.032~1.210) | 0.006 |
| TIA | -0.005 | 0.014 | 0.140 | 0.995(0.968~1.023) | 0.708 |
| T1S | 0.031 | 0.028 | 1.191 | 1.031(0.976~1.090) | 0.275 |
| NT | -0.009 | 0.013 | 0.503 | 0.991(0.965~1.017) | 0.478 |
| OCI | -0.001 | 0.207 | 0.002 | 0.999(0.948~1.052) | 0.964 |
| C2~7 SVA | 0.017 | 0.017 | 0.947 | 1.017(0.783~1.251) | 0.063 |
| 累及节段数 | 1.282 | 0.267 | 23.090 | 3.602(2.136~6.076) | <0.001 |
| 椎管侵占率 | 0.047 | 0.019 | 6.026 | 1.048(1.009~1.088) | 0.014 |
注:CL为颈椎前凸角;C2S为C2倾斜角;TIA为胸廓入口角;T1S为T1倾斜角;NT为颈倾角;OCI为枕颈倾斜角;SVA为矢状轴距离
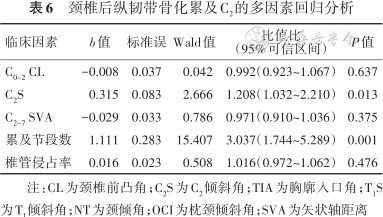
颈椎后纵韧带骨化累及C2的多因素回归分析
颈椎后纵韧带骨化累及C2的多因素回归分析
| 临床因素 | b值 | 标准误 | Wald值 | 比值比(95%可信区间) | P值 |
|---|---|---|---|---|---|
| C0~2 CL | -0.008 | 0.037 | 0.042 | 0.992(0.923~1.067) | 0.637 |
| C2S | 0.315 | 0.083 | 2.666 | 1.208(1.032~2.210) | 0.013 |
| C2~7 SVA | -0.029 | 0.033 | 0.786 | 0.971(0.910~1.036) | 0.375 |
| 累及节段数 | 1.111 | 0.283 | 15.407 | 3.037(1.744~5.289) | 0.001 |
| 椎管侵占率 | 0.016 | 0.023 | 0.508 | 1.016(0.972~1.062) | 0.476 |
注:CL为颈椎前凸角;C2S为C2倾斜角;TIA为胸廓入口角;T1S为T1倾斜角;NT为颈倾角;OCI为枕颈倾斜角;SVA为矢状轴距离
颈椎OPLL是引起颈髓神经压迫症状的常见原因,好发于下颈椎区,但累及上颈椎的病例亦不少见,既往文献报道OPLL累及上颈椎发生率约占颈椎OPLL的40%[7,14]。本研究中OPLL累及C2占颈椎OPLL的37.1%(36/97),与既往研究结果相近。Wang等[8]研究结果显示,累及C2的颈椎OPLL平均骨化5.1个节段,且混合型是最常见的OPLL类型(73.3%),其次为连续型(24.5%);对于继发性椎管狭窄而言,虽然C2受累,但椎管侵占率最高的节段仍多位于C3~4,45例中仅1例位于C2。Yin等[7]研究得出类似结论,但OPLL分型连续型为其最常见骨化类型。本组病例中,C2阳性组最常见的OPLL类型为混合型,其次为连续型;此外,累及C2者骨化范围平均4.6个节段,椎管侵占率平均达52.42%,均显著高于C2阴性组,提示OPLL累及C2的患者韧带骨化程度更重。对于临床量表评分的比较,Yin等[7]及Lee等[14]均报道OPLL是否累及C2的2组在JOA评分上无显著差异,但此2项研究均未对NDI评分进行评估。本研究对JOA和NDI评分均予以比较,亦发现组间JOA评分无统计学差异,但C2阳性组NDI评分较高,提示OPLL侵及C2可影响患者颈椎功能状态。JOA评分代表神经功能,虽然2组在骨化严程度上有差别,但并未影响JOA评分,可能因为C2椎管空间大,C2的OPLL通常不会造成明显的椎管狭窄及脊髓压迫;此外,在C2阳性组,椎管侵占率最高的节段仍多位于下颈椎,因此在神经压迫症状上与C2阴性组患者差别不大。对于其他影像学特征,包括K线触及与否及脊髓高信号,2组患者均无明显差异,提示以上特征对颈椎OPLL累及C2后的独特性评估价值有限。
除上述传统影像学特征外,颈椎矢状面参数亦是颈椎OPLL患者术前颈椎功能状态评估及术式选择的重要参考指标,尤其对于颈后路手术者[15]。虽然胸腰椎矢状面形态和脊柱-骨盆参数已被广泛研究并应用于临床,但颈椎矢状面参数直至2010年后才逐渐引起关注。目前,颈椎矢状面参数已被报道用于多节段脊髓型颈椎病、颈椎后凸畸形和颈椎融合术后邻近节段退变等疾病的评估,多种参数被发现与患者颈痛程度、临床量表评分、颈椎退变发生及术后恢复情况等显著相关[16, 17, 18]。对于颈椎OPLL,后纵韧带的骨化改变亦可能对颈椎矢状面形态产生明显影响,但目前尚缺乏对该类患者颈椎矢状面参数的系统性研究;此外,相对于下颈椎,上颈椎区对颈椎矢状面形态的影响可能更大。因此,近年越来越多的学者将上颈椎区纳入颈椎矢状面研究中。然而,目前尚无研究涉及颈椎OPLL累及C2与否对颈椎矢状面参数的影响。
临床上常用的颈椎矢状面参数包括CL、TIA、T1S、NT、C2S、C2~7 SVA等。既往文献多采用C2~7CL评估颈椎前凸程度[3],本研究则加用C0~2CL联合C2~7CL进行分析。T1S是影响颈椎矢状面平衡的重要指标,由Knott等[19]于2010年首次报道。其后,Martini等[20]提出了TIA、NT、T1S等参数,由于头颈部的矢状面平衡以相对固定的胸廓入口形态和倾斜角度为基础,TIA是调节颈部形态及视线水平的重要参数,并类似于骨盆参数,颈椎矢状面参数在几何上满足TIA=NT+T1S。颈椎矢状面参数除了调节颈椎矢状面形态及平衡的作用外,亦具有重要临床相关性。既往研究报道T1S和C2~7 SVA均与颈椎病患者NDI评分相关,并通过回归分析确定C2~7 SVA的临界值为40 mm[21]。本研究中对CL进行比较,2组间C0~2 CL与C2~7 CL差异均无统计学意义,但C0~2 CL占C0~7 CL整体颈椎前凸的比例在C2阳性与C2阴性组中分别为61.7%和59.2%,均明显低于既往报道正常人群的77%左右[22],提示颈椎OPLL的发生可影响颈椎前凸的分布。其他参数中,虽然TIA、T1S、NT、OCI及C2~7 SVA在组间差异均无统计学意义,但2组内各参数间均具有一定相关性,如TIA、T1S、NT之间各自相关,C2~7 SVA与TIA、T1S均呈显著正相关。因此,对于颈椎OPLL患者,临床上应关注TIA及T1S的评估与术后改善情况。
C2S是反映颅椎区与下颈椎关联作用的重要参数。Protopsaltis等[23]报道在颈椎后凸畸形患者中,高C2S可致术后功能恢复不佳。C2S在数值上近似T1S-CL,而T1S与CL的差值反映胸椎近端矢状面形态与颈椎前凸的匹配程度,因此,高C2S值代表颈椎矢状面形态与远端的匹配性不佳,进一步影响颈部功能状态。有研究报道,C2S超过20°即预示明显的颈部功能障碍[24]。本研究中,对C2阳性组与C2阴性组矢状面各项参数进行比较,OPLL累及C2者的C2S高于未累及者,差异有统计学意义;而相关性分析中,2组C2S均与C2~7 SVA呈显著正相关,即颈椎OPLL患者C2S的增大可关联C2~7SVA的增加,影响颈椎功能。因此,对于OPLL累及C2的高C2S值患者,术中应注意恢复或降低患者C2S水平,以获得更满意的颈椎功能。在C2S与颈椎前凸的相关性分析中,我们发现在C2阴性组中C2S与C0~2 CL呈正相关、与C2~7 CL呈负相关,但在C2阳性组中仅C0~2 CL与C2S呈显著正相关。因此,笔者认为,对于未累及C2的OPLL患者,增加C2至C7弧度的颈椎后路内固定即有助于降低C2S;而对累及C2者,C2S的减小则需延长固定至上颈椎区以增加C0~2 CL,或行C2~3间隙的前路手术以降低C2下终板倾斜度。
既往文献多关注于颈椎OPLL骨化进展的危险因素分析,如年龄较小、连续型和混合型病变、骨化累及椎间隙、节段性活动度高、手术方式等被报道可影响颈椎OPLL的进展[25, 26]。然而,目前尚缺少涉及颈椎OPLL累及C2危险因素的研究。本研究中危险因素分析显示,仅C2S和受累节段数为OPLL累及C2的独立性危险因素。OPLL进展多受机械应力的影响,后纵韧带起自枢椎并与椎体覆膜相延续,C2S增高时可牵张后纵韧带,造成应力增大。有研究报道,作用于后纵韧带组织的机械应力,尤其是周期性牵张应力,可上调多种参与OPLL发生发展的基因和后纵韧带细胞表面特定受体亚型的表达,诱导OPLL形成[27, 28];而OPLL累及节段多本身即反映异位骨化的活跃。因此,对于未累及C2的颈椎OPLL患者,当其C2S值偏高,尤其是累及节段较多时,手术亦应关注C2S值的减小,不仅有助于颈椎功能的改善,也有可能助于控制颈椎OPLL的继续进展。
综上所述,颈椎OPLL累及C2者在影像学上表现为累及节段更多和椎管侵占率更高,在颈椎矢状面参数上以更高的C2S为特点,且C2S和受累节段数为颈椎OPLL累及C2的独立性危险因素,C2S对累及C2的OPLL患者颈椎矢状面形态评估及手术策略制定具有重要参考意义。本研究存在以下不足:(1)样本量偏少,需进一步行大样本量的前瞻性研究以减少选择性偏倚;(2)并非所有纳入患者均摄立位脊柱全长片,难以评估颈椎矢状面参数与胸椎、腰椎矢状参数及脊柱-骨盆参数之间的关系;(3)颈椎OPLL可影响颈椎活动度,而颈椎活动度的改变亦可能参与矢状面形态的调节,需要在后续的研究中纳入颈椎活动度参数,进一步观察。
所有作者声明不存在利益冲突



























