
低级别FH缺陷型肾细胞癌是新近报道的生物学行为可能为惰性的一种少见肾肿瘤,其FH基因状态可为体系或胚体突变,胚系突变与遗传性平滑肌瘤病和肾细胞癌(hereditary leiomyomatosis and renal cell carcinoma,HLRCC)综合征相关。我们报道1例54岁男性患者,其左侧为低级别FH缺陷型RCC,右侧为透明细胞性肾细胞癌(clear cell renal cell carcinoma,CCRCC)。高通量靶向测序结果证实左肾肿瘤的FH突变类型为体细胞错义突变(c.1256C>T,p.5419L)。我们应当熟悉此形态并及时推荐患者进行遗传咨询。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者男,54岁。体检发现双侧肾脏占位于2021年1月入院。肾脏B超提示左肾中下极探及一低回声灶,大小约1.5 cm×1.4 cm,肿块凸向包膜外,右肾下极探及一低回声灶,肿块凸向包膜外,大小约2.0 cm×1.5 cm,界欠清。
病理检查:送检左肾灰黄肿物1枚,大小1.5 cm×1.3 cm×1.4 cm,切面灰黄色、实性、界清。镜下观察:肿瘤边界清楚(图1),肿瘤细胞呈管状或巢状排列。肿瘤中心区域存在低细胞密度区,其间质疏松水肿。肿瘤细胞呈多角形,胞质絮状嗜酸性,有散在的胞质内空泡,细胞核圆形,核形规则,染色质呈细颗粒状,观察全部肿瘤区域,低倍镜下未见到清晰的核仁[WHO/国际泌尿病理协会(ISUP)2级,图2, 3, 4, 5]。间质存在肥大细胞(图1)。免疫组织化学:肿瘤细胞PAX8,肾脏特异性抗原(kidney-specific cadherin,Ksp-cadherin)、SDHB、广谱细胞角蛋白(CKpan)、E-cadherin、波形蛋白、P504s呈弥漫阳性,CD10、TFE3、TFEB、细胞角蛋白(CK)7、CD117、碳酸酐酸Ⅸ(CAⅨ)呈阴性表达。肿瘤组织中FH阴性,正常肾组织FH阳性表达(图6)。间质肥大细胞CD117阳性。送检右肾肿物一枚,大小2.4 cm×1.5 cm×1.5 cm,切面多彩状。镜下观察:肿瘤细胞呈巢状排列,胞质透明,间质见纤细的纤维血管网,核分级为WHO/ISUP 2级。免疫组织化学:肿瘤细胞PAX8、CD10、CAⅨ、CKpan、波形蛋白阳性表达,TFE3、CD117、CK7阴性。双侧肾肿瘤均未见凝固性坏死及血管侵犯,pTNM分期均为T1aN0M0。分子检测:包括425个基因的下一代测序(NGS)结果证实,左肾肿瘤的FH突变类型为体细胞错义突变(c.1256C>T,p.5419L)。
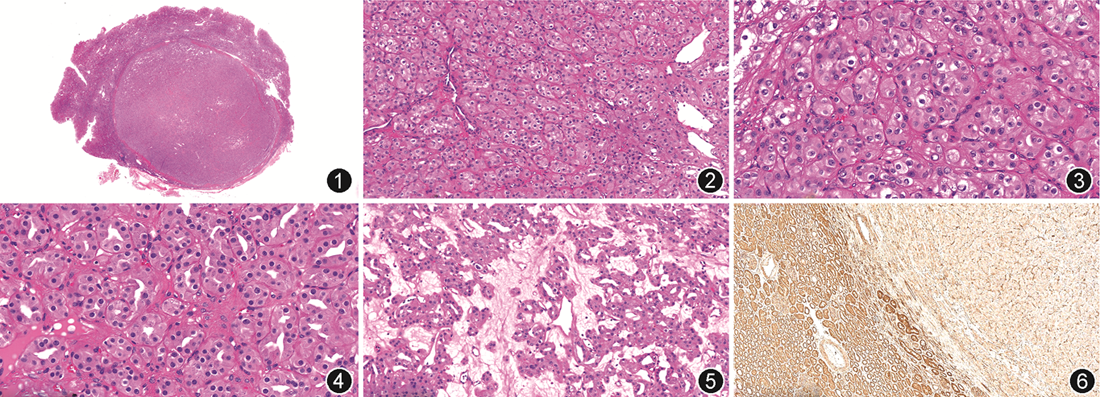

病理诊断:左侧为肾脏低级别FH缺陷型肾细胞癌,右侧为透明细胞性肾细胞癌。
随访:患者接受腹腔镜下左肾部分切除术,术后5个月接受了腹腔镜下右肾部分切除术。左侧肿瘤随访12个月,右侧肿瘤随访7个月均未见肿瘤复发及转移。
讨论:在早期的临床工作中,遗传性平滑肌瘤病和肾细胞癌(hereditary leiomyomatosis and renal cell carcinoma,HLRCC)综合征相关的肾细胞癌容易被诊断为集合管癌、2型乳头状肾细胞癌、管状囊性癌、高级别未分类的肾细胞癌等。随着认识的不断加深,2016版WHO泌尿男生殖系统肿瘤分类对该肿瘤进行了详尽的描述。当前国内外专家认为,延胡索酸水化酶(fumarate hydratase,FH)缺失的肾细胞癌,不管有无HLRCC综合征病史或临床特征的RCC均归类为FH缺陷型肾细胞癌。新近,FH缺陷型肾细胞癌的形态学谱已从高级别扩展到低级别[1, 2, 3]。与高级别相比,低级别FH缺陷型肾细胞癌具有独特的形态学特征和相对较好的临床预后[4]。本文报道1例低级别FH缺陷型肾细胞癌同时合并对侧肾脏透明细胞性肾细胞癌(CCRCC)。
1983年,首次报道了FH基因胚系突变(纯合突变)的患者发生的一种罕见的代谢性疾病,表现为大脑异常、发育延迟等[5, 6]。FH基因胚系突变(杂合突变)与HLRCC综合征相关,HLRCC综合征是一种常染色体显性遗传病[7]。在Lau等[1]的研究中,1例患者存在FH基因的体系突变(P.L283*),该患者为pT3a期,术后36个月死亡。因此,他们认为由FH基因体系突变导致的肾细胞癌在形态学特征、临床行为上与HLRCC相关的肾细胞癌并无差异。目前散发性高级别FH缺陷型肾细胞癌与HLRCC相关肾细胞癌的比例尚不清楚。
高级别FH缺陷型肾细胞癌典型细胞学特征为增大的细胞核内存在带有空晕的嗜酸性大核仁,类似于巨细胞病毒感染。其他的特征还包括核的多形性、核膜不规则、大的胞质内空泡。生长方式多种多样,包括乳头状、实性、筛状、肉瘤样、管状、囊状、管囊状、管状乳头状、巢状、腺样等[1, 2]。90%(26/29)具有2种以上生长方式,59%(17/29)显示3种以上的生长方式[1]。多数FH缺陷型肾细胞癌表现为高级别的形态和较差的临床预后,新近,其形态学谱已从高级别扩展到低级别[2]。低级别FH缺陷型肾细胞癌细胞学特征为:嗜碱性小核仁、核周空晕、絮状嗜酸性胞质及小的胞质内空泡,呈巢状、管状或实性,少数会出现囊状、微囊或管囊状排列[1, 2, 3],这些特点与高级别不同。在高级别FH缺陷型肾细胞癌中,有时大的胞质内空泡会引起筛状外观,而在低级别中,由于胞质内空泡较小,因此未呈现筛状外观。
截至目前检索出12例低级别FH缺陷型肾细胞癌。平均年龄27岁,男女比例为1∶1。9例肿瘤为单灶,3例为多灶。6例患者有HLRCC综合征临床表现,2例为散发性。1例患者同侧肾脏同时存在2个肾细胞癌,分别为高级别及低级别FH缺陷型肾细胞癌。另1例患者初次接受肾脏部分切除术,术后诊断为低级别FH缺陷型肾细胞癌,术后4年同侧肾脏肿瘤复发,行根治性切除术,术后诊断为高级别FH缺陷型肾细胞癌[4]。2例高级别FH缺陷型肾细胞癌中存在有小灶的低级别区域[1]。因此,低级别FH缺陷型肾细胞癌可与高级别形态共存于同一肿瘤中,或同时或相继存在于同一患者中。低级别FH缺陷型肾细胞癌可同时合并肾上腺皮质腺瘤、CCRCC、囊肿和高级别FH缺陷型肾细胞癌[1, 2, 3, 4]。大多数患者无症状,最长随访时间为109个月,无肿瘤复发及转移。
低级别FH缺陷型肾细胞癌的鉴别诊断主要包括:(1)SDH缺陷型肾细胞癌:两者均边界清晰,含有嗜酸性絮状胞质,胞质内空泡,但SDH缺陷型肾细胞癌中SDHB阴性表达,缺乏核周空晕。(2)嗜酸细胞瘤:部分肿瘤细胞可呈群岛型排列,CD117弥漫阳性,CK7阴性或点灶状阳性(≤5%)。(3)新近报道的肾脏CK7+/CD117-低级别嗜酸细胞性肾肿瘤(low‐grade oncocytic renal tumor,LOT)中的细胞核圆形、椭圆形,含有核周空晕及嗜酸细胞胞质,生长方式为实性、管状和巢状[8, 9, 10],与低级别FH缺陷型肾细胞癌形态部分有重叠。然而,LOT含有在疏松水肿间质中呈“组织培养”生长外观的低细胞密度区,及小梁状生长特征的细胞密集区。CK7+/CD117-/FH+的免疫表达特征有助于鉴别。NGS证实存在MTOR基因、TSC基因突变。(4)嗜酸性实性囊性肾细胞癌(eosinophilic solid and cystic renal cell carcinoma,ESCRCC)的肿瘤细胞亦含有丰富的嗜酸性胞质,但胞质内含有粗糙的颗粒状物,且肿瘤细胞之间存在散在的组织细胞、淋巴细胞及具有实性及囊性的生长方式。FH阳性,CK7和CD117阴性,CK20弥漫或局灶阳性。NGS证实存在TSC1/TSC2基因突变。(5)高级别CCRCC的肿瘤细胞通常胞质嗜酸,但仔细寻找整个肿瘤区域,通常会存在局灶胞质透明的细胞,及纤细的纤维血管间质。CAⅨ、CD10、FH阳性。CD117、CK7、CK20阴性。FISH检测存在3p缺失。(6)嗜酸型嫌色细胞肾细胞癌(chromophobe renal cell carcinoma,chRCC)的肿瘤细胞为实性排列,细胞膜增厚,不规则的细胞核及核周空晕。CK7及CD117阳性表达。chRCC显示染色体Y、1、2、6、10、13、17和21丢失,嗜酸型chRCC可能显示较少或无遗传物质丢失。TP53和PTEN的突变率分别是27%~32%和9%。
大多数高级别FH缺陷型肾细胞癌在诊断时已经出现转移。由于该病罕见,因此尚无专门针对该肿瘤设计的大规模临床试验。目前,雷帕霉素(mTOR)抑制剂和/或血管内皮生长因子受体酪氨酸激酶抑制剂(VEGFR-TKIs)的哺乳动物靶向药物已应用于临床治疗转移性患者[11, 12]。对于低级别FH缺陷型肾细胞癌,目前所有病例均存活,随访中位生存时间为60个月(29~109个月),因此该肿瘤可能为一种惰性肿瘤,但目前文献报道病例数较少且随访时间较短,其真正的生物学行为还有待于积累更多的临床资料研究明确。
已经报道的12例低级别FH缺陷型肾细胞癌中,2例无肾细胞癌或平滑肌瘤病史,并存在FH体系突变,这表明FH体系突变也可触发低级别FH缺陷型肾细胞癌。分别由FH体系及胚系突变导致的低级别FH缺陷型肾细胞癌的比例约为1∶3。此外,低级别FH缺陷型肾细胞癌也可以是HLRCC的一个临床表现,病理学医师应当熟悉此形态并及时推荐患者进行遗传咨询。因此我们在临床工作中,应当注意该肿瘤实体。
所有作者声明无利益冲突



























