
探讨达雷妥尤单抗治疗复发难治性多发性骨髓瘤(RRMM)患者的有效性及安全性。
回顾性纳入四川大学华西医院2019年9月至2021年11月行达雷妥尤单抗治疗的52例RRMM患者,其中男31例,女21例,初次诊断为多发性骨髓瘤(MM)时年龄为(58±10)岁。根据达雷妥尤单抗治疗剂量,将患者分为低剂量组(n=10)和高剂量组(n=42)。统计分析患者总缓解率(ORR)、无进展生存时间(PFS)、总生存时间(OS)以及不良反应发生率,并对影响患者预后的因素进行单因素及多因素分析。
52例患者中,8例行达雷妥尤单抗单药治疗,27例联合免疫调节剂(IMiD)治疗,4例联合蛋白酶体抑制剂(PI)治疗,2例联合IMiD和PI治疗,11例联合地塞米松治疗。高剂量组患者初次诊断为MM时年龄为(57±9)岁,小于低剂量组(66±10)岁(P=0.009);高剂量组患者的基线肌酐水平M(Q1,Q3)为91(68,196)μmol/L,高于低剂量组的66(51,76)μmol/L(P=0.021);两组患者在其余基线临床特征、既往治疗方案及线数、达雷妥尤单抗治疗方案及疗程差异均无统计学意义(均P>0.05)。52例患者总体ORR为71.2%(37/52),IMiD联合治疗组ORR为81.5%(22/27),高于单用或联合地塞米松治疗组的52.6%(10/19)(P=0.036)。随访时间M(Q1,Q3)为7(5,26)个月,总体中位PFS为17(95%CI:9.6~24.4)个月,IMiD联合治疗组中位PFS为26(95%CI:6.0~46.0)个月,显著高于单用或联合地塞米松治疗组的12(95%CI:3.5~20.5)个月(HR=0.231,95%CI:0.075~0.715,P=0.011)。初次诊断为MM时年龄高是疾病进展的危险因素(HR=1.085,95%CI:1.016~1.158,P=0.014),达雷妥尤单抗疗程数更多是疾病进展的保护因素(HR=0.669,95%CI:0.495~0.904,P=0.009);达雷妥尤单抗剂量对疾病进展无影响(以低剂量为参照,HR=1.016,95%CI:0.221~4.668,P=0.984)。总体中位OS为26(95%CI:13.1~38.9)个月,血钙高是患者死亡的危险因素(HR=12.190,95%CI:1.170~127.048,P=0.037);达雷妥尤单抗剂量对患者死亡无影响(以低剂量为参照,HR=0.818,95%CI:0.171~3.917,P=0.802)。常见不良事件为感染(43.2%,16/37)、输液相关不良反应(29.7%,11/37)、血小板减少(27.0%,10/37)。
达雷妥尤单抗治疗RRMM效果较好,在联合治疗时的剂量对预后无影响;患者不良反应发生率较低、安全可控。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
多发性骨髓瘤(multiple myeloma,MM)是浆细胞恶性克隆性增生的血液系统肿瘤,占所有肿瘤的1%。虽然免疫调节剂(immuno-modulatory drug,IMiD)、蛋白酶体抑制剂(proteosome inhibitor,PI)等新药治疗已显著改善患者的疗效,延长了MM患者的生存期,但是在MM的疾病发展过程中,耐药性终将产生,大多数患者最终都会复发,复发难治性多发性骨髓瘤(relapsed/refractory multiple myeloma,RRMM)患者预后较差。因此亟需通过其他机制抑制MM的新药以改善经治患者的不良预后。
达雷妥尤单抗是人源化、IgG1κ型抗CD38单克隆抗体,通过补体依赖的细胞毒作用、抗体依赖细胞介导的细胞毒作用、抗体依赖的细胞吞噬作用、Fcγ介导的单抗交联、CD38酶活性的调节等诱导MM细胞凋亡。CASTOR临床试验发现RRMM患者经DVd(达雷妥尤单抗-硼替佐米-地塞米松)方案治疗的总缓解率(overall response rate,ORR)及无进展生存时间(progression-free survival,PFS)优于Vd(硼替佐米-地塞米松),POLLUX临床试验发现RRMM患者DRd(达雷妥尤单抗-来那度胺-地塞米松)方案治疗的ORR及PFS优于Rd(来那度胺-地塞米松),因此达雷妥尤单抗获批与Vd或Rd方案联合用于RRMM的2线及以上治疗[1, 2]。虽然国内外多项临床试验均证明达雷妥尤单抗疗效及安全性较好,但是临床试验入选标准较为严格,对于真实世界中高龄、体能差、肾功能不全、有共病等骨髓瘤患者的疗效及安全性经验有限。因此本研究旨在探讨达雷妥尤单抗治疗RRMM患者的疗效及安全性。
回顾性分析四川大学华西医院血液内科2019年9月至2021年11月接受达雷妥尤单抗治疗的52例RRMM患者的临床资料。纳入标准:(1)符合MM诊断标准;(2)难治性MM满足原发难治(诱导治疗4个疗程后仍未达到微小缓解)或复发难治(对挽救治疗无反应或上次治疗曾达到微小缓解以上疗效,但60 d内疾病进展);(3)临床复发满足至少1项:出现新的骨病变或软组织浆细胞瘤、明确已有的浆细胞瘤或骨病变增加、高钙血症、血红蛋白浓度下降≥20 g/L、血肌酐上升≥176.8 μmol/L且与MM相关、M蛋白相关高黏滞血症[3];(4)资料完整。排除标准:(1)自行中断治疗者;(2)合并其他恶性肿瘤者。危险度分层基于2014年国际骨髓瘤工作组(International Myeloma Working Group,IMWG)共识[4]。根据达雷妥尤单抗治疗剂量,将患者分为低剂量组(n=10)和高剂量组(n=42)。本研究已通过四川大学华西医院伦理委员会批准(WCH-EC/2021-1703),患者均签署知情同意书。
1.达雷妥尤单抗治疗方案:低剂量组中达雷妥尤单抗剂量为8 mg/kg,高剂量组中达雷妥尤单抗剂量为16 mg/kg。两组均为每个疗程4周。第1~2疗程(即1~8周),在第1、8、15、22天静脉输注达雷妥尤单抗;第3~6疗程(即第9~24周),在第1、15天静脉输注达雷妥尤单抗;第7疗程及以后(即第25周及以后),在第1天静脉输注达雷妥尤单抗。达雷妥尤单抗单用或与其他药物联用的治疗方案取决于对患者病情的充分评估和讨论。
2.疗效及安全性评估:参考2016年IMWG疗效判断标准[5],依次分为严格意义的完全缓解(stringent complete response,sCR)、完全缓解(complete response,CR)、非常好的部分缓解(very good partial response,VGPR)、部分缓解(partial response,PR)、微小缓解(minimal response,MR)、疾病稳定(stable disease,SD)、疾病进展(progression disease,PD)。ORR=(sCR+CR+VGPR+PR)例数/总例数×100%。
3.随访:通过查询门诊及住院病历、电话随访患者的PFS、总生存时间(overall survival,OS)。PFS定义:从启动达雷妥尤单抗治疗至疾病进展或死亡的时间。OS定义:从启动达雷妥尤单抗治疗至因任何原因死亡的时间。随访时间截至2021年12月31日。
采用SPSS 23.0、GraphPad Prism 7.0软件进行数据分析。治疗疗程和治疗时间以M(范围)表示;初次诊断为MM的年龄、血红蛋白、乳酸脱氢酶为正态分布的计量资料,以表示,采用独立样本t检验进行两组间比较;初次诊断MM至启动达雷妥尤单抗治疗的时间、基线血钙、血β2微球蛋白、血肌酐、既往治疗线数为偏态分布的计量资料,以M(Q1,Q3)表示,采用Mann-Whitney U检验进行两组间比较;计数资料以百分率(%)表示,采用χ²检验、连续修正的χ²检验或Fisher精确概率法进行组间比较。生存曲线绘制采用Kaplan-Meier法,生存分析采用Log-rank检验。影响生存结局变量的单因素及多因素分析采用Cox比例风险模型,单因素分析后P<0.06的因素及作者结合临床专业判断可能影响结局的因素纳入多因素分析。双侧检验,检验水准α=0.05。
52例RRMM患者中,男31例(59.6%),女21例(40.4%)。初次诊断MM的年龄为(58±10)岁。达雷妥尤单抗高剂量组42例(80.8%),低剂量组10例(19.2%)。高剂量组患者初次诊断为MM时年龄小于低剂量组(t=2.74,P=0.009)。高剂量组患者的基线肌酐水平高于低剂量组(Z=-2.31,P=0.021)。两组患者其余基线临床特征、既往治疗方案及线数、达雷妥尤单抗治疗方案及疗程差异均无统计学意义(均P>0.05)。对于年老、体弱、耐受性差的患者,本中心倾向于使用低剂量达雷妥尤单抗。结果见表1。
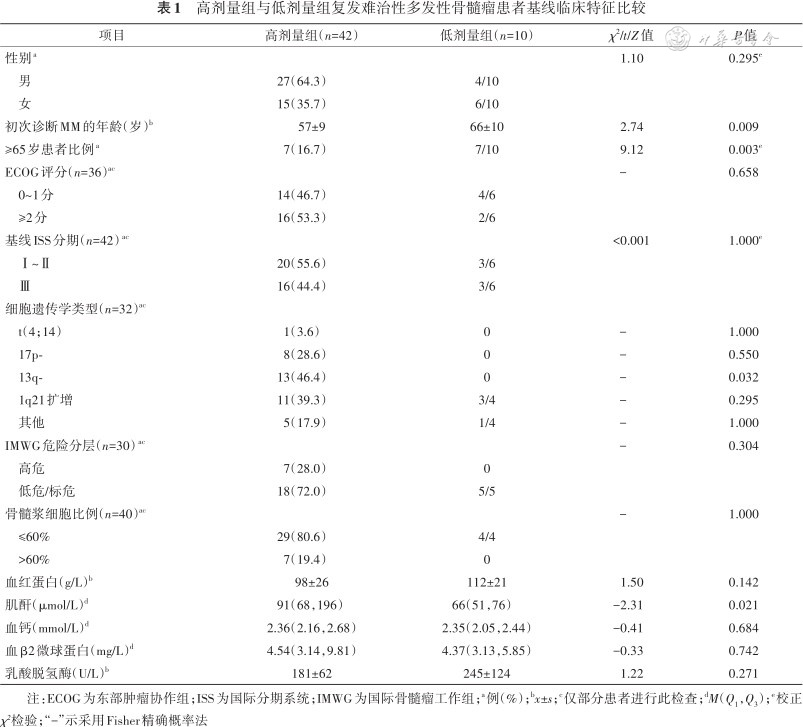
高剂量组与低剂量组复发难治性多发性骨髓瘤患者基线临床特征比较
高剂量组与低剂量组复发难治性多发性骨髓瘤患者基线临床特征比较
| 项目 | 高剂量组(n=42) | 低剂量组(n=10) | χ2/t/Z值 | P值 |
|---|---|---|---|---|
| 性别a | 1.10 | 0.295e | ||
| 男 | 27(64.3) | 4/10 | ||
| 女 | 15(35.7) | 6/10 | ||
| 初次诊断MM的年龄(岁)b | 57±9 | 66±10 | 2.74 | 0.009 |
| ≥65岁患者比例a | 7(16.7) | 7/10 | 9.12 | 0.003e |
| ECOG评分(n=36)ac | - | 0.658 | ||
| 0~1分 | 14(46.7) | 4/6 | ||
| ≥2分 | 16(53.3) | 2/6 | ||
| 基线ISS分期(n=42) ac | <0.001 | 1.000e | ||
| Ⅰ~Ⅱ | 20(55.6) | 3/6 | ||
| Ⅲ | 16(44.4) | 3/6 | ||
| 细胞遗传学类型(n=32)ac | ||||
| t(4;14) | 1(3.6) | 0 | - | 1.000 |
| 17p- | 8(28.6) | 0 | - | 0.550 |
| 13q- | 13(46.4) | 0 | - | 0.032 |
| 1q21扩增 | 11(39.3) | 3/4 | - | 0.295 |
| 其他 | 5(17.9) | 1/4 | - | 1.000 |
| IMWG危险分层(n=30) ac | - | 0.304 | ||
| 高危 | 7(28.0) | 0 | ||
| 低危/标危 | 18(72.0) | 5/5 | ||
| 骨髓浆细胞比例(n=40)ac | - | 1.000 | ||
| ≤60% | 29(80.6) | 4/4 | ||
| >60% | 7(19.4) | 0 | ||
| 血红蛋白(g/L)b | 98±26 | 112±21 | 1.50 | 0.142 |
| 肌酐(μmol/L)d | 91(68,196) | 66(51,76) | -2.31 | 0.021 |
| 血钙(mmol/L)d | 2.36(2.16,2.68) | 2.35(2.05,2.44) | -0.41 | 0.684 |
| 血β2微球蛋白(mg/L)d | 4.54(3.14,9.81) | 4.37(3.13,5.85) | -0.33 | 0.742 |
| 乳酸脱氢酶(U/L)b | 181±62 | 245±124 | 1.22 | 0.271 |
注:ECOG为东部肿瘤协作组;ISS为国际分期系统;IMWG为国际骨髓瘤工作组;a例(%);bx±s;c仅部分患者进行此检查;dM(Q1,Q3);e校正χ²检验;“-”示采用Fisher精确概率法
52例患者从诊断至采用达雷妥尤单抗进行治疗的时间为26.5(10.3~55.8)个月,具体既往治疗情况如表2所示。达雷妥尤单抗疗程为2(1~26)个。8例(15.4%)患者行达雷妥尤单抗单药治疗,44例(84.6%)患者与其他药物联合治疗;联合治疗中,最常见的治疗方案为DRd或DR,共20例(45.5%),其余治疗方案见表2。
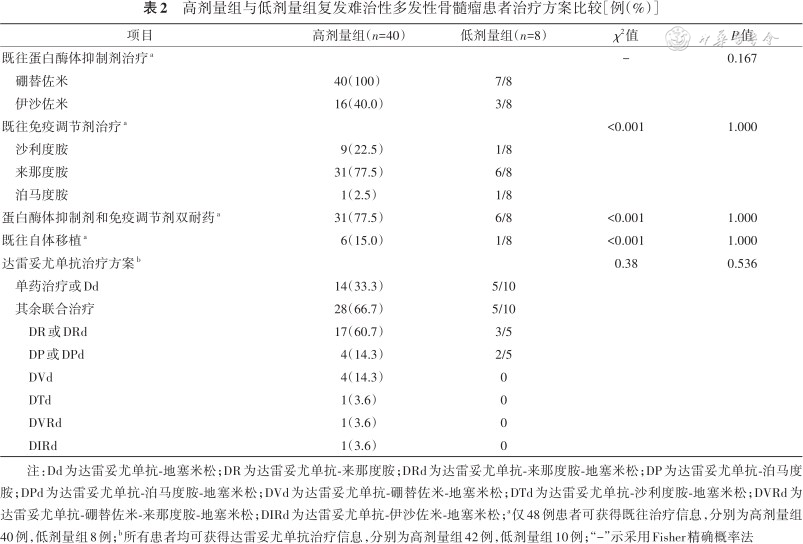
高剂量组与低剂量组复发难治性多发性骨髓瘤患者治疗方案比较[例(%)]
高剂量组与低剂量组复发难治性多发性骨髓瘤患者治疗方案比较[例(%)]
| 项目 | 高剂量组(n=40) | 低剂量组(n=8) | χ2值 | P值 |
|---|---|---|---|---|
| 既往蛋白酶体抑制剂治疗a | - | 0.167 | ||
| 硼替佐米 | 40(100) | 7/8 | ||
| 伊沙佐米 | 16(40.0) | 3/8 | ||
| 既往免疫调节剂治疗a | <0.001 | 1.000 | ||
| 沙利度胺 | 9(22.5) | 1/8 | ||
| 来那度胺 | 31(77.5) | 6/8 | ||
| 泊马度胺 | 1(2.5) | 1/8 | ||
| 蛋白酶体抑制剂和免疫调节剂双耐药a | 31(77.5) | 6/8 | <0.001 | 1.000 |
| 既往自体移植a | 6(15.0) | 1/8 | <0.001 | 1.000 |
| 达雷妥尤单抗治疗方案b | 0.38 | 0.536 | ||
| 单药治疗或Dd | 14(33.3) | 5/10 | ||
| 其余联合治疗 | 28(66.7) | 5/10 | ||
| DR或DRd | 17(60.7) | 3/5 | ||
| DP或DPd | 4(14.3) | 2/5 | ||
| DVd | 4(14.3) | 0 | ||
| DTd | 1(3.6) | 0 | ||
| DVRd | 1(3.6) | 0 | ||
| DIRd | 1(3.6) | 0 |
注:Dd为达雷妥尤单抗-地塞米松;DR为达雷妥尤单抗-来那度胺;DRd为达雷妥尤单抗-来那度胺-地塞米松;DP为达雷妥尤单抗-泊马度胺;DPd为达雷妥尤单抗-泊马度胺-地塞米松;DVd为达雷妥尤单抗-硼替佐米-地塞米松;DTd为达雷妥尤单抗-沙利度胺-地塞米松;DVRd为达雷妥尤单抗-硼替佐米-来那度胺-地塞米松;DIRd为达雷妥尤单抗-伊沙佐米-地塞米松;a仅48例患者可获得既往治疗信息,分别为高剂量组40例,低剂量组8例;b所有患者均可获得达雷妥尤单抗治疗信息,分别为高剂量组42例,低剂量组10例;“-”示采用Fisher精确概率法
52例患者总体ORR为71.2%(37/52),高剂量组患者ORR为71.4%(30/42),低剂量组患者ORR为7/10。达雷妥尤单抗单用或联合地塞米松治疗组ORR为10/19,IMiD联合治疗组ORR为81.5%(22/27),后者ORR高于前者(χ2=4.38,P=0.036),结果见表3及表4。
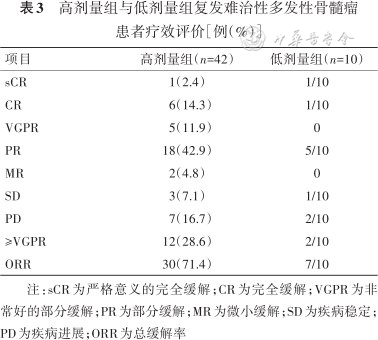
高剂量组与低剂量组复发难治性多发性骨髓瘤患者疗效评价[例(%)]
高剂量组与低剂量组复发难治性多发性骨髓瘤患者疗效评价[例(%)]
| 项目 | 高剂量组(n=42) | 低剂量组(n=10) |
|---|---|---|
| sCR | 1(2.4) | 1/10 |
| CR | 6(14.3) | 1/10 |
| VGPR | 5(11.9) | 0 |
| PR | 18(42.9) | 5/10 |
| MR | 2(4.8) | 0 |
| SD | 3(7.1) | 1/10 |
| PD | 7(16.7) | 2/10 |
| ≥VGPR | 12(28.6) | 2/10 |
| ORR | 30(71.4) | 7/10 |
注:sCR为严格意义的完全缓解;CR为完全缓解;VGPR为非常好的部分缓解;PR为部分缓解;MR为微小缓解;SD为疾病稳定;PD为疾病进展;ORR为总缓解率
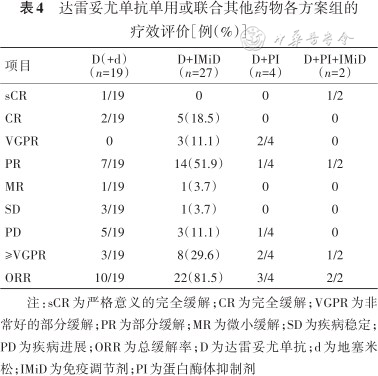
达雷妥尤单抗单用或联合其他药物各方案组的疗效评价[例(%)]
达雷妥尤单抗单用或联合其他药物各方案组的疗效评价[例(%)]
| 项目 | D(+d) (n=19) | D+IMiD (n=27) | D+PI (n=4) | D+PI+IMiD(n=2) |
|---|---|---|---|---|
| sCR | 1/19 | 0 | 0 | 1/2 |
| CR | 2/19 | 5(18.5) | 0 | 0 |
| VGPR | 0 | 3(11.1) | 2/4 | 0 |
| PR | 7/19 | 14(51.9) | 1/4 | 1/2 |
| MR | 1/19 | 1(3.7) | 0 | 0 |
| SD | 3/19 | 1(3.7) | 0 | 0 |
| PD | 5/19 | 3(11.1) | 1/4 | 0 |
| ≥VGPR | 3/19 | 8(29.6) | 2/4 | 1/2 |
| ORR | 10/19 | 22(81.5) | 3/4 | 2/2 |
注:sCR为严格意义的完全缓解;CR为完全缓解;VGPR为非常好的部分缓解;PR为部分缓解;MR为微小缓解;SD为疾病稳定;PD为疾病进展;ORR为总缓解率;D为达雷妥尤单抗;d为地塞米松;IMiD为免疫调节剂;PI为蛋白酶体抑制剂
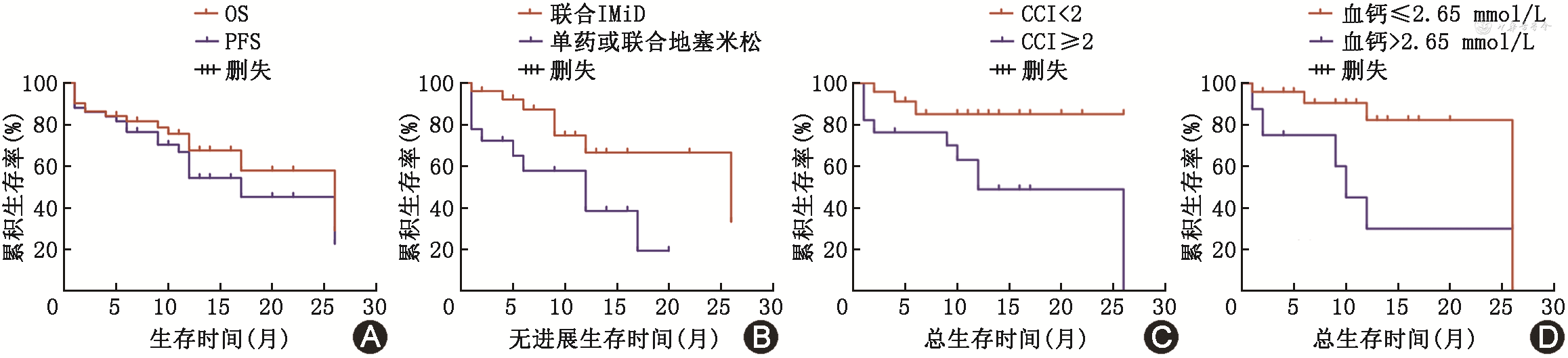
1. PFS:随访时间为7(5,26)个月,1例失访。总体患者中位PFS为17(95%CI:9.6~24.4)个月(图1A)。初次诊断为MM时年龄(HR=1.090,95%CI:1.025~1.060,P=0.006)、达雷妥尤单抗疗程数(HR=0.690,95%CI 0.508~0.938,P=0.018)与PFS相关,达雷妥尤单抗联合IMiD治疗组的PFS优于单药或联合地塞米松治疗组(χ2=6.466,HR=0.231,95%CI:0.075~0.715,P=0.011)(图1B),达雷妥尤单抗剂量对疾病进展无影响(以低剂量为参照,HR=1.016,95%CI:0.221~4.668,P=0.984)。将以上纳入多因素分析后,初次诊断为MM时年龄更大(HR=1.085,95%CI:1.016~1.158,P=0.014)是PFS的危险因素,达雷妥尤单抗疗程数更多(HR=0.669,95%CI:0.495~0.904,P=0.009)是PFS的保护因素。此外,基线各临床特征、达雷妥尤单抗治疗线数对PFS均无影响(表5)。

注:OS为总生存时间;PFS为无进展生存时间;IMiD为免疫调节剂;CCI为Charlson合并症指数
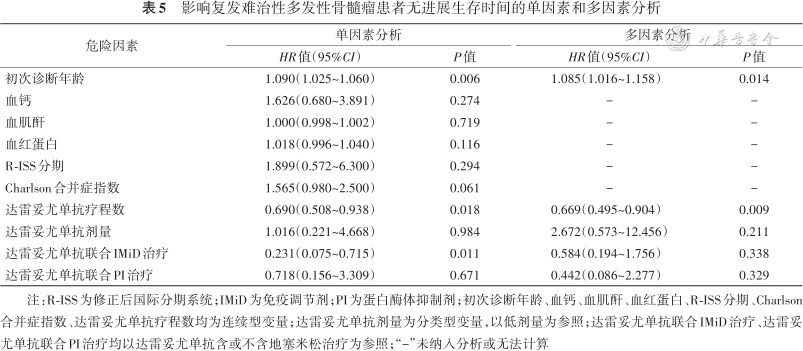
影响复发难治性多发性骨髓瘤患者无进展生存时间的单因素和多因素分析
影响复发难治性多发性骨髓瘤患者无进展生存时间的单因素和多因素分析
| 危险因素 | 单因素分析 | 多因素分析 | ||
|---|---|---|---|---|
| HR值(95%CI) | P值 | HR值(95%CI) | P值 | |
| 初次诊断年龄 | 1.090(1.025~1.060) | 0.006 | 1.085(1.016~1.158) | 0.014 |
| 血钙 | 1.626(0.680~3.891) | 0.274 | - | - |
| 血肌酐 | 1.000(0.998~1.002) | 0.719 | - | - |
| 血红蛋白 | 1.018(0.996~1.040) | 0.116 | - | - |
| R-ISS分期 | 1.899(0.572~6.300) | 0.294 | - | - |
| Charlson合并症指数 | 1.565(0.980~2.500) | 0.061 | - | - |
| 达雷妥尤单抗疗程数 | 0.690(0.508~0.938) | 0.018 | 0.669(0.495~0.904) | 0.009 |
| 达雷妥尤单抗剂量 | 1.016(0.221~4.668) | 0.984 | 2.672(0.573~12.456) | 0.211 |
| 达雷妥尤单抗联合IMiD治疗 | 0.231(0.075~0.715) | 0.011 | 0.584(0.194~1.756) | 0.338 |
| 达雷妥尤单抗联合PI治疗 | 0.718(0.156~3.309) | 0.671 | 0.442(0.086~2.277) | 0.329 |
注:R-ISS为修正后国际分期系统;IMiD为免疫调节剂;PI为蛋白酶体抑制剂;初次诊断年龄、血钙、血肌酐、血红蛋白、R-ISS分期、Charlson合并症指数、达雷妥尤单抗疗程数均为连续型变量;达雷妥尤单抗剂量为分类型变量,以低剂量为参照;达雷妥尤单抗联合IMiD治疗、达雷妥尤单抗联合PI治疗均以达雷妥尤单抗含或不含地塞米松治疗为参照;“-”未纳入分析或无法计算
2. OS:总体患者中位OS为26(95%CI:13.1~38.9)个月(图1A)。单因素分析显示,初次诊断为MM时年龄、血钙和Charlson合并症指数与OS相关,达雷妥尤单抗剂量对患者死亡无影响(以低剂量为参照,HR=0.818,95%CI:0.171~3.917,P=0.802)。将以上因素及达雷妥尤单抗治疗方案纳入多因素分析后,血钙是OS的危险因素(HR=12.190,95%CI:1.170~127.048,P=0.037)。对OS进行亚组分析,Charlson合并症指数<2者OS优于≥2者(χ2=4.64,HR=0.278,95%CI:0.087~0.890,P=0.031),血钙≤2.65 mmol/L者OS优于>2.65 mmol/L者(χ2=4.29,HR=0.198,95%CI:0.043~0.916,P=0.038)(图1C,D)。此外,达雷妥尤单抗治疗线数、细胞遗传学异常、基线各临床特征对OS均无影响(表6)。
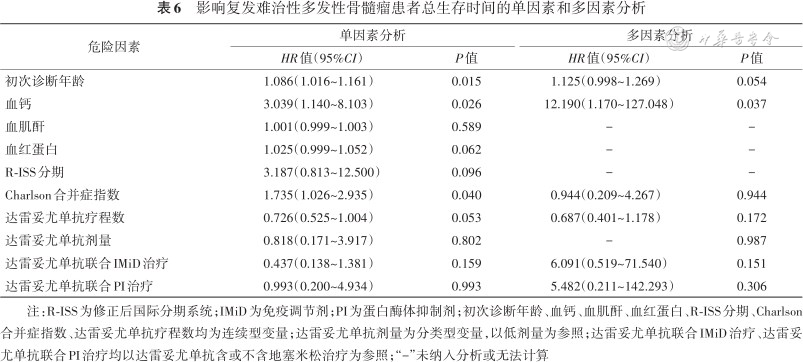
影响复发难治性多发性骨髓瘤患者总生存时间的单因素和多因素分析
影响复发难治性多发性骨髓瘤患者总生存时间的单因素和多因素分析
| 危险因素 | 单因素分析 | 多因素分析 | ||
|---|---|---|---|---|
| HR值(95%CI) | P值 | HR值(95%CI) | P值 | |
| 初次诊断年龄 | 1.086(1.016~1.161) | 0.015 | 1.125(0.998~1.269) | 0.054 |
| 血钙 | 3.039(1.140~8.103) | 0.026 | 12.190(1.170~127.048) | 0.037 |
| 血肌酐 | 1.001(0.999~1.003) | 0.589 | - | - |
| 血红蛋白 | 1.025(0.999~1.052) | 0.062 | - | - |
| R-ISS分期 | 3.187(0.813~12.500) | 0.096 | - | - |
| Charlson合并症指数 | 1.735(1.026~2.935) | 0.040 | 0.944(0.209~4.267) | 0.944 |
| 达雷妥尤单抗疗程数 | 0.726(0.525~1.004) | 0.053 | 0.687(0.401~1.178) | 0.172 |
| 达雷妥尤单抗剂量 | 0.818(0.171~3.917) | 0.802 | - | 0.987 |
| 达雷妥尤单抗联合IMiD治疗 | 0.437(0.138~1.381) | 0.159 | 6.091(0.519~71.540) | 0.151 |
| 达雷妥尤单抗联合PI治疗 | 0.993(0.200~4.934) | 0.993 | 5.482(0.211~142.293) | 0.306 |
注:R-ISS为修正后国际分期系统;IMiD为免疫调节剂;PI为蛋白酶体抑制剂;初次诊断年龄、血钙、血肌酐、血红蛋白、R-ISS分期、Charlson合并症指数、达雷妥尤单抗疗程数均为连续型变量;达雷妥尤单抗剂量为分类型变量,以低剂量为参照;达雷妥尤单抗联合IMiD治疗、达雷妥尤单抗联合PI治疗均以达雷妥尤单抗含或不含地塞米松治疗为参照;“-”未纳入分析或无法计算
达雷妥尤单抗总体安全可控,3级及以上不良事件发生率较低,常见的不良事件发生率由高到低依次为感染、输液相关不良反应、血小板减少。输液相关不良反应均为首次输液时出现,发热最为常见(表7)。
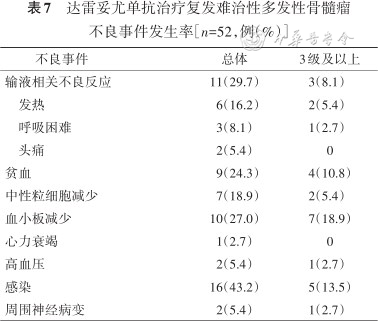
达雷妥尤单抗治疗复发难治性多发性骨髓瘤不良事件发生率[n=52,例(%)]
达雷妥尤单抗治疗复发难治性多发性骨髓瘤不良事件发生率[n=52,例(%)]
| 不良事件 | 总体 | 3级及以上 |
|---|---|---|
| 输液相关不良反应 | 11(29.7) | 3(8.1) |
| 发热 | 6(16.2) | 2(5.4) |
| 呼吸困难 | 3(8.1) | 1(2.7) |
| 头痛 | 2(5.4) | 0 |
| 贫血 | 9(24.3) | 4(10.8) |
| 中性粒细胞减少 | 7(18.9) | 2(5.4) |
| 血小板减少 | 10(27.0) | 7(18.9) |
| 心力衰竭 | 1(2.7) | 0 |
| 高血压 | 2(5.4) | 1(2.7) |
| 感染 | 16(43.2) | 5(13.5) |
| 周围神经病变 | 2(5.4) | 1(2.7) |
本研究结果发现,低剂量组较高剂量组患者初次诊断为MM时年龄更大、血肌酐水平更低。77.1%患者既往对PI和IMiD双耐药,总体患者在行中位2个疗程的达雷妥尤单抗治疗后ORR为71.2%,达雷妥尤单抗与IMiD联合治疗组ORR为81.5%。中位PFS为17个月,中位OS为26个月,血钙升高是OS的危险因素。达雷妥尤单抗治疗总体安全性较好,常见的3级及以上不良事件为血小板减少(18.9%)、感染(13.5%)、输液相关不良反应(8.1%)。
真实世界研究与临床试验数据存在差异,Park等[6]探索了107例不符合GEN501和SIRIUS临床试验纳入标准的RRMM患者行达雷妥尤单抗单药治疗的有效性和安全性,发现ORR为42.1%,中位从随机到第一次进展的时间(PFS1)和从随机到第二次进展的时间(PFS2)分别为3.6、8.1个月,中位OS为11.9个月,预后差于GEN501和SIRIUS临床试验患者;并且东部肿瘤协作组(ECOG)评分≥3分、中性粒细胞减少、血小板减少、肾功能衰竭者PFS1和PFS2显著更差,可能与临床试验将体能状态差、肝肾功能不全、合并症较多、高龄等患者排除在外有关,提示此类患者达雷妥尤单抗治疗、预后、安全性尚需真实世界研究以进一步证实。本研究中84.6%患者行联合治疗,ORR为71.2%,中位PFS为17个月,与Atrash等[7]开展的真实世界研究结论相似。此外,本研究还发现达雷妥尤单抗作为4线及以上治疗者、对PI和IMiD双耐药者、荧光原位杂交(FISH)高危者、国际分期系统(ISS)分期3期、ECOG评分≥2分者、诊断年龄≥65岁者、有慢性肾脏病者、Charlson合并症指数≥2者、血β2微球蛋白>5.5 mg/L者ORR均高于60%,提示真实世界中以上患者经达雷妥尤单抗治疗的效果也较好。
本研究将达雷妥尤单抗分为低剂量(8 mg/kg)组和高剂量(16 mg/kg)组,发现在高达84.6%患者行联合治疗的情况下,低剂量组与高剂量组的ORR、PFS、OS差异均无统计学意义,提示达雷妥尤单抗若与其他新药联合治疗,8 mg/kg剂量可能已足够。既往研究中达雷妥尤单抗16 mg/kg剂量起源于GEN501研究及SIRIUS研究,二者均发现其单药治疗RRMM时,8 mg/kg组的ORR、PFS显著低于16 mg/kg组,因此后续联合治疗的临床试验也大多遵循此剂量[8, 9]。然而达雷妥尤单抗联合IMiD和(或)PI治疗与单药治疗相比,达到相同的疗效,所需的剂量可能不同,并且已有研究报道泊马度胺与达雷妥尤单抗治疗有协同作用,因此联合治疗时达雷妥尤单抗的最佳剂量需进一步探索,以降低高龄、肝肾功能不全等患者的不良反应。但本研究中低剂量组仅占19.2%,样本量较小,后续尚需增加低剂量组样本量和随访时间以进一步证实。
本研究发现达雷妥尤单抗联合IMiD(大多数为来那度胺)组治疗效果最佳,其与达雷妥尤单抗单药或联合地塞米松治疗组相比,ORR及PFS更优,与GEN503临床试验结论相似,该研究发现DRd治疗RRMM的ORR为81.3%,18个月的PFS率为72.1%[10]。此外,本研究发现达雷妥尤单抗联合IMiD与PI治疗组ORR为100%,但样本量较小,需增加此类患者以验证。
本研究还发现诊断年龄大、达雷妥尤单抗疗程数少是PFS的危险因素;基线血钙升高是OS的危险因素,可能与诊断时疾病负荷相关。既往文献提出ISS分期、既往治疗线数、FISH高危、肾功能等影响预后[6, 7,11],而本研究中ISS分期、IMWG危险分层、ECOG评分、FISH高危、既往治疗线数、血β2微球蛋白、白蛋白、血红蛋白、肾功能对预后都无影响,可能与样本量较小相关。本研究中达雷妥尤单抗总体安全性较好,常见的不良事件为感染、输液相关不良反应、血小板减少,既往达雷妥尤单抗治疗的真实世界研究报道中,常见的不良事件为血三系降低(发生率30%~50%)、输液相关不良反应(15%~20%)、感染(23%~50%),本研究不良事件发生率与既往文献相似[12, 13, 14]。
本研究不足之处在于样本量较小,达雷妥尤单抗单药治疗、与PI联合治疗、与PI和IMiD联合治疗组患者较少,难以确切证实不同治疗方案组的疗效及预后差异;此外,达雷妥尤单抗低剂量组患者也较少,难以确切证明不同剂量组的疗效及预后差异。后续尚需进一步扩大样本量、延长随访时间以进一步探索达雷妥尤单抗治疗RRMM的最佳治疗方案及剂量。
所有作者均声明不存在利益冲突



























