
探讨儿童急性淋巴细胞白血病(ALL)大剂量甲氨蝶呤(HD-MTX)治疗后甲氨蝶呤(MTX)排泄延迟的影响因素及MTX排泄延迟、HD-MTX减量对患儿预后的影响。
回顾性分析2015年1月至2020年6月于华中科技大学同济医学院附属同济医院按照中国抗癌协会小儿肿瘤专业委员会(CCCG)-ALL 2015方案诊治的242例ALL患儿的临床资料,其中低危、中高危患儿分别接受3、5 g/m2 MTX化疗4次,监测血清MTX浓度,以给药44 h血清MTX浓度>1 µmol/L为排泄延迟,并分为轻度(>1 µmol/L且≤5 µmol/L)、中度(>5 µmol/L且≤10 µmol/L)和重度(>10 µmol/L)排泄延迟。采用单因素及多因素logistic回归分析MTX排泄延迟的影响因素,采用单因素Cox比例风险模型分析患儿复发的相关因素。
242例ALL患儿共完成962例次HD-MTX化疗,给药44 h血清中位MTX浓度[M(Q1,Q3)]为0.45 µmol/L(0.33 µmol/L,0.72 µmol/L),MTX排泄延迟总发生率为17.7%(170/962),轻、中、重度排泄延迟发生率分别为13.8%(133/962)、2.6%(25/962)、1.2%(12/962)。logistic回归分析结果显示,年龄≥7岁(OR=1.68,95% CI 1.17~2.41,P=0.005)、单次MTX剂量>3 g/m2(OR=2.14,95% CI 1.52~3.03,P<0.001)及首次HD-MTX化疗(OR=2.05,95% CI 1.43~2.93,P<0.001)为MTX排泄延迟的独立危险因素。中位随访50个月(34个月,68个月),12.8%(31/242)患儿复发,中位复发时间30个月(30个月,39个月)。单因素Cox回归分析结果显示,不同性别、免疫表型、危险度、MTX排泄延迟发生次数、HD-MTX化疗完成度(MTX平均剂量与初始计划剂量的比值)患儿复发率差异均无统计学意义(均P>0.05)。
ALL患儿发生MTX排泄延迟的独立危险因素有年龄≥7岁、单次MTX剂量>3 g/m2及首次HD-MTX化疗,MTX排泄延迟及HD-MTX减量对疾病复发无明显影响。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
急性淋巴细胞白血病(ALL)是儿童最常见的血液系统恶性肿瘤,发达国家儿童ALL治愈率已超过90%,我国儿童ALL预后也不断改善[1]。大剂量甲氨蝶呤(HD-MTX)疗法是儿童ALL髓外病变的主要防治手段,但可引起多种不良反应,包括急性肾损伤、严重的黏膜炎、骨髓抑制、胃肠道反应、肝毒性及白质脑病等[2,3],严重影响患儿治疗效果及生命质量。甲氨蝶呤(MTX)相关不良反应常见且往往不可预测,其排泄延迟是引起全身不良反应的主要原因。MTX清除存在较大个体差异,因此接受HD-MTX的患者需严密监测血浆MTX浓度,以便及时调整解救方案,避免不良反应发生[4,5]。HD-MTX治疗ALL目前无标准方法,中国抗癌协会小儿肿瘤专业委员会(CCCG)-ALL 2015方案的HD-MTX疗法是指短时间给予较大剂量MTX以迅速达到峰浓度,并持续较长时间输注小剂量MTX,以实现更大浓度-时间曲线下面积。本研究分析HD-MTX化疗的ALL患儿MTX排泄延迟发生情况及影响因素,并探讨MTX排泄延迟及HD-MTX化疗减量对预后的影响,为ALL患儿的个体化治疗提供依据。
回顾性分析2015年1月至2020年6月在我院儿童血液病专科诊断的初治ALL患儿临床资料。纳入标准:根据骨髓细胞形态学(原始细胞+幼稚淋巴细胞比例≥0.25)及免疫表型确诊为ALL;年龄>1个月且<15岁。排除标准:成熟急性B淋巴细胞白血病(B-ALL);按世界卫生组织(WHO)标准诊断的模糊谱系白血病;慢性粒细胞白血病ALL转变;21-三体综合征,或伴有脏器功能损害的先天性或遗传性疾病;其他继发性白血病;先天免疫缺陷病或代谢性疾病;先天性心脏病伴心功能不全;复发非初治ALL者;在HD-MTX化疗前死亡、复发、主动放弃者,或未在我院行HD-MTX化疗者,或HD-MTX化疗期间MTX浓度数据缺失者。最终242例纳入研究,男女比例为1.5∶1,中位初诊年龄为4.9岁(10个月至14.3岁)。所有患儿和监护人签署知情同意书,本研究经我院伦理委员会批准[批准文号:2020伦审字(S207)号]。
(1)低危组:必要条件(B-ALL满足以下条件之一)包括,年龄≥1岁且≤10岁,同时白细胞计数≤50×109/L;检测染色体数≥50条;ETV6-RUNX1融合基因型。必须排除以下情况,中枢神经系统和(或)睾丸浸润;TCF3-PBX1/t(1;19)、BCR-ABL1/t(9;22)、KMT2A基因重排、检测染色体数<44条、iAMP21;第19天微小残留病(MRD)≥1%。(2)高危组:KMT2A基因重排者,当年龄<6个月且白细胞计数≥300×109/L;第46天MRD≥1%。(3)中危组:所有不能归入低危组及高危组的B-ALL,所有不能归入高危组的急性T淋巴细胞白血病(T-ALL)。
临床低危患儿MTX起始剂量为3 g/m2,中高危患儿为5 g/m2,每2周重复1次,共4次。第0天开始水化尿液(24 h总液量3 L/m2)及碱化尿液(24 h静脉输注5%碳酸氢钠溶液5 ml/kg),共持续4 d,维持尿pH值7~8。第1天MTX先以总量的1/10在0.5 h内滴注,随后0.5 h内行MTX+阿糖胞苷+地塞米松鞘内注射1次,MTX余量于23.5 h内均匀滴注。MTX开始应用42 h后予亚叶酸钙解救(每次15 mg/ m2,每6 h 1次,共3次,根据临床症状及血清MTX浓度进行调整)。化疗期间口服巯嘌呤(25 mg/m2,每晚1次,根据血常规调整剂量)。MTX开始应用44 h采集患者静脉血1~2 ml,离心、取上清液,使用德国西门子公司Viva-E全自动药物浓度分析仪检测血清MTX浓度,每天质控1次。
首次MTX剂量主要根据患儿内生肌酐清除率(CCR)和(或)肾同位素检查结果进行调整:校正CCR为70~85、55~69、40~54、20~39 ml/min分别减量至总量的80%、70%、50%、40%;同时参考诱导缓解阶段的不良反应(骨髓抑制、肝功能损害、感染等)经验性调整剂量。后续MTX剂量根据前次44 h血清MTX浓度进行调整:44 h血清MTX浓度<0.5 µmol/L时,增加原剂量的20%(不超过最大剂量);0.5~1.0 µmol/L时,维持原剂量不变;>1.0 µmol/L时,根据MTX排泄延迟程度,减量20%~60%;同时参考既往化疗不良反应进行剂量调整。
收集患儿基本资料,包括性别、年龄、流式免疫分型、BCR-ABL1融合基因[阳性患儿口服酪氨酸激酶抑制剂(TKI)]、临床危险度以及HD-MTX化疗时身高、体质量、体表面积、体质量指数(BMI)、MTX给药剂量及44 h血清MTX浓度。
MTX排泄延迟定义为给药44 h血清MTX浓度>1 µmol/L,并分为轻度(>1 µmol/L且≤5 µmol/L)、中度(>5 µmol/L且≤10 µmol/L)和重度(>10 µmol/L)。MTX平均剂量为按MTX实际总剂量计算的每次化疗的平均剂量,HD-MTX化疗完成度定义为MTX平均剂量与初始计划剂量(也为最大剂量)的比值。
采用住院、门诊及电话方式随访。复发定义为完全缓解后骨髓原始细胞和(或)幼稚淋巴细胞比例≥0.25,或髓外浸润。随访时间为诊断至死亡或末次随访的时间。随访截至2022年1月。
采用SPSS 26.0软件处理数据及统计学分析,采用GraphPad Prism 8.0软件作图。非正态分布的计量资料以M(Q1,Q3)表示,独立样本组间比较使用Mann-Whitney U检验,患儿历次MTX给药44 h血清MTX浓度比较使用Friedman检验。计数资料以频数(%)表示,组间比较采用χ2检验。采用单因素二分类logistic回归分析MTX排泄延迟的影响因素,将其中P<0.1的变量纳入多因素logistic回归,变量筛选方法为Forward:LR法。采用单因素Cox比例风险模型分析复发的相关因素。以P<0.05为差异有统计学意义。
242例ALL患儿中,临床低、中、高危组分别有131、108、3例,T-ALL患儿26例,BCR-ABL1融合基因阳性10例。低危组与中高危组患儿间性别构成、年龄、身高、体质量、体表面积差异均有统计学意义(均P<0.001),BMI差异无统计学意义(P>0.05)(表1)。52.5%(127/242)患儿至少发生1次MTX排泄延迟。与低危组患儿相比,中高危组MTX排泄延迟发生≥ 2次患儿比例高,MTX实际总剂量和平均剂量高,而HD-MTX化疗完成度低(均P<0.001)(表1)。
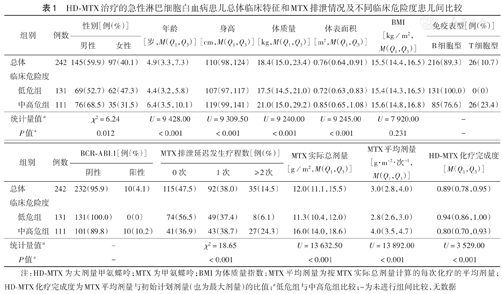
HD-MTX治疗的急性淋巴细胞白血病患儿总体临床特征和MTX排泄情况及不同临床危险度患儿间比较
HD-MTX治疗的急性淋巴细胞白血病患儿总体临床特征和MTX排泄情况及不同临床危险度患儿间比较
| 组别 | 例数 | 性别[例(%)] | 年龄[岁,M(Q1,Q3)] | 身高[cm,M(Q1,Q3)] | 体质量[kg,M(Q1,Q3)] | 体表面积[m2,M(Q1,Q3)] | BMI [kg/m2, M(Q1,Q3)] | 免疫表型[例(%)] | |||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 男性 | 女性 | B细胞型 | T细胞型 | ||||||||
| 总体 | 242 | 145(59.9) | 97(40.1) | 4.9(3.3,7.3) | 110(98,124) | 18.4(15.0,23.4) | 0.76(0.64,0.91) | 15.5(14.4,16.5) | 216(89.3) | 26(10.7) | |
| 临床危险度 | |||||||||||
| 低危组 | 131 | 69(52.7) | 62(47.3) | 4.4(3.2,5.8) | 107(97,117) | 17.5(14.5,21.0) | 0.72(0.63,0.83) | 15.4(14.3,16.5) | 131(100.0) | 0(0) | |
| 中高危组 | 111 | 76(68.5) | 35(31.5) | 6.4(3.5,10.1) | 119(99,141) | 21.0(15.0,29.2) | 0.85(0.65,1.08) | 15.6(14.8,16.8) | 85(76.6) | 26(23.4) | |
| 统计量值a | χ2=6.24 | U=9 428.00 | U=9 309.50 | U=9 240.00 | U=9 245.00 | U=7 920.00 | - | ||||
| P值a | 0.012 | <0.001 | <0.001 | <0.001 | <0.001 | 0.231 | - | ||||
| 组别 | 例数 | BCR-ABL1[例(%)] | MTX排泄延迟发生疗程数[例(%)] | MTX实际总剂量[g/m2,M(Q1,Q3)] | MTX平均剂量[g·m-2·次-1, M(Q1,Q3)] | HD-MTX化疗完成度[M(Q1,Q3)] | ||||
|---|---|---|---|---|---|---|---|---|---|---|
| 阴性 | 阳性 | 0次 | 1次 | ≥2次 | ||||||
| 总体 | 242 | 232(95.9) | 10(4.1) | 115(47.5) | 92(38.0) | 35(14.5) | 12.0(11.1,15.5) | 3.0(2.8,4.0) | 0.89(0.78,0.95) | |
| 临床危险度 | ||||||||||
| 低危组 | 131 | 131(100.0) | 0(0) | 74(56.5) | 49(37.4) | 8(6.1) | 11.3(10.4,12.0) | 2.8(2.6,3.0) | 0.94(0.86,1.00) | |
| 中高危组 | 111 | 101(89.8) | 10(10.2) | 41(36.9) | 43(38.7) | 27(24.3) | 16.0(14.0,18.6) | 4.0(3.5,4.7) | 0.80(0.70,0.93) | |
| 统计量值a | - | χ2=18.65 | U=13 632.50 | U=13 892.00 | U=3 529.00 | |||||
| P值a | - | <0.001 | <0.001 | <0.001 | <0.001 | |||||
注:HD-MTX为大剂量甲氨蝶呤;MTX为甲氨蝶呤;BMI为体质量指数;MTX平均剂量为按MTX实际总剂量计算的每次化疗的平均剂量;HD-MTX化疗完成度为MTX平均剂量与初始计划剂量(也为最大剂量)的比值;a低危组与中高危组比较;-为未进行组间比较,无数据
242例ALL患儿共完成962例次HD-MTX化疗,各次MTX给药44 h血清MTX浓度范围为0.11~46.08 µmol/L,中位浓度0.45 µmol/L(0.33 µmol/L,0.72 µmol/L)。MTX排泄延迟总发生率为17.7%(170/962),轻、中、重度排泄延迟发生率分别为13.8%(133/962)、2.6%(25/962)、1.2%(12/962)。每例患儿历次HD-MTX给药44 h血清MTX浓度变化情况见图1,Friedman检验结果显示,患儿历次HD-MTX化疗间44 h血清MTX浓度的差异有统计学意义(Z=10.23,P=0.017)。
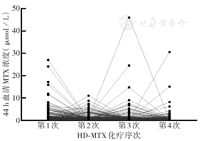

注:MTX为甲氨蝶呤;HD-MTX为大剂量甲氨蝶呤
单因素logistic回归分析显示,962例次HD-MTX化疗中,年龄≥7岁、身高≥120 cm、体质量≥20 kg、体表面积≥0.8 m2、T-ALL、临床中高危组、单次MTX剂量>3 g/m2及首次HD-MTX化疗患儿MTX排泄延迟发生率均较高(均P<0.05),而MTX排泄延迟发生率与性别、BMI及BCR-ABL1融合基因均无关(均P>0.05)(表2)。多因素logistic回归分析显示,年龄≥ 7岁(OR=1.68,95% CI 1.17~2.41,P=0.005)、单次MTX剂量>3 g/m2(OR=2.14,95% CI 1.52~3.03, P<0.001)及首次HD-MTX化疗(OR=2.05,95% CI 1.43~2.93,P<0.001)是HD-MTX排泄延迟的独立危险因素。
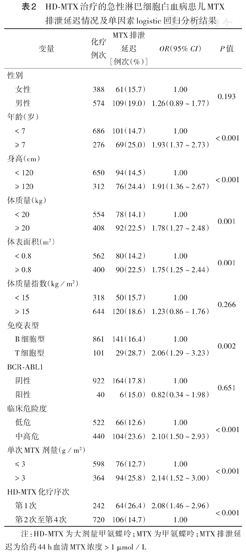
HD-MTX治疗的急性淋巴细胞白血病患儿MTX排泄延迟情况及单因素logistic回归分析结果
HD-MTX治疗的急性淋巴细胞白血病患儿MTX排泄延迟情况及单因素logistic回归分析结果
| 变量 | 化疗例次 | MTX排泄延迟[例次(%)] | OR(95% CI) | P值 | |
|---|---|---|---|---|---|
| 性别 | |||||
| 女性 | 388 | 61(15.7) | 1.00 | 0.193 | |
| 男性 | 574 | 109(19.0) | 1.26(0.89~1.77) | ||
| 年龄(岁) | |||||
| < 7 | 686 | 101(14.7) | 1.00 | <0.001 | |
| ≥ 7 | 276 | 69(25.0) | 1.93(1.37~2.73) | ||
| 身高(cm) | |||||
| < 120 | 650 | 94(14.5) | 1.00 | <0.001 | |
| ≥ 120 | 312 | 76(24.4) | 1.91(1.36~2.67) | ||
| 体质量(kg) | |||||
| < 20 | 554 | 78(14.1) | 1.00 | 0.001 | |
| ≥ 20 | 408 | 92(22.5) | 1.78(1.27~2.48) | ||
| 体表面积(m2) | |||||
| < 0.8 | 562 | 80(14.2) | 1.00 | 0.001 | |
| ≥ 0.8 | 400 | 90(22.5) | 1.75(1.25~2.44) | ||
| 体质量指数(kg/m2) | |||||
| < 15 | 318 | 50(15.7) | 1.00 | 0.266 | |
| ≥ 15 | 644 | 120(18.6) | 1.23(0.86~1.76) | ||
| 免疫表型 | |||||
| B细胞型 | 861 | 141(16.4) | 1.00 | 0.002 | |
| T细胞型 | 101 | 29(28.7) | 2.06(1.29~3.23) | ||
| BCR-ABL1 | |||||
| 阴性 | 922 | 164(17.8) | 1.00 | 0.651 | |
| 阳性 | 40 | 6(15.0) | 0.82(0.34~1.98) | ||
| 临床危险度 | |||||
| 低危 | 522 | 66(12.6) | 1.00 | <0.001 | |
| 中高危 | 440 | 104(23.6) | 2.10(1.50~2.93) | ||
| 单次MTX剂量(g/m2) | |||||
| ≤ 3 | 598 | 76(12.7) | 1.00 | <0.001 | |
| > 3 | 364 | 94(25.8) | 2.14(1.52~3.00) | ||
| HD-MTX化疗序次 | |||||
| 第1次 | 242 | 64(26.4) | 2.08(1.46~2.96) | <0.001 | |
| 第2次至第4次 | 720 | 106(14.7) | 1.00 | ||
注:HD-MTX为大剂量甲氨蝶呤;MTX为甲氨蝶呤;MTX排泄延迟为给药44 h血清MTX浓度>1 µmol/L
242例ALL患儿随访4~85个月,中位随访50个月(34个月,68个月),共31例(12.8%)患儿复发,复发时间4~56个月,中位复发时间为30个月(30个月,39个月),包括单纯骨髓复发19例(7.8%)、单纯中枢神经系统复发7例(2.9%)、骨髓合并髓外复发5例(2.1%)。单因素Cox回归分析显示,性别、免疫表型、临床危险度、MTX排泄延迟疗程数及HD-MTX化疗完成度对患儿复发均无明显影响(均P>0.05)(表3)。
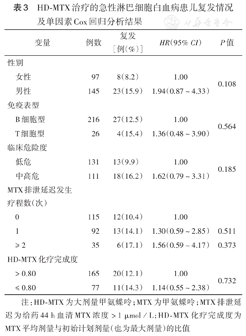
HD-MTX治疗的急性淋巴细胞白血病患儿复发情况及单因素Cox回归分析结果
HD-MTX治疗的急性淋巴细胞白血病患儿复发情况及单因素Cox回归分析结果
| 变量 | 例数 | 复发[例(%)] | HR(95% CI) | P值 | |
|---|---|---|---|---|---|
| 性别 | |||||
| 女性 | 97 | 8(8.2) | 1.00 | 0.108 | |
| 男性 | 145 | 23(15.9) | 1.94(0.87~4.33) | ||
| 免疫表型 | |||||
| B细胞型 | 216 | 27(12.5) | 1.00 | 0.564 | |
| T细胞型 | 26 | 4(15.4) | 1.36(0.48~3.90) | ||
| 临床危险度 | |||||
| 低危 | 131 | 13(9.9) | 1.00 | 0.185 | |
| 中高危 | 111 | 18(16.2) | 1.62(0.79~3.31) | ||
| MTX排泄延迟发生疗程数(次) | |||||
| 0 | 115 | 12(10.4) | 1.00 | ||
| 1 | 92 | 13(14.1) | 1.30(0.59~2.85) | 0.511 | |
| ≥ 2 | 35 | 6(17.1) | 1.56(0.59~4.17) | 0.373 | |
| HD-MTX化疗完成度 | |||||
| > 0.80 | 165 | 20(12.1) | 1.00 | 0.732 | |
| ≤ 0.80 | 77 | 11(14.3) | 1.14(0.55~2.38) | ||
注:HD-MTX为大剂量甲氨蝶呤;MTX为甲氨蝶呤;MTX排泄延迟为给药44 h血清MTX浓度>1 µmol/L;HD-MTX化疗完成度为MTX平均剂量与初始计划剂量(也为最大剂量)的比值
HD-MTX可在肾小管沉淀,并可直接引起肾小管损伤;若存在酸性尿和容量不足,肾损伤风险会增加,进而严重影响MTX的清除[6]。本研究显示,尽管已给予患儿大量的水化、充足的尿液碱化及亚叶酸钙解救等规范治疗,所有疗程中MTX排泄延迟发生率仍为17.7%,而近期发表的一项日本小样本研究显示MTX排泄延迟发生率仅为7.8%[7],可能原因是研究对象选择、MTX残留浓度检测时间、排泄延迟的定义及用药方案等方面存在差异。本研究还发现超过一半的患儿至少发生1次MTX排泄延迟,可见MTX排泄延迟相当常见。因此预测MTX排泄延迟对临床诊疗有重要指导意义。
HD-MTX治疗前消除影响药物排泄的因素是非常必要的,目前研究较多的危险因素包括肾功能障碍、脱水、酸性尿液、同时使用影响MTX清除药物(如TKI、青霉素、质子泵抑制剂、糖皮质激素等)、血管外积液(各种浆膜腔积液)、肥胖等[2,3,8]。与Ramsey等[9]研究结果不同,本研究未发现TKI增加MTX排泄延迟风险,这可能与本研究样本量较小(仅10例患儿BCR-ABL1融合基因阳性)有关,仍需进行前瞻性研究加以验证。本研究发现,大龄儿童、更高MTX剂量、首次HD-MTX化疗更易出现MTX排泄延迟,与既往研究报道基本一致[7,10]。
值得关注的是,本研究中1例重度MTX排泄延迟的患儿前2次HD-MTX疗程中MTX排泄正常,第3次相同剂量给药44 h MTX浓度达46.08 µmol/L,追查病史发现患儿化疗前1周左右出现了一过性尿急、尿痛、尿道口红肿,仅予局部处理,提示隐匿性泌尿系统感染很可能影响MTX排泄。本研究进一步分析发现患儿4次HD-MTX疗程的44 h MTX浓度的波动变化显著,这与Tsurusawa等[11]研究结果一致。这一显著变化也表明了MTX药物代谢在同一个体多次化疗中存在差异,因此首次HD-MTX化疗发生排泄延迟并不意味着后续疗程也会发生该事件;这也提示预测MTX排泄延迟存在极高难度,尤其对于中度、重度排泄延迟的预测更难。MTX重度排泄延迟很可能是偶发事件,如本研究图1所示,对于前次或前2~3次无排泄延迟的患儿,即使未增加剂量仍可能发生MTX重度排泄延迟,体现了MTX体内代谢、清除的复杂性。残留浓度越高意味着药物暴露时间越长,而目前多数研究认为MTX相关不良反应更多地取决于药物暴露的时间,并非峰浓度水平[2,4]。这表明准确预测HD-MTX排泄延迟与毒性的相关性存在极高难度,也提示仅消除药物代谢动力学及药效学相关因素是不够的,临床上还需结合每例患儿具体情况,对HD-MTX起始剂量进行经验性调整,以保证用药安全。
MTX排泄延迟使血浆浓度高于预期而引起全身不良反应增加,这些不良反应不仅会引起化疗中断或药物剂量调整,还可能影响治疗效果、导致肿瘤复发[5]。本研究结果显示,MTX排泄延迟发生疗程数越多的患儿复发风险有升高趋势,HD-MTX化疗完成度低者复发风险也有增加趋势,但经Cox回归分析发现HD-MTX排泄延迟及HD-MTX化疗减量对复发并无影响,仍需大样本、前瞻性研究来验证。
唐氏综合征ALL患儿在HD-MTX化疗中可观察到更多的MTX相关不良反应[12],提示遗传背景这一风险因素不容忽视。目前已有研究表明亚甲基四氢叶酸还原酶(MTHFR)基因的低活性变体对MTX的不良反应有预测作用[13]。此外,MTX排泄途径相关基因(如ABC超家族蛋白)在MTX相关不良反应发生中也可能起关键作用[14],这预示着临床实践中引入药物组学有望提高ALL患儿HD-MTX治疗的安全性和有效性,也有助于评估ALL患儿预后[15]。
本研究存在一定不足。首先,本研究为回顾性研究,在HD-MTX化疗期间其他合并用药(如6-巯基嘌呤)的混杂效应可能对HD-MTX排泄存在一定影响。此外,HD-MTX化疗中残留浓度与临床上化疗不良反应的相关性有待进一步研究。本研究在分析HD-MTX化疗耐受性对ALL患儿预后的影响时,仅分析了MTX残留浓度对复发的影响,未分析其对临床不良反应的影响,可能存在研究偏倚。
所有作者均声明不存在利益冲突



























