
分析肝硬化患者行经颈静脉肝内门体分流术(TIPS)后2年内死亡的危险因素,探讨临床上常见的6种评价系统对TIPS术后死亡危险的预测价值。
回顾分析132例接受TIPS治疗的肝硬化患者的临床资料。按照TIPS术后2年的临床结局,将患者分为死亡组及生存组。采用Logistic回归分析影响TIPS术后2年内的死亡相关危险因素。根据术前及术后1周时CTP、MELD、MELD-Na、BioCliM、FIB-4、ALBI评价系统的评分,应用受试者工作特征曲线(ROC)及其下面积(AUC)评价6种评价系统的死亡危险预测效能。
在TIPS术后2年的随访期内,死亡组的年龄、尿素氮水平、血小板计数及术后1月发生肝性脑病的比例均高于生存组且血钠水平低于生存组(均P<0.05)。多因素分析显示,高龄、术后1月发生肝性脑病是影响患者死亡的独立危险因素(均P<0.05)。术后1周时,生存组和死亡组患者的CTP、MELD、MELD-Na评分的差异有统计学意义(均P<0.05);术后1周时,CTP、MELD、MELD-Na及ALBI评分ROC的AUC分别为0.685、0.721、0.805和0.658,最佳临界值分别为8.5、12.99、14.51和-1.52。
高龄及TIPS术后1月发生肝性脑病是肝硬化患者TIPS术后2年内死亡的独立危险因素,术后1周进行CTP、MELD、MELD-Na、ALBI评价,能够对失代偿期肝硬化患者TIPS术后2年内的死亡危险进行预测,其中MELD-Na的预测效能最佳。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肝硬化门静脉高压可引起一系列严重并发症,如食管胃底静脉曲张破裂出血,顽固性胸、腹水等,是肝硬化死亡的主要原因。肝硬化食管胃底静脉曲张的发生率为30%~70%,其中15%的患者每年会发生破裂出血,而首次出血的死亡率约为30%[1]。据报道,顽固性腹水的发生率为10%左右,1年死亡率高达50%[2]。经颈静脉肝内门体分流(transjugular intrahepatic portosystemic shunt,TIPS)术通过微创治疗在肝静脉及肝内门静脉之间通过支架建立一个通道,从而达到快速降低门静脉压力效果[3]。目前,TIPS术的适应征已从肝硬化食管胃底静脉曲张破裂出血(治疗和预防),顽固性胸、腹水,发展到肝肾综合征、布加综合征等[4]。
临床上较多应用终末期肝病模型(model for end-stage liver disease,MELD)评分、终末期肝病血清钠模型(model for end-stage liver disease-Na,MELD-Na)评分和Child-Turcotte-Pugh(CTP)评分对TIPS术后患者的预后进行评估,但多针对患者的短期预后效果,缺少中长期的随访资料。近期研究结果显示,由于TIPS操作技术的改进,上述评估方法的预测效能有所变化[5,6]。目前,BioCliM、肝纤维化4因子指数(fibrosis index based on the four factors,FIB-4)、白蛋白-胆红素评分(albumin-bilirubin,ALBI)已广泛应用于不同肝病患者的肝功能评价及预后判断,但鲜见于失代偿期肝硬化患者TIPS术后预后的评估[7]。此外,关于影响TIPS术后生存的危险因素尚未完全明确。本研究中,通过回顾性分析行TIPS治疗的食管胃底静脉曲张破裂出血或顽固性胸、腹水的肝硬化患者的2年随访结果,探讨影响TIPS术后2年生存的相关危险因素及各评价系统对患者死亡的预测价值。
选择2014年1月至2018年12月天津市第三中心医院消化科收治的行TIPS治疗的155例患者为研究对象,采集其术后2年的病历资料,终点事件是死亡或进行肝移植。纳入标准:符合肝硬化诊断;存在门静脉高压并发症,即经内镜证实食管胃底静脉曲张破裂出血,初发或再发的经内科保守治疗或内镜下治疗失败的患者;顽固性胸、腹水的患者。其中,肝硬化的诊断标准为《肝硬化诊治指南》[8],食管胃底静脉破裂出血的诊断及分级标准为《肝硬化门静脉高压食管胃静脉曲张出血的防治指南》[9],顽固性胸、腹水的诊断标准为《肝硬化腹水及相关并发症的诊疗指南》[10]。排除标准:TIPS手术失败者;合并肝癌及其他器官恶性肿瘤患者;难以控制的全身感染者;严重心、肺、肾等功能障碍者;患有血液系统疾病者;患布加综合征者;患肝窦阻塞综合征者;接受过肝移植治疗者。
155例患者中有17例因合并肝癌、其他系统肿瘤、严重肾功能不全、布加综合征、肝窦阻塞综合征、进行肝移植等原因排除;有6例因患者失访原因排除。最终,共纳入132例患者,其中男性90例,女性42例,年龄为36~84岁,平均年龄为(57.3±9.4)岁。其中:100例患者因食管胃底静脉曲张破裂出血(esophageal gastric varices bleeding,EVB)行TIPS治疗,32例因顽固性胸、腹水行TIPS治疗;乙型肝炎53例、丙型肝炎13例、酒精性肝炎27例、原发性胆汁性胆管炎10例、自身免疫性肝炎8例,其他原因21例;23例患者在随访期间死亡,100例患者生存。23例死亡患者的死亡原因包括:多脏器功能衰竭1例,心力衰竭2例,肝性脑病2例,消化道出血3例,肝功能衰竭3例,感染6例以及不明原因死亡6例。
本研究已得到天津市第三中心医院伦理委员会批准,且所有患者均签署知情同意书。
回顾分析患者术前和术后2年(每3个月随访1次)的病历资料。术前资料包括TIPS术前的血常规、凝血常规、血生化指标,腹部B超、上腹强化CT等相关检查结果,及术后1周的血常规、凝血常规、血生化指标;术后资料包括复查的血常规、凝血常规、血生化指标,腹部B超检查的支架通畅情况,以及检查肝性脑病、再出血等发生情况。分别计算患者TIPS术前及术后1周的CTP、MELD、MELD-Na、BioCliM、FIB-4及ALBI评分,评分方法如下。
CTP评分包括总胆红素(total bilirubin,TBil)水平、凝血酶原时间(prothrombin time,PT)、白蛋白水平、腹水程度、肝性脑病分级5项指标[6]。根据疾病严重程度,CTP评分可分为3级,其中5~6分为A级,7~9分为B级,10~15分为C级。
MELD评分的计算公式为[6]
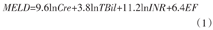
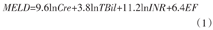
式中:Cre为肌酐(creatinine)水平(mg/dl);TBil为总胆红素水平(mg/dl);INR为国际标准化比值(international normalized ratio),其是患者凝血酶原时间与正常对照凝血酶原时间之比的ISI次方,而ISI为国际敏感度指数(由试剂厂家标定);EF为病因系数(etiologic factor),胆汁淤积性或酒精性为0,其他为1。
MELD-Na评分的计算公式为[6]
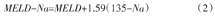
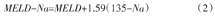
式中:MELD为终末期肝病模型评分;Na为血钠水平(mmol/L),若Na>135 mmol/L,则按135 mmol/L计算;若120 mmol/L≤Na≤135 mmol/L,则按实际数据计算;若Na<120 mmol/L,则按120 mmol/L计算。
BioCliM评分的计算公式为[7]
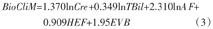
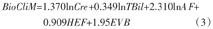
式中:Cre为肌酐水平(mmol/dl);TBil为总胆红素水平(mmol/L);AF为腹水系数(ascites factor),无或易消退时为0,不易消退时为1;HEF为肝性脑病系数(hepatic encephalopathy factor),无或临床易控制时为0,临床不易控制时为1;EVB为食管胃底静脉曲张破裂出血系数,无出血或此次无出血时为0,此次有出血时为1。
FIB-4评分的计算公式为[7]


式中:AGE为年龄(岁);AST为天门冬氨酸氨基转移酶(aspartate aminotransferase)水平(U/L);ALT为丙氨酸氨基转移酶(alaninetransaminase)水平(U/L);PLT为血小板计数(109/L)。
ALBI评分的计算公式为[7]
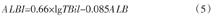
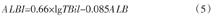
式中:TBil为总胆红素水平(μmol/L);ALB为白蛋白-胆红素水平(g/L)。
使用SPSS 19.0软件进行数据分析。服从正态分布的计量资料以均数±标准差( ±s)表示,组间比较采用t检验;不服从正态分布的偏态计量资料以M(Q1,Q3)表示,组间比较采用Mann-Whitney U秩和检验。计数资料进行组间比较时,当理论数≥5时,采用χ2检验;1≤理论数≤5时,采用连续校正的χ2检验。采用Logistic回归模型进行单因素及多因素分析。应用受试者工作特征(receiver operating characteristic,ROC)曲线评估各评价系统对死亡危险预测的准确性。应用ROC曲线及约登指数获取最佳临界值。以P<0.05为差异有统计学意义。
±s)表示,组间比较采用t检验;不服从正态分布的偏态计量资料以M(Q1,Q3)表示,组间比较采用Mann-Whitney U秩和检验。计数资料进行组间比较时,当理论数≥5时,采用χ2检验;1≤理论数≤5时,采用连续校正的χ2检验。采用Logistic回归模型进行单因素及多因素分析。应用受试者工作特征(receiver operating characteristic,ROC)曲线评估各评价系统对死亡危险预测的准确性。应用ROC曲线及约登指数获取最佳临界值。以P<0.05为差异有统计学意义。
生存组及死亡组的临床资料比较结果,见表1。结果表明,死亡组患者的年龄、血尿素氮(blood urea nitrogen,UN)水平、血小板计数及术后1月发生肝性脑病的比例均高于生存组(均P<0.05),而血钠(Na)水平低于生存组(P<0.05)。此外,TIPS术后1月发生肝性脑病的患者有18例(13.6%),随访2年内死亡9例,死亡率为50.0%,明显高于未发生肝性脑病患者(死亡率12.3%),差异具有统计学意义(χ2=15.372,P<0.01)。
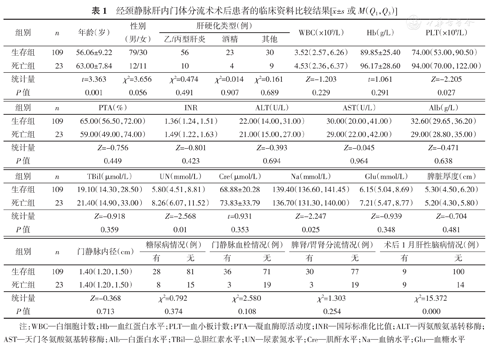
经颈静脉肝内门体分流术术后患者的临床资料比较结果[ ±s或M(Q1,Q3)]
±s或M(Q1,Q3)]
经颈静脉肝内门体分流术术后患者的临床资料比较结果[ ±s或M(Q1,Q3)]
±s或M(Q1,Q3)]
| 组别 | n | 年龄(岁) | 性别(男/女) | 肝硬化类型(例) | WBC(×109/L) | Hb(g/L) | PLT(×109/L) | ||
|---|---|---|---|---|---|---|---|---|---|
| 乙/丙型肝炎 | 酒精 | 其他 | |||||||
| 生存组 | 109 | 56.06±9.22 | 79/30 | 56 | 23 | 30 | 3.52(2.57,6.26) | 89.85±25.40 | 74.00(53.00,90.50) |
| 死亡组 | 23 | 63.00±7.84 | 12/11 | 10 | 4 | 9 | 4.53(2.36,6.37) | 96.17±28.60 | 94.00(70.00,122.00) |
| 统计量 | t=3.363 | χ2=3.656 | χ2=0.474 | χ2=0.014 | χ2=0.161 | Z=-1.203 | t=1.061 | Z=-2.205 | |
| P值 | 0.001 | 0.056 | 0.491 | 0.907 | 0.689 | 0.229 | 0.291 | 0.027 | |
| 组别 | n | PTA(%) | INR | ALT(U/L) | AST(U/L) | Alb(g/L) |
|---|---|---|---|---|---|---|
| 生存组 | 109 | 65.00(56.50,72.00) | 1.36(1.24,1.51) | 22.00(14.00,31.00) | 30.00(20.00,41.00) | 32.60(29.65,36.20) |
| 死亡组 | 23 | 59.00(49.00,74.00) | 1.49(1.22,1.63) | 21.00(15.00,27.00) | 29.00(22.00,42.00) | 29.00(28.80,35.00) |
| 统计量 | Z=-0.756 | Z=-0.801 | Z=-0.393 | Z=-0.045 | Z=-0.471 | |
| P值 | 0.449 | 0.423 | 0.694 | 0.964 | 0.638 |
| 组别 | n | TBil(μmol/L) | UN(mmol/L) | Cre(μmol/L) | Na(mmol/L) | Glu(mmol/L) | 脾脏厚度(cm) |
|---|---|---|---|---|---|---|---|
| 生存组 | 109 | 19.10(14.30,28.50) | 5.80(4.51,8.81) | 68.88±20.28 | 139.40(136.60,141.45) | 6.15(5.04,8.69) | 5.30(4.50,6.20) |
| 死亡组 | 23 | 21.40(14.90,33.00) | 8.26(6.07,11.52) | 73.83±33.79 | 136.70(131.30,140.00) | 7.21(5.47,8.77) | 5.20(4.30,5.80) |
| 统计量 | Z=-0.918 | Z=-2.568 | t=0.931 | Z=-2.247 | Z=-0.939 | Z=-0.704 | |
| P值 | 0.359 | 0.01 | 0.353 | 0.025 | 0.348 | 0.481 |
| 组别 | n | 门静脉内径(cm) | 糖尿病情况(例) | 门静脉血栓情况(例) | 脾肾/胃肾分流情况(例) | 术后1月肝性脑病情况(例) | ||||
|---|---|---|---|---|---|---|---|---|---|---|
| 有 | 无 | 有 | 无 | 有 | 无 | 有 | 无 | |||
| 生存组 | 109 | 1.40(1.20,1.50) | 28 | 81 | 36 | 71 | 30 | 77 | 9 | 100 |
| 死亡组 | 23 | 1.40(1.20,1.50) | 8 | 15 | 3 | 19 | 3 | 19 | 9 | 14 |
| 统计量 | Z=-0.368 | χ2=0.792 | χ2=2.580 | χ2=1.303 | χ2=15.372 | |||||
| P值 | 0.713 | 0.374 | 0.108 | 0.254 | 0.000 | |||||
注:WBC—白细胞计数;Hb—血红蛋白水平;PLT—血小板计数;PTA—凝血酶原活动度;INR—国际标准化比值;ALT—丙氨酸氨基转移酶;AST—天门冬氨酸氨基转移酶;Alb—白蛋白水平;TBil—总胆红素水平;UN—尿素氮水平;Cre—肌酐水平;Na—血钠水平;Glu—血糖水平
单因素Logistic回归分析显示,影响TIPS术后患者预后的因素包括年龄、血小板、血钠、术后1月发生肝性脑病(均P<0.05)。进一步对上述变量进行多因素Logistic回归分析,结果显示年龄、术后1月发生肝性脑病是影响TIPS术后患者预后的独立危险因素(均P<0.05)。(表2)
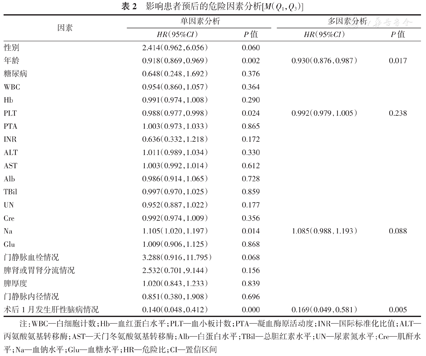
影响患者预后的危险因素分析[M(Q1,Q3)]
影响患者预后的危险因素分析[M(Q1,Q3)]
| 因素 | 单因素分析 | 多因素分析 | ||
|---|---|---|---|---|
| HR(95%CI) | P值 | HR(95%CI) | P值 | |
| 性别 | 2.414(0.962,6.056) | 0.060 | ||
| 年龄 | 0.918(0.869,0.969) | 0.002 | 0.930(0.876,0.987) | 0.017 |
| 糖尿病 | 0.648(0.248,1.692) | 0.376 | ||
| WBC | 0.954(0.860,1.057) | 0.364 | ||
| Hb | 0.991(0.974,1.008) | 0.290 | ||
| PLT | 0.988(0.977,0.998) | 0.024 | 0.992(0.979,1.005) | 0.238 |
| PTA | 1.003(0.973,1.033) | 0.865 | ||
| INR | 0.636(0.332,1.218) | 0.172 | ||
| ALT | 1.011(0.989,1.034) | 0.330 | ||
| AST | 1.003(0.992,1.014) | 0.612 | ||
| Alb | 0.986(0.914,1.065) | 0.728 | ||
| TBil | 0.997(0.970,1.025) | 0.859 | ||
| UN | 0.952(0.887,1.022) | 0.177 | ||
| Cre | 0.992(0.974,1.009) | 0.356 | ||
| Na | 1.105(1.020,1.197) | 0.014 | 1.085(0.988,1.193) | 0.088 |
| Glu | 1.009(0.906,1.125) | 0.868 | ||
| 门静脉血栓情况 | 3.288(0.916,11.795) | 0.068 | ||
| 脾肾或胃肾分流情况 | 2.532(0.701,9.144) | 0.156 | ||
| 脾厚度 | 1.020(0.843,1.233) | 0.839 | ||
| 门静脉内径情况 | 0.851(0.380,1.908) | 0.696 | ||
| 术后1月发生肝性脑病情况 | 0.140(0.048,0.412) | 0.000 | 0.169(0.049,0.581) | 0.005 |
注:WBC—白细胞计数;Hb—血红蛋白水平;PLT—血小板计数;PTA—凝血酶原活动度;INR—国际标准化比值;ALT—丙氨酸氨基转移酶;AST—天门冬氨酸氨基转移酶;Alb—白蛋白水平;TBil—总胆红素水平;UN—尿素氮水平;Cre—肌酐水平;Na—血钠水平;Glu—血糖水平;HR—危险比;CI—置信区间
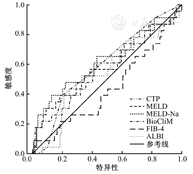
TIPS术前,生存组和死亡组患者的CTP、MELD、MELD-Na、BioCliM、FIB-4及ALBI评分的差异均无统计学意义(均P>0.05),见表3。ROC曲线分析结果显示,CTP、MELD、MELD-Na、BioCliM、FIB-4、ALBI评分,在术前对患者预后评估价值的AUC分别为0.596(95%CI:0.472~0.720,P=0.149)、0.586(95%CI:0.444~0.728,P=0.196)、0.620(95%CI:0.479~0.761,P=0.070)、0.571(95%CI:0.433~0.708,P=0.287)、0.442(95%CI:0.307~0.576,P=0.379)、0.540(95%CI:0.408~0.673,P=0.547),见图1。上述结果表明,在术前CTP、MELD、MELD-Na、BioCliM、FIB-4及ALBI评价系统对失代偿期肝硬化患者TIPS术后2年内的死亡危险没有预测效能。

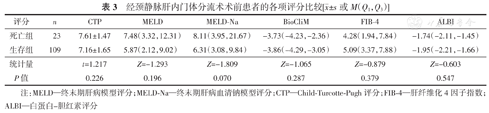
经颈静脉肝内门体分流术术前患者的各项评分比较[ ±s或M(Q1,Q3)]
±s或M(Q1,Q3)]
经颈静脉肝内门体分流术术前患者的各项评分比较[ ±s或M(Q1,Q3)]
±s或M(Q1,Q3)]
| 评分 | n | CTP | MELD | MELD-Na | BioCliM | FIB-4 | ALBI |
|---|---|---|---|---|---|---|---|
| 死亡组 | 23 | 7.61±1.47 | 7.48(3.32,12.31) | 8.11(3.95,21.67) | -3.73(-4.23,-2.36) | 4.28(1.94,7.84) | -1.74(-2.11,-1.45) |
| 生存组 | 109 | 7.16±1.65 | 5.87(2.12,9.02) | 6.31(3.08,9.84) | -3.86(-4.29,-3.05) | 5.09(3.37,7.88) | -1.95(-2.21,-1.66) |
| 统计量 | t=1.217 | Z=-1.293 | Z=-1.809 | Z=-1.065 | Z=-0.879 | Z=-0.603 | |
| P值 | 0.226 | 0.196 | 0.070 | 0.287 | 0.379 | 0.547 |
注:MELD—终末期肝病模型评分;MELD-Na—终末期肝病血清钠模型评分;CTP—Child-Turcotte-Pugh评分;FIB-4—肝纤维化4因子指数;ALBI—白蛋白-胆红素评分
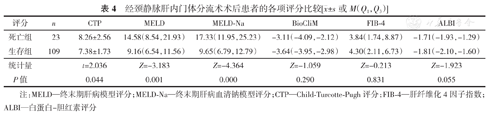
TIPS术后1周,死亡组的CTP、MELD、MELD-Na评分较生存组明显升高,差异具有统计学意义(均P<0.05),而二者的BioCliM、FIB-4及ALBI评分的差异无统计学意义(均P>0.05)。(表4)
经颈静脉肝内门体分流术术后患者的各项评分比较[ ±s或M(Q1,Q3)]
±s或M(Q1,Q3)]
经颈静脉肝内门体分流术术后患者的各项评分比较[ ±s或M(Q1,Q3)]
±s或M(Q1,Q3)]
| 评分 | n | CTP | MELD | MELD-Na | BioCliM | FIB-4 | ALBI |
|---|---|---|---|---|---|---|---|
| 死亡组 | 23 | 8.26±2.56 | 14.58(8.54,21.93) | 17.33(11.95,25.23) | -3.11(-4.09,-2.12) | 3.84(1.74,8.87) | -1.71(-1.93,-1.29) |
| 生存组 | 109 | 7.38±1.73 | 9.16(6.54,11.56) | 9.65(6.79,12.79) | -3.64(-3.95,-2.98) | 4.30(2.11,6.73) | -1.81(-2.10,-1.60) |
| 统计量 | t=2.036 | Z=-3.183 | Z=-4.364 | Z=-1.059 | Z=-0.213 | Z=-1.923 | |
| P值 | 0.044 | 0.001 | 0.000 | 0.290 | 0.831 | 0.055 |
注:MELD—终末期肝病模型评分;MELD-Na—终末期肝病血清钠模型评分;CTP—Child-Turcotte-Pugh评分;FIB-4—肝纤维化4因子指数;ALBI—白蛋白-胆红素评分
对于TIPS术后1周时预后评估价值,CTP、MELD、MELD-Na、ALBI评分的ROC曲线AUC分别为0.685(95%CI:0.553~0.816,P=0.006)、0.721(95%CI:0.565~0.877,P=0.001)、0.805(95%CI:0.674~0.937,P=0.000)和0.658(95%CI:0.531~0.785,P=0.020)。(图2)
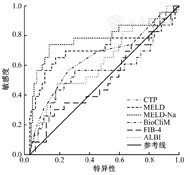

根据ROC曲线和约登指数,在随访期为2年的情况下,CTP、MELD、MELD-Na及ALBI评分的最佳临界值分别为8.5、12.99、14.51和-1.52,敏感性分别为56.5%、65.2%、73.9%和47.8%,特异性分别为74.1%、82.6%、86.2%和79.8%。
失代偿期肝硬化以门静脉高压和肝功能严重损伤为特征,EVB和腹水是最常见并发症及死亡原因[1,2]。TIPS手术可显著降低门静脉压力,但术后引起的肝性脑病、肝功能恶化可能影响患者的预后,从而一定程度上限制了TIPS的应用[11]。很多研究者对TIPS术后患者的预后进行了研究,但尚未得出统一的结论[6,7,8,9,10,11,12]。因此寻找一种可以对TIPS的预后进行准确、客观评估的方法具有重要的临床价值。
Pateria等[13]的研究结果表明,TIPS术后患者1年内的累计死亡率为29.1%,5年累计死亡率为56.1%。本研究结果显示,失代偿期肝硬化患者TIPS术后2年内的死亡率为17.4%。既往研究结果显示,TIPS术后的生存率与年龄、肌酐水平、胆红素水平、血小板水平、自发性腹膜炎、感染性休克等因素有关[14]。本研究结果显示,年龄、术后1月发生肝性脑病是TIPS术后患者预后的独立危险因素,且年龄越高,TIPS术后发生死亡的危险越高,该结果与Bai等[6]的研究结果一致。分析其原因,一方面是由于年龄相关的肝脏储备功能下降[15],另一方面是高龄患者往往心、肺、肾功能较差,导致术后与感染、脏器功能衰竭相关的死亡危险增加。
据报道,TIPS术后发生肝性脑病的比例为20%~50%,大部分患者发生肝性脑病出现在术后3个月内[16]。本研究中,患者在TIPS术后1月内发生肝性脑病的比例为14.1%,与既往报道数据一致[6]。TIPS手术会增加肝性脑病的发病率,主要由于人为门-体分流道的建立,使含氨有毒物质未经肝脏代谢而直接进入体循环[16,17]。TIPS术后早期反复发作肝性脑病增加大患者的远期死亡率[12],本研究结果也显示,TIPS术后1月内发生肝性脑病患者的死亡率较未发生肝性脑病患者明显升高,达50.0%。该结果提示,临床工作中对于接受TIPS治疗的患者,术后应积极预防肝性脑病的发生,以期改善患者预后。
Young等[5]的研究结果表明,MELD、MELD-Na评价对于TIPS术后患者30 d内的死亡危险有一定的预测价值,而对于1年的死亡危险预测价值不佳。本研究结果显示,在TIPS术前进行CTP、MELD、MELD-Na、BioCliM、FIB-4、ALBI评价,不能对患者的2年内死亡危险进行预测,这与Young等的结果是一致的;而在术后1周进行的MELD、MELD-Na、CTP、ALBI评价,可用于失代偿期肝硬化患者TIPS术后2年内的死亡危险预测。Young等[5]的研究结果显示,MELD评分较MELD-Na评分能更好地预测TIPS术后患者的短期死亡危险,而本研究结果显示,MELD-Na评分在TIPS术后1周时的预测的效能最佳,此时当MELD-Na≥14.51时,患者2年内的死亡危险较高。
近年来,ALBI评分成为一个研究热点,相关研究在不同肝病患者的肝功能及预后判断上取得了一定的进展。一些研究者认为,ALBI评分与肝静脉压力梯度有很好的相关性,可用于预测肝硬化急性上消化道出血患者的病死率[18],ALBI评分可用于不同肝病患者肝功能及预后的判断[7]。但在本研究中,ALBI评分虽能用于预测失代偿期肝硬化患者TIPS术后的死亡危险,但预测效能欠佳,原因可能与ALBI评分只包含了胆红素、白蛋白等肝脏功能指标,未包括肾功能、心脏功能等指标有关,可能需要联合其他全身指标提高其预测效能。
综上所述,高龄、术后1月发生肝性脑病是TIPS术后患者预后的独立危险因素。术后1周时,CTP、MELD、MELD-Na及ALBI评分可作为失代偿期肝硬化患者TIPS术后2年内的死亡危险预测指标,其中MELD-Na评分的预测效能较佳。临床上,对于接受TIPS治疗的失代偿期肝硬化患者,应积极防止其发生肝性脑病,尽早识别高危患者并及时进行肝移植治疗,从而改善患者的预后。由于本研究中的样本量较少且为单中心研究,尚不排除选择性偏倚对结果产生影响的可能,未来需要扩大样本量并进行多中心研究,以进一步验证结果。
所有作者均声明不存在利益冲突



























