
回顾性分析1例在石家庄市中医院内分泌科就诊的合并心血管疾病高危因素的2型糖尿病患者,在使用司美格鲁肽治疗的同时,联合胰岛素及口服药物的诊疗过程。患者为47岁男性,因“发现血糖升高6个月,口干、多饮10 d”入院,入院后完善相关检查,明确诊断为2型糖尿病。在给予司美格鲁肽皮下注射、二甲双胍口服及胰岛素泵强化降糖治疗后,调整治疗方案为司美格鲁肽皮下注射联合二甲双胍,血糖平稳达标,患者满意度高。司美格鲁肽是一种可与其他降糖药物联合使用的、药物作用靶点广泛的胰高糖素样肽-1受体激动剂,除有效控制血糖外,还能获得血脂、血压、体重、心血管保护等多重获益。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
司美格鲁肽是胰高糖素样肽-1(glucagon-like peptide-1,GLP-1)受体激动剂,它与天然人GLP-1氨基酸序列具有94%的同源性,可以改善血压、血糖、血脂、体重等多种心血管疾病的危险因素;半衰期约为7 d,每周1次皮下给药,依从性高,可作为长期治疗方案。我们报道1例2型糖尿病患者,在使用司美格鲁肽及其他降糖药物治疗后,多重获益明确,临床效果满意,患者认可度高,期望在将来临床治疗中,为各位同仁治疗思路提供参考。
患者 男,47岁。主因“发现血糖升高6个月,口干、多饮10 d”入院。患者6个月前体检发现血糖升高,空腹血糖10 mmol/L,患者未予重视,饮食、运动控制不严格,未就诊治疗,未系统监测血糖。10 d前,患者出现口干、多饮症状,无多食易饥,尿量约1 500~2 000 ml/d,无明显体重变化。10 d来,患者单纯通过控制饮食及适当运动控制血糖,未应用药物,自行监测空腹血糖波动于12~15 mmol/L,餐后血糖未监测,为进一步诊治就诊我院门诊。查空腹血糖15.3 mmol/L,糖化血红蛋白(glycated hemoglobin A1c,HbA1c)10.4%,尿白蛋白/肌酐比值15.3 mg/g,收入石家庄市中医院内分泌一科。近6个月来,患者偶有乏力,无视物模糊,无恶心、呕吐,无四肢手套、袜套样改变,无间歇性跛行,无双下肢水肿,尿中无泡沫,二便大致正常,体重无明显下降。既往史:脂肪肝、高脂血症病史多年,未应用药物治疗,近期未复查。否认手术、外伤史,否认食物及药物过敏史。吸烟史30年,约20支/d,饮酒史30年,现每月约饮酒1~2次,饮酒量每次不足50 g。父亲有高血压、冠心病病史,母亲有糖尿病病史。入院查体:身高165.0 cm,体重90.7 kg,体重指数33.3 kg/m2,腰围114 cm,臀围124.5 cm。生命体征平稳。神志清楚,精神可。体型肥胖,浅表淋巴结无肿大。双侧肢体深浅感觉对称存在。入院后查空腹C肽3.7 ng/ml,胰岛素24.08 μU/ml,空腹血糖16.2 mmol/L,胰岛细胞抗体、胰岛素自身抗体及谷氨酸脱羧酶抗体均为阴性,血酮体0.1 mmol/L,尿酮阴性,尿糖3+,血浆胆固醇4.99 mmol/L,甘油三酯3.58 mmol/L,低密度脂蛋白胆固醇3.77 mmol/L,高密度脂蛋白胆固醇0.82 mmol/L。患者为中年男性,病史较短,数次监测空腹血糖≥7.0 mmol/L,HbA1c≥6.5%,糖尿病诊断明确。患者体型肥胖,有糖尿病家族史,无自发酮症酸中毒倾向,考虑2型糖尿病可能性大。患者发病时间短,入院后查血糖水平高,空腹C肽及胰岛素水平处于参考值正常范围内,糖尿病相关抗体检查结果回报为阴性,除外1型糖尿病及成人隐匿性自身免疫糖尿病的诊断。患者既往无腹部手术、无胰腺炎症及肿瘤性疾病、甲状腺疾病、肾上腺疾病等其他内分泌疾病病史,无激素等特殊用药史,无新型冠状病毒等病毒感染病史,故不考虑其余病因导致的特殊类型糖尿病。故患者2型糖尿病诊断明确。入院后予司美格鲁肽0.25 mg、1次/周皮下注射,二甲双胍0.5 g、3次/d口服,联合胰岛素泵强化治疗,调节全天基础量为24.4 U(0∶00—4∶00用量为0.5 U/h,4:00—9∶00用量为1.5 U/h,9:00—17∶00用量为1.0 U/h,17:00—21∶00用量为1.2 U/h,21:00—24∶00用量为0.7 U/h),三餐前分别给予8 U餐时量皮下注射,根据血糖调节降糖药物用量,患者血糖水平逐渐下降,撤除胰岛素泵前,司美格鲁肽应用剂量为0.25 mg,1次/周皮下注射,二甲双胍0.5 g,2次/d口服,胰岛素泵全天基础量为12.2 U(0∶00—4∶00用量为0.25 U/h,4:00—9∶00用量为0.75 U/h,9:00—17∶00用量为0.5 U/h,17:00—21∶00用量为 0.6 U/h,21:00—24∶00用量为0.35 U/h),三餐前分别给予5 U餐时量皮下注射。患者空腹血糖控制于5~6 mmol/L,餐后血糖控制于7~10 mmol/L。患者平素工作繁忙,且工作环境复杂,反复强调每日注射治疗方案无法依从,可依从周制剂注射药物治疗或口服药物治疗;故调整降糖方案为司美格鲁肽0.5 mg、1次/周皮下注射,二甲双胍0.5 g、3次/d口服治疗,无明显恶心、腹胀、腹泻、便秘等消化系统症状,患者血糖控制满意(表1),遵医嘱出院。出院后患者门诊随诊,并根据血糖调整降糖方案。3个月后,患者应用司美格鲁肽1.0 mg、1次/周皮下注射。因患者合并心血管疾病,给予二甲双胍、恩格列净改善预后并较单用二甲双胍减少服药次数,提高依从性。复查空腹C肽3.5 ng/ml,胰岛素20.08 μU/ml,空腹血糖6.6 mmol/L,HbA1c 7.0%,血浆总胆固醇3.99 mmol/L,甘油三酯1.46 mmol/L,低密度脂蛋白胆固醇2.37 mmol/L,高密度脂蛋白胆固醇0.92 mmol/L。自行监测血糖,空腹波动于4.5~6.7 mmol/L,餐后波动于5.5~8.9 mmol/L。体重78.5 kg,体重指数28.8 kg/m2,腰围96 cm,臀围103.5 cm。患者血糖达标,未出现低血糖,血脂、体重指数等多重心血管危险因素得到显著改善,临床效果满意。
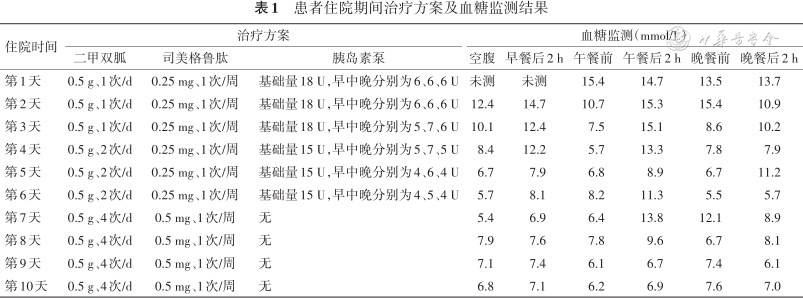
患者住院期间治疗方案及血糖监测结果
患者住院期间治疗方案及血糖监测结果
| 住院时间 | 治疗方案 | 血糖监测(mmol/L) | |||||||
|---|---|---|---|---|---|---|---|---|---|
| 二甲双胍 | 司美格鲁肽 | 胰岛素泵 | 空腹 | 早餐后2 h | 午餐前 | 午餐后2 h | 晚餐前 | 晚餐后2 h | |
| 第1天 | 0.5 g、1次/d | 0.25 mg、1次/周 | 基础量18 U,早中晚分别为6、6、6 U | 未测 | 未测 | 15.4 | 14.7 | 13.5 | 13.7 |
| 第2天 | 0.5 g、1次/d | 0.25 mg、1次/周 | 基础量18 U,早中晚分别为6、6、6 U | 12.4 | 14.7 | 10.7 | 15.3 | 15.4 | 10.9 |
| 第3天 | 0.5 g、1次/d | 0.25 mg、1次/周 | 基础量18 U,早中晚分别为5、7、6 U | 10.1 | 12.4 | 7.5 | 15.1 | 8.6 | 10.2 |
| 第4天 | 0.5 g、2次/d | 0.25 mg、1次/周 | 基础量15 U,早中晚分别为5、7、5 U | 8.4 | 12.2 | 5.7 | 13.3 | 7.8 | 7.9 |
| 第5天 | 0.5 g、2次/d | 0.25 mg、1次/周 | 基础量15 U,早中晚分别为4、6、4 U | 6.7 | 7.9 | 6.8 | 8.9 | 6.7 | 11.2 |
| 第6天 | 0.5 g、2次/d | 0.25 mg、1次/周 | 基础量15 U,早中晚分别为4、5、4 U | 5.7 | 8.1 | 8.2 | 11.3 | 5.5 | 5.7 |
| 第7天 | 0.5 g、4次/d | 0.5 mg、1次/周 | 无 | 5.4 | 6.9 | 6.4 | 13.8 | 12.1 | 8.9 |
| 第8天 | 0.5 g、4次/d | 0.5 mg、1次/周 | 无 | 7.9 | 7.6 | 7.8 | 9.6 | 6.7 | 8.1 |
| 第9天 | 0.5 g、4次/d | 0.5 mg、1次/周 | 无 | 7.1 | 7.4 | 6.1 | 6.7 | 7.4 | 6.1 |
| 第10天 | 0.5 g、4次/d | 0.5 mg、1次/周 | 无 | 6.8 | 7.1 | 6.2 | 6.9 | 7.6 | 7.0 |
本例患者入院时血糖水平高,同时合并高血脂、肥胖等多种心血管疾病危险因素,HbA1c>9.0%,《中国2型糖尿病防治指南(2020年版)》建议给予胰岛素强化治疗[1]。2021版美国糖尿病学会指南也推荐对于合并动脉粥样硬化性心血管疾病或者心血管高危因素的患者,应在二甲双胍基础上联合具有心血管获益的GLP-1受体激动剂。故为快速解除高糖状态,同时获得长期获益,给予胰岛素泵模拟生理胰岛素分泌模式,以期改善胰岛β细胞功能[2]。经过治疗后,患者血糖趋于平稳,考虑将院内治疗方案过渡为院外治疗方案,方案的制定充分考虑药物的有效性、安全性,患者的长期获益及治疗的依从性,故调整为司美格鲁肽皮下注射,二甲双胍、恩格列净口服,根据患者血糖水平,对药物剂量进行调整,血糖控制平稳。
GLP-1是由31个氨基酸组成的胰高糖素样肽,由肠道的L细胞分泌,在发挥降糖作用[3]的同时,还具有脑保护、改善脂代谢、增强胰岛素敏感性等多重作用靶点。在血液循环系统中,二肽基肽酶Ⅳ(dipeptidyl peptidase Ⅳ,DPP-4)可快速分解GLP-1而使其快速灭活[4],所以人体天然GLP-1的半衰期只有1~2 min,不能持续作用而产生更大临床获益。司美格鲁肽作为通过分子结构变化而衍生出的GLP-1类似物,攻克了这个难题,以稳定的血浆浓度达到有效的治疗效果。首先,将天然GLP-1的第8位氨基酸进行替换,由之前的丙氨酸变成α-氨基异丁酸,由此改变DPP-4的剪切位点,抵抗DPP-4的降解作用,延长了半衰期;其次,在26位赖氨酸上通过间隔基连接一个碳18脂肪二酸的侧链,从而使分子能够更加紧密地与白蛋白结合,减少肾脏的清除和分子本身的降解,进一步延长半衰期;最后,为了防止脂肪酸侧链结合到错误的赖氨酸上,对第34位的赖氨酸也进行了相应的替换,替换成了精氨酸。所以司美格鲁肽的结构中,与天然人GLP-1分子相比,只替换了2个氨基酸,与天然GLP-1的同源性是94%,而其半衰期能延长到7 d,也实现每周1次注射的频率,大大减少了注射次数,提高了患者依从性。
GLP-1受体激动剂主要作用于胰岛β细胞,促进胰岛素的合成和分泌,刺激β细胞的增殖和分化,抑制β细胞的凋亡,增加β细胞数量,具有保护胰岛功能的作用,还可以作用于胰岛α细胞,抑制胰高糖素的释放,减少肝糖的释放。GLP-1受体激动剂还能作用于胰岛δ细胞,促进生长抑素的分泌,参与抑制胰高糖素的分泌,并且增强胰岛素的敏感性,起到降糖的作用,同时它还可以作用于下丘脑,抑制食欲,延缓胃的排空[5, 6],增加饱腹感,并改变人体对饮食(如咸食、甜品、乳制品等)的偏好等,而起到减重的作用[7, 8]。并且,有研究表明,应用司美格鲁肽在有效控制体重的同时,仍然可维持正常的基础代谢率,防止机体消耗的应激性下调,有利于长期减重治疗及治疗方案的维持[9, 10]。
随着治疗理念的更新,指南对于心血管获益的关注也日益提升。司美格鲁肽同样进行了心血管结局的临床试验研究,研究结果显示,司美格鲁肽通过改善血糖、血脂、血压等多重心血管疾病高危因素,取得心血管临床获益。其降低主要不良心血管事件发生风险达26%,降低非致死性卒中发生风险达39%,并且SUSTAIN(Semaglutide Unabated Sustainability in Treatment of Type 2 Diabetes)6的研究结果同样提示该药物可以改善肾脏临床预后[11]。另外,关于药物之间的相互作用,司美格鲁肽与阿托伐他汀钙片、华法林、地高辛、二甲双胍等药物联合应用,并不会影响这些药物的血药浓度等药代动力学参数,所以在应用上述这些药物治疗的同时,应用司美格鲁肽是无需调整药物治疗剂量的。关于司美格鲁肽的药物安全性,通过对美国食品与药品监督管理局不良事件报告系统数据库的总结分析发现,使用司美格鲁肽的人群,应注意消化道不良反应、低血糖发生风险,同时对于存在糖尿病视网膜病变、急性胰腺炎、梗阻性胆管疾病及胰腺肿瘤的患者,以及新型冠状病毒肺炎患者均应谨慎应用该药物[12]。
综上,随着目前生活质量的提高,糖尿病的发病率逐年升高,2022美国糖尿病学会糖尿病诊疗标准中推荐的一线治疗方式,取决于糖尿病患者存在的合并症,同时以患者为中心的治疗因素和管理需求,通常包括二甲双胍和全面生活方式改变。对于2型糖尿病患者以及肥胖人群选择GLP-1受体激动剂优于胰岛素,对于明确有动脉粥样硬化性心血管疾病或高风险患者,依然推荐使用GLP-1受体激动剂。GLP-1受体激动剂周制剂的使用,大大提高了患者治疗依从性,在有效降糖的基础上,可取得长期心血管获益,有利于实现患者综合管理目标的长期达标。
所有作者声明无利益冲突



























