
分析1例在山东中医药大学第一临床医学院内分泌科治疗的肥胖2型糖尿病患者,在使用大剂量胰岛素治疗后血糖控制仍不达标,加用司美格鲁肽序贯治疗的诊治过程,并进行相关资料复习。患者为58岁男性,因“发现血糖升高3年”入院,入院后完善相关检查,糖尿病分型诊断为2型糖尿病。既往长期使用胰岛素每日1次皮下注射联合口服降糖药物控制血糖,胰岛素最大剂量用至42 U/d,血糖控制仍不达标。入院后调整降糖方案,司美格鲁肽起始0.5 mg(1次/周)皮下注射,后逐渐加量至1.0 mg(1次/周),联合胰岛素睡前16 U(1次/d)、阿卡波糖50 mg(3次/d)、达格列净片10 mg(1次/d)、西格列汀100 mg(1次/d),血糖控制良好,患者满意。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
司美格鲁肽是一种新型的胰高糖素样肽-1受体激动剂(glucagon-like peptide-1 receptor agonist,GLP-1RA),通过连接脂肪二酸侧链以促进和白蛋白的结合,同时替换氨基酸使半衰期逐渐延长为7 d,大大减少了患者的注射次数,提高依从性。司美格鲁肽代谢方式类似大分子蛋白,没有特定的代谢器官,而是在组织中广泛代谢,因此用药不受肝肾功能影响[1]。全球多中心大型临床试验SUSTAIN系列研究共纳入11 000余例糖尿病患者,其中包括605例中国糖尿病患者,证实了司美格鲁肽良好的降糖疗效、安全性和心血管代谢获益。我们报道1例肥胖2型糖尿病(type 2 diabetes mellitus,T2DM)患者在长期大剂量胰岛素治疗后血糖控制仍不达标,加用司美格鲁肽治疗后取得良好效果,以期为后续同类患者的治疗提供参考。
患者 男,58岁。主因“发现血糖升高3年”入院。患者3年前于单位健康体检时发现血糖升高,空腹血糖为12.4 mmol/L,诊断为T2DM。予长效胰岛素12 U皮下注射联合二甲双胍治疗,后因二甲双胍不耐受,换用阿卡波糖,后期血糖控制长期不理想,自行调整胰岛素用量,最大剂量用至42 U/d,血糖控制仍不达标。1个月前复测空腹血糖14.9 mmol/L,糖化血红蛋白12.5%,C肽2.18 ng/ml,空腹胰岛素8.24 μU/ml,稳态模型评估胰岛素抵抗指数(homeostasis model assessment-insulin resistance,HOMA-IR)5.46(>2.69存在胰岛素抵抗),糖尿病自身抗体谱中指标均为阴性。查尿糖3+,尿酮体±,尿微量白蛋白/肌酐比值为68.71 mg/g,求进一步诊治收入山东中医药大学第一临床医学院内分泌科。近1个月来患者自述口干、口渴,偶有视物模糊,尿中泡沫较多,手足发麻,晨起明显,无恶心、呕吐,无胸闷、心慌,无双下肢水肿,精神、食欲可,二便如常,近半年体重增加5 kg。既往否认冠心病、高血压、慢性肾脏病史。高脂血症病史5年,中度脂肪肝病史3年。否认食物及药物过敏史。否认吸烟饮酒史。家族中父亲有糖尿病史,否认高血压、冠心病家族史。
入院查体:身高172.0 cm,体重89.8 kg,体重指数30.35 kg/m2,颈围41 cm,腰围115 cm,臀围126 cm。体温36.4 ℃,脉搏82 次/min,呼吸18 次/min,血压126/78 mmHg(1 mmHg=0.133 kPa)。神志清楚,精神可。体形肥胖,全身皮肤黏膜无黄染,浅表淋巴结未及肿大。心、肺、腹部查体无明显异常。双下肢无水肿,肌力、肌张力正常。生理反射存在,病理反射未引出。双侧足背动脉搏动正常,双下肢痛觉、温度觉正常。
实验室及辅助检查:(1)常规化验检查:尿葡萄糖3+,尿酮体±,24 h尿蛋白定量0.97 g/24 h,尿微量白蛋白/肌酐比值92.43 mg/g,低密度脂蛋白胆固醇4.83 mmol/L,甘油三酯2.88 mmol/L,总胆固醇7.65 mmol/L;血常规、大便常规、感染系列、男性肿瘤系列、凝血功能、肝功能、心肌酶、电解质均未见异常。(2)糖尿病相关检查:空腹血糖12.6 mmol/L,糖化血红蛋白13.8%,糖化白蛋白32.4%。口服葡萄糖耐量试验、胰岛素、C肽释放试验结果见表1。(3)辅助检查:心电图未见明显异常。心脏彩色超声示二尖瓣、三尖瓣轻度返流;腹部彩色超声示中度脂肪肝;颈动脉彩色超声示双颈总动脉内-中膜增厚;四肢血管彩色超声示双下肢轻度动脉粥样硬化,双侧足背动脉散在斑块;甲状腺彩色超声示甲状腺多发胶质囊肿。(4)肌电图:上下肢周围神经损害,累及感觉及运动纤维。
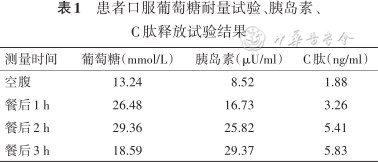
患者口服葡萄糖耐量试验、胰岛素、C肽释放试验结果
患者口服葡萄糖耐量试验、胰岛素、C肽释放试验结果
| 测量时间 | 葡萄糖(mmol/L) | 胰岛素(μU/ml) | C肽(ng/ml) |
|---|---|---|---|
| 空腹 | 13.24 | 8.52 | 1.88 |
| 餐后1 h | 26.48 | 16.73 | 3.26 |
| 餐后2 h | 29.36 | 25.82 | 5.41 |
| 餐后3 h | 18.59 | 29.37 | 5.83 |
结合患者的临床特征,中年男性,慢性长期病程,体型肥胖,多次测得空腹血糖处于较高水平,尿中存在酮体持续弱阳性情况,单纯调整胰岛素用量无法降低患者血糖水平,且会造成过量胰岛素在体内堆积,增加患者体重,并有低血糖风险。患者既往无急慢性胰腺炎、胰腺肿瘤、腹部创伤、胰腺切除、肾上腺疾病等其他内分泌疾病、特殊用药、病毒感染病史,可排除上述病因导致的特殊类型糖尿病,糖尿病的分型诊断为T2DM。入院后以补液消除酮体为首要治疗,加用司美格鲁肽0.5 mg(1次/周),待尿酮体转阴后再加达格列净10 mg(1次/d),原胰岛素逐渐减量,2周后调整司美格鲁肽1.0 mg(1次/周),此时长效胰岛素已减至22 U/d,患者血糖得到极大改善,空腹血糖维持在7~8 mmol/L,但餐后血糖仍高于正常上限,故加用西格列汀100 mg(1次/d),稳定1周后遵医嘱出院(表2)。出院医嘱为司美格鲁肽1.0 mg(1次/周)+胰岛素16 U(1次/d)+阿卡波糖50 mg(3次/d)+达格列净10 mg(1次/d)+西格列汀100 mg(1次/d),出院后随访1周,患者血糖水平控制平稳,胰岛素减至14 U/d,嘱患者门诊随诊。
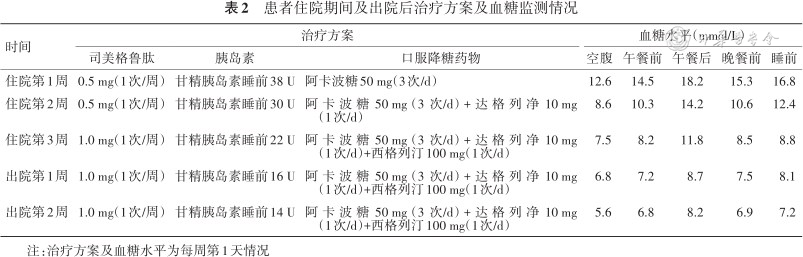
患者住院期间及出院后治疗方案及血糖监测情况
患者住院期间及出院后治疗方案及血糖监测情况
| 时间 | 治疗方案 | 血糖水平(mmol/L) | ||||||
|---|---|---|---|---|---|---|---|---|
| 司美格鲁肽 | 胰岛素 | 口服降糖药物 | 空腹 | 午餐前 | 午餐后 | 晚餐前 | 睡前 | |
| 住院第1周 | 0.5 mg(1次/周) | 甘精胰岛素睡前38 U | 阿卡波糖50 mg(3次/d) | 12.6 | 14.5 | 18.2 | 15.3 | 16.8 |
| 住院第2周 | 0.5 mg(1次/周) | 甘精胰岛素睡前30 U | 阿卡波糖50 mg(3次/d)+达格列净10 mg(1次/d) | 8.6 | 10.3 | 14.2 | 10.6 | 12.4 |
| 住院第3周 | 1.0 mg(1次/周) | 甘精胰岛素睡前22 U | 阿卡波糖50 mg(3次/d)+达格列净10 mg(1次/d)+西格列汀100 mg(1次/d) | 7.5 | 8.2 | 11.8 | 8.5 | 8.8 |
| 出院第1周 | 1.0 mg(1次/周) | 甘精胰岛素睡前16 U | 阿卡波糖50 mg(3次/d)+达格列净10 mg(1次/d)+西格列汀100 mg(1次/d) | 6.8 | 7.2 | 8.7 | 7.5 | 8.1 |
| 出院第2周 | 1.0 mg(1次/周) | 甘精胰岛素睡前14 U | 阿卡波糖50 mg(3次/d)+达格列净10 mg(1次/d)+西格列汀100 mg(1次/d) | 5.6 | 6.8 | 8.2 | 6.9 | 7.2 |
注:治疗方案及血糖水平为每周第1天情况
在我国居民不良饮食节律、生活作息压力下,T2DM患病率逐年升高,与正常人群相比,肥胖者有着较高的T2DM风险[2, 3]。临床降糖治疗过程中,胰岛素以其高效降糖作用得以在临床广泛应用,但其长期使用所导致的体重增加等不良反应不仅会加重T2DM患者胰岛β细胞负荷和胰岛素抵抗,而且存在较高低血糖风险。新型GLP-1RA司美格鲁肽通过作用于下丘脑中的胰高糖素样肽-1受体引起食欲减退,能量摄入减少,胃排空过程延缓,已被证实对T2DM和肥胖患者有确切疗效,同时可以通过增加尿钠排泄、改善内皮功能,产生心肾获益[4, 5]。司美格鲁肽最常见的不良反应是患者胃肠道症状,而临床研究发现和日制剂利拉鲁肽相比,不良反应发生率大幅度降低[6, 7, 8]。Wharton等[9]通过对STEP系列试验中司美格鲁肽所导致的胃肠道不良反应的严重程度进行评估发现,其所导致的胃肠道反应很少会引起治疗中断事件的发生。司美格鲁肽经外周注射进入脑内后,主要作用于下丘脑和后脑区域,刺激该区域参与食欲调节的神经元活动,从而减少食欲和能量摄入[10]。同时,动物实验结果显示,司美格鲁肽在减肥的情况下能维持新陈代谢活动,防止能量消耗代偿性下调,从而助于长期减肥或维持[11]。临床研究结果显示,司美格鲁肽引起一天随意用餐的总能量摄入平均减少24%,为利拉鲁肽的2倍。与胰岛素合用,在血糖控制达标前提下,司美格鲁肽能够显著减少胰岛素用量,进而降低大剂量应用胰岛素所带来的不良反应,使胰岛素效益最大化[12, 13, 14]。
司美格鲁肽的临床使用方法为每周1次皮下注射,可选择一天中的任意时间,无需根据进餐时间给药。起始剂量一般为0.25 mg,逐渐加量至1.0 mg(1次/周),不推荐超过1.0 mg。推荐每次剂量稳定4周后再行调整,临床使用过程中发现,大部分患者耐受情况良好,2~3周即可调整剂量,以求尽早达到最佳临床疗效浓度水平。应美国食品药品监督管理局要求,3种GLP-1RA周制剂(司美格鲁肽、艾塞那肽周制剂、度拉糖肽)在心血管结局试验中的结果显示,司美格鲁肽能显著改善多项心血管代谢危险因子、减低非致死性卒中风险、进一步改善肾脏结局[15]。与胰岛素相比,司美格鲁肽在有效降低T2DM患者的血糖、糖化血红蛋白水平时,还能修复胰岛β细胞,引起低血糖风险低,同时还能综合化管理心血管危险因素。司美格鲁肽可以与多种口服药物联合使用,但需要注意与不同类型降糖药物联合使用时,应结合口服降糖药物的特点,灵活调整药物用量,尤其是与磺脲类药物联合治疗时,需注意低血糖发生风险。与胰岛素联合使用时,可明显减少胰岛素用量,且与胰岛素互补,降低胰岛素所导致的体重增加。
本例患者体型肥胖,长期大剂量应用胰岛素治疗血糖控制仍不达标,胰岛素抵抗明显。入院后加用司美格鲁肽素每周1次,联合阿卡波糖、达格列净、西格列汀治疗,其中胰岛素联合达格列净控制空腹血糖,阿卡波糖三餐前嚼服配合西格列汀有效控制餐后血糖,联合用药可稳定患者一天血糖情况,同时加用司美格鲁肽,减重降糖,抑制食欲,延缓胃排空,减少糖分摄入,同时在防治患者并发症等远期效果方面疗效显著。后续还将持续观察患者的血糖控制情况和体重变化,并监测不良反应。
新型降糖药物的不断研发上市,为糖尿病患者的诊疗提供了更多灵活便捷的治疗方案,在有效控制血糖达标的同时,对减少不良反应、延缓糖尿病并发症进展、保护心肾功能效果愈发显著。在应用新型司美格鲁肽时,我们需要结合患者血糖水平、胰岛β细胞功能、体重指数等具体情况,制定合理的个体化治疗方案。司美格鲁肽因其独特的药物代谢动力学特点,可以每周1次皮下注射,同时可以与多种降糖药物、胰岛素联合使用,提高患者依从性,实现血糖的长期达标,给患者带来更大获益。
所有作者声明无利益冲突



























