
探讨伴凝血功能异常的多发性骨髓瘤临床特征、实验室检查结果以及诊疗方案。
回顾性分析南京医科大学第一附属医院2019、2020年收治的2例伴凝血功能异常多发性骨髓瘤患者的诊疗经过,并复习相关文献。
2例患者在多发性骨髓瘤起病时均出现凝血功能异常。其中1例出现出血症状,1例无出凝血症状。在对症支持治疗的基础上给予积极治疗后,2例患者的凝血功能均有好转,且在多发性骨髓瘤达完全缓解的情况下凝血功能恢复正常,但其后随着多发性骨髓瘤控制不佳,凝血功能也再次发生异常。
伴凝血功能异常多发性骨髓瘤患者的凝血功能指标与疾病控制程度有关,且可出现严重出血症状,需在治疗原发病的同时积极治疗凝血功能障碍。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
多发性骨髓瘤(MM)是一种以单克隆浆细胞异常增殖为特征的恶性疾病,主要可引起骨质破坏、肾功能不全、贫血、高钙血症等,少部分患者可有出血表现,但合并严重凝血功能障碍的患者少见[1]。现将我们收治的2例伴凝血功能异常MM患者的临床表现、诊疗经过报道如下。
例1,男性,69岁,因乏力伴双下肢水肿半个月余,于2019年11月就诊于我院。患者2019年10月中旬无明显诱因出现全身乏力,行走受限。既往有慢性肾炎史。查体:可见贫血貌,右侧大腿外侧可触及质韧包块,大小约15 cm×3 cm,皮温高、有压痛。血常规:白细胞计数(WBC)24.44×109/L,血红蛋白(Hb)63 g/L,血小板计数(Plt)339×109/L;生化系列:清蛋白28.7 g/L,球蛋白32.6 g/L,肌酐936.2 μmol/L,钾5.22 mmol/L;凝血功能检查结果见表1。双下肢B型超声:右侧大腿外侧肌层内见大小约155 mm×34 mm囊实性回声区(考虑血肿可能)。因患者存在严重的肾功能异常合并高钾血症,立即行床旁连续性肾脏替代治疗,并予红细胞及新鲜血浆输注、补充维生素K1等治疗,但凝血功能未见明显改善(表1)。活化部分凝血活酶时间(APTT)纠正试验:即刻未纠正。抗心磷脂抗体、Ⅷ因子以及Ⅸ因子抑制物滴度测定均未见异常。进一步检查发现,血清蛋白电泳:M蛋白9.09%(5.57 g/L)。血清免疫固定电泳:IgD-λ+λ阳性。血清游离轻链:κ 17.6 mg/L,λ 2 400 mg/L,κ/λ为0.007;尿轻链:κ 8.787 mg/24 h,λ 857.82 mg/24 h。24 h尿蛋白定量1.1 g。骨髓形态学:原始幼稚浆细胞比例0.304。骨髓病理:幼稚浆细胞约占有核细胞40%。骨髓流式细胞学:异常浆细胞占11.5%,表达CD138、CD38、CD56、cλ。免疫荧光原位杂交(FISH):1q21扩增阳性,p53缺失阴性,IgH重排阴性。胸腹部CT平扫:右侧胸壁及髂骨后缘皮下软组织内多发软组织密度结节影(考虑血肿可能)。诊断为MM[IgD-λ+λ轻链双克隆型,DS分期Ⅲ期B组,国际分期系统(ISS)分期Ⅲ期,修订的国际分期系统(R-ISS)分期Ⅱ期];凝血功能异常。予以PCD(硼替佐米+环磷酰胺+地塞米松)方案化疗,同时给予新鲜冰冻血浆、止血等对症支持治疗。化疗第11天复查凝血功能接近正常(表1)。PCD方案化疗4个疗程后,评估病情达严格的完全缓解(sCR),微小残留病(MRD)阴性。复查凝血功能恢复正常(表1)。原方案化疗共计7个疗程(当时疾病评估sCR)后患者自行停止治疗。2021年2月患者右下肢外伤后出现局部血肿,伴口腔血疱。血常规:WBC 18.91×109/L,Hb 38 g/L,Plt 181×109/L,生化系列:肌酐670.8 μmol/L,凝血检查再次出现APTT和凝血酶原时间(PT)明显延长(表1)。血栓弹力图试验:有肝素样物质残留。采用骨髓瘤相关指标评估病情,考虑疾病复发,调整为IPD(伊沙佐米+泊马度胺+地塞米松)方案化疗,同时予血浆、重组人凝血因子Ⅶa、硫酸鱼精蛋白、血浆置换等治疗,患者右下肢血肿较前有所好转,但左腰部及左胸部出现新发血肿,化疗第4天由于出血性休克死亡。
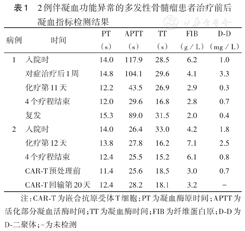
2例伴凝血功能异常的多发性骨髓瘤患者治疗前后凝血指标检测结果
2例伴凝血功能异常的多发性骨髓瘤患者治疗前后凝血指标检测结果
| 病例 | 时间 | PT(s) | APTT(s) | TT(s) | FIB(g/L) | D-D(mg/L) |
|---|---|---|---|---|---|---|
| 1 | 入院时 | 14.0 | 117.9 | 28.5 | 6.2 | 1.0 |
| 对症治疗后1周 | 14.8 | 104.1 | 29.6 | 4.1 | 3.3 | |
| 化疗第11天 | 12.2 | 43.5 | 26.9 | 2.9 | 0.3 | |
| 4个疗程结束 | 12.0 | 29.6 | 16.8 | 2.8 | 0.7 | |
| 复发 | 15.3 | 89.0 | 31.5 | 2.0 | 0.4 | |
| 2 | 入院时 | 14.0 | 26.4 | 33.0 | 4.2 | 1.8 |
| 化疗第12天 | 13.8 | 27.8 | 16.2 | 7.1 | 2.5 | |
| 4个疗程结束 | 12.4 | 25.5 | 15.2 | 6.1 | 0.8 | |
| CAR-T预处理前 | 11.4 | 25.6 | 18.5 | 3.0 | 0.7 | |
| CAR-T回输第20天 | 12.4 | 28.2 | 18.1 | 3.2 | - |
注:CAR-T为嵌合抗原受体T细胞;PT为凝血酶原时间;APTT为活化部分凝血活酶时间;TT为凝血酶时间;FIB为纤维蛋白原;D-D为D-二聚体;-为未检测
例2,女性,57岁,因腰痛1个月余,于2020年9月就诊。患者2020年8月无明显诱因下出现腰部胀痛,伴下肢乏力。查体可见贫血貌。血常规:WBC 5.80×109/L,Hb 74 g/L,Plt 46×109/L。生化系列:清蛋白29.9 g/L,球蛋白73.1 g/L,肌酐62.6 μmol/L。APTT和PT正常,凝血酶时间(TT)明显延长(表1),TT纠正试验:纠正。血栓弹力图:存在肝素样抗凝物。抗ENA抗体、抗核抗体、抗心磷脂抗体均未见明显异常。IgG 55.5 g/L。血清免疫固定电泳:IgG-κ阳性。尿免疫固定电泳:IgG-κ+κ轻链阳性。血清游离轻链:κ 4 100 mg/L,λ 5.15 mg/L,κ/λ为796.1。尿轻链:κ 8 712 mg/24 h,λ<90.0 mg/24 h。24 h尿蛋白定量3.0 g。骨髓形态学:原始幼稚浆细胞比例0.68。骨髓病理:幼稚浆细胞约占有核细胞80%。骨髓流式细胞学:异常浆细胞占21.98%,表达CD138、CD38、CD56、cκ。FISH:1q21扩增阳性,p53缺失阳性,IgH重排阳性,t(4;14)阳性,t(14;16)阴性,t(11;14)阴性。PET-CT:全身多发性骨质密度减低伴局部骨质破坏,氟代脱氧葡萄糖(FDG)代谢增高。诊断为MM(IgG-κ型,DS分期Ⅲ期A组,ISS分期Ⅲ期,R-ISS分期Ⅲ期);凝血功能异常。予PDD(硼替佐米+脂质体多柔比星+地塞米松)方案化疗1个疗程,同时予新鲜冰冻血浆输注。化疗第12天复查凝血功能较前有所改善(表1)。考虑患者为高危核型,后予R-PDD(来那度胺+硼替佐米+脂质体多柔比星+地塞米松)方案化疗3个疗程。4个疗程后查凝血功能未能恢复正常(表1),评估病情达部分缓解(PR)。为进一步控制疾病,2021年1月行自体造血干细胞采集,3月查血清蛋白电泳:28.54%(21.3 g/L),评估疾病进展(PD),行自体造血干细胞移植挽救治疗。2021年5月评估病情仍为PR,遂至外院行嵌合抗原受体T细胞(CAR-T)治疗,凝血功能检查结果见表1。予FC(氟达拉滨+环磷酰胺)方案预处理后,序贯回输CD19 CAR-T和BCMA CAR-T。回输第12天患者出现发热,细胞因子释放综合征(CRS)1级,存在骨髓抑制。回输第20天凝血功能检查结果见表1。患者因血液学不良反应回当地医院继续治疗,尚未进行病情评估。
凝血功能异常是MM常见的并发症之一[2,3],约15%的患者可表现为出血[4]。MM引起的出血可表现为瘀斑、皮下血肿、眼底或眶周出血、消化道出血,严重者可出现脑出血、多脏器出血,甚至危及生命[5]。出血症状常发生于MM终末阶段,此时出血发生率可达33%[6,7]。
MM致凝血功能异常的机制暂不明确,患者体内升高的单克隆免疫球蛋白可能通过抑制纤维蛋白单体聚合而影响纤维蛋白形成[7],导致TT延长;部分患者体内检出的抗Ⅷ因子物质可引起FⅧ缺乏[3]。除此之外,带负电的λ轻链同源二聚体能够干扰血管性血友病因子(vWF)的A1结构域[8],从而影响APTT。Cesarman-Maus等[9]对55种MM胞株和223种实体瘤细胞株进行比较,发现所有MM细胞株都缺乏FⅢ表达,这可能与部分MM患者PT延长相关。有研究显示,MM患者体内存在类肝素样物质,其形成及作用机制尚不完全明确[10]。高浓度的M蛋白一直被认为是导致凝血功能障碍的关键因素[11]。
本组2例患者在MM起病时都伴有不同程度凝血功能异常。例1为肾衰竭的双克隆型MM(IgD-λ+λ轻链型),是一种罕见类型。患者入院时出现下肢血肿,凝血功能异常以APTT延长为主。MM合并凝血功能异常患者的凝血功能指标常存在APTT延长[11],且是IgA型MM患者预后的独立危险因素[2]。例2患者虽无出血症状,但出现了明显TT延长。Saif等[4]发现TT延长显著增加MM患者的出血风险。另有研究发现TT与M蛋白浓度呈正相关[11,12]。本组2例患者在针对MM进行治疗后,凝血功能及症状均得到改善。值得注意的是,2例患者治疗前都检出了类肝素样物质,化疗后凝血功能均恢复正常。因此,我们推测MM细胞分泌的类肝素样物质是引起患者凝血功能异常的重要原因。
MM合并凝血功能障碍诊断时需排除抗凝或止血药物的影响,例如肝素的使用可能引起TT延长;此外,还需排除其他原发性出凝血疾病,例如获得性血管性血友病综合征(AvWS),该病常表现为皮肤黏膜自发出血或侵入性操作后出血,实验室检查常提示FⅧ:C减少、APTT延长,但AvWS患者常出现出血时间异常,并可通过纠正试验纠正[13]。第二种常见的原发性出血性疾病为获得性纤维蛋白原血症,该病可表现为纤维蛋白原活性降低,但纤维蛋白原抗原水平正常,同时存在PT、TT延长,可通过这些指标进行鉴别诊断[14]。
MM合并凝血功能障碍需要在对症支持治疗的基础上针对MM进行积极治疗。这类患者在原发病得到控制后,凝血功能也随之恢复正常,当疾病再次复发时,可再次出现凝血功能异常,且可能伴随严重的出血症状。在化疗的选择上,免疫调节剂相较于蛋白酶体抑制剂更适合应用于具有出血风险的患者[15]。Hiroi等[16]报道硼替佐米可增强内皮细胞蛋白C的活化能力,增强抗凝作用;相反,沙利度胺可能帮助改善MM患者的凝血因子缺乏。此外,针对出血患者,需寻找引起凝血功能异常的途径或因子,以针对性地给予凝血因子、纤溶抑制剂、硫酸鱼精蛋白、精氨酸、血管升压素等治疗[17]。需要注意的是,MM患者常合并肾功能不全,部分患者需进行肾脏替代,而血液透析或滤过的过程中使用的抗凝药物可能增加出血风险。本组例1患者进行了肾脏替代治疗,因此对于这类患者需要警惕由肾脏替代治疗引起的出血加重。
综上所述,MM引起的凝血功能异常并不少见,其中以严重出血起病者则相对罕见。这类疾病发病机制尚不明确,需在治疗原发病的同时需针对凝血障碍进行对症支持治疗,以降低出血风险。MM引起的凝血功能障碍的严重程度与疾病本身相关,在原发病缓解后大多可得到改善。
所有作者均声明不存在利益冲突



























