
中枢性性早熟(CPP)是指因下丘脑-垂体-性腺轴功能提前启动而导致女童8岁前、男童9岁前出现内、外生殖器官快速发育及第二性征呈现的一种常见的儿科内分泌疾病。促性腺素释放激素类似物(GnRHa)是临床上治疗CPP的首选用药,国内目前以3.75 mg/月缓释的短效剂型(1M剂型)应用最多,而长效剂型的开发将会减少患儿注射次数,降低临床就诊负担。目前亮丙瑞林微球3个月的长效剂型(3M剂型,规格:11.25 mg)已在国内获批上市,但鉴于现阶段国内对于亮丙瑞林3M剂型的临床实践经验较为缺乏,因此,对该剂型的现有临床证据进行综述,以期为临床应用提供循证医学支持。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
随着社会经济的发展,卫生条件、营养状况的改善,近年来,可在世界范围内观察到性成熟整体提前趋势[1,2]。在此背景下,儿童中枢性性早熟(CPP)的发病率也在逐年升高[3,4],成为社会关注的焦点。CPP对机体的影响主要表现为:性发育过早,引起女童初潮早;骨骼成熟进展较快,骨龄(BA)超过实际年龄(CA)而骨骺提前愈合,影响患儿的终身高;第二性征过早发育及性成熟,可能带来相应的心理问题或社会行为异常,严重影响儿童身心健康[5,6]。基于CPP发病机制较明确,目前国内外普遍应用促性腺激素释放激素类似物(GnRHa)治疗CPP,包括曲普瑞林、亮丙瑞林、布舍瑞林、戈舍瑞林和组氨瑞林等几种药物,剂型有3.75 mg缓释剂[每4周肌内注射或皮下注射(1M剂型)]、11.25 mg或30.00 mg的长效缓释剂[每3个月注射1次(3M剂型)]、22.50 mg的长效缓释剂(每6个月注射1次)以及12个月50.00 mg的皮下植入缓释剂型(此剂型需要通过外科手术,进行皮下埋置缓释泵)[7]。目前,醋酸亮丙瑞林11.25 mg是国内唯一获批用于CPP治疗的3M剂型药物。因此,本综述主要针对亮丙瑞林3M剂型的疗效和安全性进行汇总分析,以期给临床用药带来一些理论证据支持。
亮丙瑞林为亲水性多肽类药物,不易透过生物膜,在胃肠道中不稳定,易被消化酶降解,口服给药生物利用度极低(<0.1%),又由于其在体液内不稳定,半衰期只有16 h,不宜制成口服制剂和普通的注射剂[8]。因此,亮丙瑞林缓释制剂设计采用微球技术。微球指药物溶解或分散于高分子材料中形成的微小球状实体,球形或类球形,粒径1~250 μm[9]。作为药物的载体,载药微球通常使用生物可降解材料。1995年每3个月注射1次的亮丙瑞林微球缓释制剂被美国食品药品监督管理局(FDA)批准用于临床。亮丙瑞林3M剂型采用乳酸聚合物(PLA)作为注射用微球骨架材料,其具有无毒、无免疫刺激性、很好的生物降解性和生物相容性等特点[10,11]。微球直径约20 μm,呈良好球形形态,载药量为12%,药物分散在PLA基质中并通过微球含有诸多窄小孔道释放,注射后微球滞留在注射部位,微球缓释技术通过零级释放(衡量消除)方式保证人体相对恒定的血药浓度[12,13]。随着药物的释放,微球逐渐在生物体内分解,最终形成水和二氧化碳排出体外[10,14]。
由于微球快速释放了活性物质,因此血浆亮丙瑞林浓度在注射后数天内升高,随后降低,并在3个月内达到相对稳定[15]。一项Ⅲ期临床试验对亮丙瑞林3M剂型(11.25 mg和30.00 mg)治疗CPP进行了药代动力学研究[16],在第1次亮丙瑞林给药后,平均血药浓度在11.25 mg和30.00 mg剂量水平下于1 h迅速增加至19.10 μg/L和52.50 μg/L,给药2周后,平均血药浓度分别降至0.082 μg/L和0.251 μg/L。从第4周到第12周血药浓度保持恒定,表明亮丙瑞林的释放恒定并达到稳态。第2次注射后2个剂量组的平均亮丙瑞林浓度与第1次注射后的浓度相似,表明重复给药后亮丙瑞林无积聚。4~12周的亮丙瑞林浓度与11.25 mg和30.00 mg剂量成正比,Logistic回归模型显示,较高的亮丙瑞林浓度与更充分的促黄体生成素(LH)抑制可能相关。
作者对PubMed、Cochrane图书馆和ClinicalTrials.gov进行了相关文献的检索,筛选1995年1月1日至2021年7月31日发表的亮丙瑞林3M剂型治疗CPP的文献。经检索并筛选,共有9篇临床研究[17,18,19,20,21,22,23,24,25]和1篇病例报告[26]符合要求。其中,4项前瞻性研究[17,18,19,20]和1项回顾性研究[21]探讨了3M剂型治疗CPP(包括初诊患儿和经治患儿)的疗效,一项回顾性研究分析了亮丙瑞林1M和3M剂型的转换[22],3项研究比较了1M剂型和3M剂型的有效性[23,24,25]。
3篇应用3M剂型治疗CPP的研究均以LH为主要疗效评估终点,且均预先设定了LH激发峰值的阈值以评估治疗有效性,但不同研究设定的峰值存在差异[17,18,19]。
Carel等[17]研究中共纳入44例患儿(女40例,男4例),患儿均接受11.25 mg/3M剂型治疗6个月,在第3和6个月时做激发试验,GnRH激发试验后LH峰值<3 IU/L为性腺轴充分抑制的阈值[27],研究结果显示,44例患儿中,42例(95%)完成了试验(1例在3个月失访、1例退出研究)。第3个月时,患儿GnRH激发后LH峰值浓度均显著下降且在第6个月时仍保持在较低水平(P<0.000 1)。有3例患儿在第3个月时,LH峰值>3 IU/L,分别为3.1、3.3、3.9 IU/L,前2例患儿在第6个月时LH峰值<3 IU/L,第3例第6个月时LH峰值为4.9 IU/L,因此,在总共完成的85次GnRH激发试验中,95%(81/85)的LH峰值<3 IU/L。
Lee等[18,19]的研究是一项Ⅲ期、随机、多中心的研究,包括筛选期(最长4周)、6个月的治疗期和治疗后随访期(12周)或选择进入扩展研究。该研究一共纳入来自22个中心的84例CPP初诊患儿和经治患儿,GnRHa激发试验的纳入标准为初诊患儿LH峰值≥8 IU/L,经治患儿LH峰值<4 IU/L,如果患儿第2个月或其后任何时间LH峰值≥4 IU/L将终止试验,主要疗效终点是在治疗后的第2、3、6个月GnRHa激发试验LH峰值<4 IU/L的受试者的百分比。研究结果显示[18],第2-6个月,11.25 mg和30.00 mg剂量组中分别有78.4%和95.2%的患儿达到了性腺轴抑制。11.25 mg组中有80.7%的经治患儿、76.2%的初诊患儿达到抑制水平,30.00 mg组中经治患儿和初诊患儿达到抑制水平比例分别为100.0%和90.5%。依据研究规定治疗满6个月,且在第2个月或之后任意时间LH激发峰值均<4 IU/L的患者参与下一阶段的扩展研究[19],构成为期36个月的临床研究。共有72例患儿进入扩展研究,其中11.25 mg剂量组34例,30.00 mg剂量组38例。结果显示,24例患儿完成了为期36个月的研究,48例患儿在研究期间停止了治疗(多数因患儿已做好进入青春期准备而停止治疗),11.25 mg和30.00 mg剂量组分别有29例、36例患儿在拓展研究的第1天(导入期研究的第6个月)以及所有用药时间点的LH激发峰值<4 IU/L。研究周期内共有7例患儿(11.25 mg组5例,30.00 mg组2例)的LH激发值至少有1次高于4 IU/L的阈值水平,但患儿并未显示青春期发育的相关征象。
随后,Lee等[18,19]又在36个月的拓展研究基础上进行了事后分析研究,即亮丙瑞林1M与3M的转换研究[22]。研究仅分析既往接受亮丙瑞林1M剂型(7.50、11.25或15.00 mg每月)治疗的CPP患儿42例,并随机转换为接受亮丙瑞林11.25 mg或30.00 mg,每3个月注射1次。性腺轴充分抑制的主要指标为激发试验后LH峰值水平<4 IU/L,次要指标为基础LH值(<0.6 IU/L)。研究结果显示,转换为亮丙瑞林11.25 mg/3M剂型组的有81%的患儿LH激发峰值继续保持抑制水平(<4 IU/L),4例患儿脱离抑制,其LH峰值范围为4.1~6.4 IU/L。基础LH水平变化模式与LH峰值类似,但11.25 mg /3M剂量组比30.00 mg/3M剂量组有较多的患儿出现基础LH水平>0.6 IU/L(21例比17例)。平均FSH水平变化与平均LH水平相似,两治疗组患儿基础FSH值均维持在<1.9 IU/L的水平且FSH峰值<6.2 IU/L。总之,研究提示亮丙瑞林从1M剂型转换为3M剂型的大多数患者的性腺轴功能将保持抑制状态,并不受既往治疗的影响。
4篇研究以雌二醇(女童)、睾酮(男童)为疗效评估的次要终点,均显示亮丙瑞林3M剂型可显著降低女童雌二醇水平以及男童睾酮水平[17,18,19,22]。Carel等[17]研究显示,治疗前有55%的女童雌二醇水平<73 pmol/L的阈值,自首次注射后1个月的检测中所有女童(100%)雌二醇水平均<73 pmol/L,并在整个研究期间维持在阈值以下。Lee等[18]在6个月的导入期研究结果显示,100%的30 mg组以及93%的11.25 mg组患儿雌二醇或睾酮得到充分抑制。在随后36个月的拓展研究中[19],无论是11.25 mg组还是30.00 mg组CPP男童的睾酮水平均维持在38~212 ng/L,低于预设的阈值(300 ng/L),但拓展研究中由于雌二醇检测方法的更换使得此指标无评估意义。
3项研究评估了患者生长速率(GV),与治疗前相比,应用亮丙瑞林11.25 mg/3M剂型可显著降低患儿生长速率[17,18,19]。Carel等[17]研究显示,经过6个月、2次皮下注射治疗后,患儿平均生长速率由治疗前评估的(8.3±1.7) cm/年显著降低为(6.6±2.0)cm/年(P<0.001)。Lee等[19]为期36个月的拓展研究显示,11.25 mg组和30.00 mg组患儿在治疗前1年的生长速率分别为(7.20±3.96) cm/年和(7.53±2.81) cm/年,治疗6个月后生长速率分别降低了(1.67±3.90) cm/年和(1.65±3.43) cm/年,在36个月的研究期间,生长速率平均降低了1.66~2.64 cm/年和1.59~2.64 cm/年。
亮丙瑞林3M剂型治疗后能有效抑制BA进展,降低BA与CA比值,实现CA对BA的追赶[19,20,21]。在Lee等[19]发表的为期36个月的拓展研究中,11.25 mg组和30.00 mg组患儿就诊时基线BA分别为(11.19±1.58)岁和(11.06±1.75)岁,基线CA分别为(8.50±1.70)岁和(8.45±1.50)岁,BA/CA分别为1.37±0.28和1.32±0.13,治疗6个月后BA/CA分别下降至1.32±0.22和1.30±0.11,第36个月时BA/CA进一步下降至1.22±0.13和1.10±0.09。2021年Ramos等[21]的研究亦显示22例CPP患儿治疗前的BA与CA差值为2.1±0.9,治疗后[中位治疗时间(2.8±0.8)年]该差值变为1.0±0.6。
2项研究对身高相关的人体测量学指标进行分析,显示经亮丙瑞林11.25 mg/3M剂型治疗后可显著提高CPP患儿预测成人身高(PAH)、能达到改善患儿成年终身高(AH)的目的[20,21]。其中,Ramos等[21]发表的研究显示22例患儿治疗开始及结束后的平均PAH分别为(153.2±8.6) cm和(164.4±7.3 ) cm,差异有统计学意义(P<0.05);治疗结束至达到AH时,患儿平均身高增长量为(10.9±3.4) cm,平均AH为(163.2±6.2) cm。所有患儿的AH均在遗传靶身高范围内。
4项研究评估了治疗前后乳腺发育、子宫大小及阴毛生长等性腺发育情况[17,18,19,21],均显示经亮丙瑞林11.25 mg/3M剂型治疗后可有效抑制CPP女童乳房发育进展,使得乳房发育消退或维持稳定,子宫长度显著降低(P=0.000 4)[17],患儿阴毛生长得到抑制[19,21]。Lee等[18,19]为期36个月的拓展研究中,CPP女童在前6个月内,连续接受2次11.25 mg的亮丙瑞林注射后,90%(28/31)的患儿乳房发育消退或维持稳定,在随后的研究中大部分患儿仍维持乳房发育抑制状态。Ramos等[21]2021年最新发表的回顾性研究,纳入了22例CPP女童,均接受亮丙瑞林11.25 mg/3M剂型治疗,全部患儿治疗前乳房Tanner分期为2~4期,在平均治疗约2.8年后,乳房Tanner分期变为1~4期;研究期间阴毛Tanner分期维持不变(治疗前后均为1~4期),提示治疗期间阴毛生长亦得到抑制。
3篇研究对比、分析了11.25 mg 3M剂型与1M剂型治疗CPP的疗效[23,24,25]。其中,Badaru等[23]的研究纳入共30例CPP患儿(女童24例,男童6例),患儿均先接受7.5 mg/月的亮丙瑞林治疗至少24周,随后检测经亮丙瑞林激发的LH峰值水平。若LH激发峰值≤2 IU/L,则患儿在第24周改为3.75 mg/月的亮丙瑞林治疗,若第36周后患儿LH峰值低于4.5 IU/L,则在第40周患儿接受11.25 mg/3M的亮丙瑞林继续治疗12周,治疗过程见图1。研究主要从激素水平的变化进行分析,结果显示使用3.75 mg/1M和11.25 mg/3M亮丙瑞林治疗期间,平均LH峰值水平差异无统计学意义(1.73±0.99比2.13±1.41,P=0.08)。此外,患儿的FSH水平差异亦无统计学意义(3.91±1.98比3.96±1.34,P=0.82),但两激素水平均显著高于7.50 mg/1M组。不同剂量亮丙瑞林治疗期间患儿平均性激素(雌二醇、睾酮)水平未发现差异。各剂量是否会导致长期治疗差异仍有待进一步研究确定。
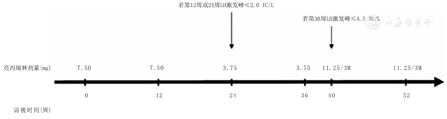

注:LH:促黄体生成素 LH:luteinizing hormone
其余2项研究均对患儿进行随机分组,并从激素水平与临床指标评估不同剂型亮丙瑞林的临床有效性[24,25]。结果显示,11.25 mg/3M剂型虽能显著降低患儿LH、FSH以及雌二醇水平,但是相较于7.5 mg/1M和22.5 mg/3M亮丙瑞林剂量组,11.25 mg/3M剂型组患儿在治疗期间对LH水平抑制作用起效较晚,且可能存在抑制不充分的风险。如,Mericq等[24]研究显示第6个月时,7.5 mg/M,11.25 mg/3M,22.5 mg/3M分别有80%、75%和100%的患儿LH峰值低于2 IU/L,在治疗第12个月时,患儿LH峰值水平均在2 IU/L以下。Fuld等[25]为期2年的研究显示,11.25 mg/3M剂量组平均LH和FSH水平较其他组(7.5 mg/M,22.5 mg/3M)更高,且观察到更多患儿LH水平高于4 IU/L。此外,在第2年将7.50 mg/1M剂量组转换为11.25 mg/3M剂型后,平均FSH出现意外的升高。虽然不同剂量组的LH和FSH水平变化存在差异,但各组的GV、BA进展无差异。此外,虽然11.25 mg/3M剂量组平均LH水平略高,但研究中并未显示出经此剂型治疗失败的患儿比其他2剂型更多的现象。因此,相较于7.5 mg/M或22.5 mg/3M等更高剂量的亮丙瑞林治疗剂量,11.25 mg/3M剂型治疗中出现的LH平均水平轻微升高是否有临床意义以及哪些患儿更易出现激素水平升高仍值得进一步探讨。
6篇进行了安全性分析[17,18,19,20,21,25]。总体来说,亮丙瑞林3M剂型安全性良好,未发生与治疗相关的严重不良反应,亦未发现新的安全性事件。常见的一般不良反应为头痛(15.3%~36.0%)、潮红(7.0%)以及腹痛、恶心、呕吐等胃肠反应(11.1%),以上不良反应在不同研究中存在差异[17,18,19]。除上述一般不良反应外,临床上较为关注的可能与GnRHa类药物治疗相关的不良反应也有报道,如注射部位反应、阴道出血、对体重及生殖的影响。
注射部位反应多为轻、中度,发生率为14.0%~29.4%,主要包括注射部位疼痛、注射部位肿胀及注射部位出现红疹,其中注射部位疼痛最为常见。Carel等[17]研究发现,44例患者在注射第1针亮丙瑞林3M剂型后有6例(14%)发生注射部位反应,其中注射部位疼痛3例、肿胀2例、注射部位出现红斑1例。在Lee等[18]于2012年发表的多中心、Ⅲ期临床试验的导入期(治疗6个月)研究结果显示,总体CPP患儿注射部位疼痛发生率为22.6%,其中11.25 mg/3M剂型组发生率为19.0%(8/42),30 mg/3M剂型组发生率为26.2%(11/42);在随后的拓展研究(为期36个月)中,注射部位疼痛是唯一确定的与治疗相关的不良反应,11.25 mg/3M剂型组发生率为23.7%(9/38),30 mg/3M剂型组发生率为29.4%(10/34)[19]。
一项研究报道了2例(2/44)CPP女童在接受亮丙瑞林11.25 mg/3M剂型注射后发生少量的激素撤退性阴道出血。在为期6个月、2次亮丙瑞林注射中,1例患儿在2次注射后均出现阴道出血,另1例患儿仅在第1次注射后出现,2例患儿均未因此停止治疗[17]。
4项研究分析了亮丙瑞林3M剂型治疗后对体重或BMI的影响,由于研究队列的异质性以及存在遗传、环境、营养和生活方式等众多对体重的影响因素,各研究结果存在争议[19,20,21,25]。Lee等[19]2014年发表的亮丙瑞林多中心、Ⅲ期临床试验的拓展研究中,11.25 mg/3M组患儿基础平均BMI SDS为1.02,30.00 mg/3M组为1.18。在为期3年的研究期间,2组患儿BMI SDS均呈现≤0.1的较小改变。Vatopoulou等[20]的研究中,24例患儿在中位3.1年的随访期间,BMI均有所增加但未达到肥胖标准,而Ramos等[21]研究中虽然研究期间患儿的平均BMI增加,但是从诊断至患儿达到AH的肥胖/超重比例在数值上呈下降趋势(39%比19%,P>0.05)。此外,基于体重的分析显示,应用较高剂量3M剂型亮丙瑞林(22.50 mg/3M)的患儿比应用11.25 mg/3M剂型的患儿体重增加更明显[25]。
2项研究分析了亮丙瑞林3M剂型治疗后对女童月经周期的影响,大部分患儿治疗结束后性腺功能恢复,随后月经初潮,排卵周期正常[20,21]。研究显示患儿治疗结束后16个月左右经历月经初潮,平均初潮年龄12岁[20,21]。但在Ramos等[21]的研究中4例患儿报告了月经周期异常;在GnRHa治疗3~5年后,患儿达到AH时,有2例患儿在CA 14~16岁时,观察到高雄激素血症;根据最近的国际联盟更新的青少年多囊卵巢综合征(PCOS)诊断标准[28],1例(4.8%)患儿诊断为PCOS。
仅一项研究探讨了应用亮丙瑞林3M剂型治疗CPP对患儿代谢相关指标的影响,Ramos等[21]的研究中,在达到AH时,3例(3/17,17.6%)儿童出现胰岛素抵抗,2例(2/21,9.5%)出现低密度脂蛋白(LDL)水平升高;所有患儿未发现高甘油三酯血症、糖尿病及动脉高血压。
总之,现有研究数据显示醋酸亮丙瑞林3M缓释剂型可有效抑制垂体-性腺轴功能,延缓CPP患儿BA成熟进程及青春期进展。安全性分析显示其总体耐受性良好,未出现新的安全性信号,但注射部位反应,尤其是注射部位疼痛较突出。CPP治疗一般需要持续2~3年,注射用醋酸亮丙瑞林3M剂型将为需要长期治疗的CPP患儿提供更为简便的治疗选择,可减少患儿注射次数,降低医患双方医疗负担,有助于推进CPP的长期规范化治疗。但基于现有研究数据较少且在安全性上未设置不同剂型的比较,亮丙瑞林3M剂型仍存在一些疑问,如3M剂型治疗哪些患儿可能存在激素抑制不充分,这些激素抑制不充分是否有临床意义以及是否需要增加剂量等,要解决这些疑问仍需进一步的研究。此外,与GnRHa类药物每月剂型应用类似,临床上较关注的诸如治疗对CPP患儿生殖功能、骨密度、BMI、心理、情绪上的远期影响也是3M剂型未来值得继续探讨的内容。相信随着醋酸亮丙瑞林3M剂型的上市,临床应用数据的增多,现阶段存在的疑问将会得到更充分的研究。
总之,注射用醋酸亮丙瑞林3M微球缓释剂型对于儿童CPP治疗安全、有效,并可大大降低患儿注射次数,减少患儿及家属来院次数,并在一定程度上降低治疗负担,3M剂型将为安全、有效的CPP持续治疗提供新的探索方向。
所有作者均声明不存在利益冲突



























