
探讨经鼻内镜视神经管减压对儿童外伤性视神经病变的疗效及其影响因素。
回顾性分析2010年11月至2021年10月北京同仁医院神经外科收治的行经鼻内镜视神经减压术的47例视神经损伤儿童患者临床资料,比较治疗前后视力情况。并将临床因素作为自变量,以治疗后视力有无好转为因变量纳入多因素Cox回归模型进行分析,观察可能影响疗效的因素。
47例患者,男35例,女12例,年龄3.0~12.0(7.2±2.3)岁。经手术以及激素治疗后,28例(59.6%)患者视力较治疗前明显好转。伤后残存视力者术后视力好转率高于伤后无视力者[85.0%(17/20)比40.7%(11/27),P=0.002],视神经管移位骨折者术后视力好转率低于无移位骨折者[42.1%(8/19)比71.4%(20/28),P=0.044],手术时间间隔≤7 d者视力好转率高于>7 d者[80.8%(21/26)比33.3%(7/21),P=0.001]。伤后残存视力(HR=3.805,95%CI:1.087~13.318,P=0.037)和手术时间间隔≤7 d(HR=2.883,95%CI:1.084~7.662, P=0.034)是术后视力的保护因素。
经鼻内镜视神经管减压术能够有效提高儿童外伤性视神经病变的视力,伤后残存视力和手术时间间隔≤7d是儿童外伤性视神经病变经鼻内镜视神经管减压术后视力预后的保护因素。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
外伤性视神经病变(traumatic optic neuropathy,TON)通常是指颅面部的创伤传导至视神经管,引起视神经管变形或骨折,间接造成视神经损伤而引起的视力、视野障碍。TON在颅面部创伤中的发生率为0.5%~5.0%,主要发生在视神经管内段和视神经颅内段,多见于额部或额颞部的损伤,特别是眶外侧缘的直接暴力[1, 2]。TON是引起儿童外伤性视力丧失最常见的原因,尽管经鼻内镜视神经管减压(endoscopic optic nerve decompression,EOND)和(或)激素冲击治疗是目前治疗TON重要的措施,但是由于其发生机制和损伤程度评估等的复杂性和不确定性,目前对于儿童TON的预后缺乏有效的判断指标。本研究通过对北京同仁医院神经外科收治的47例视神经损伤患儿进行回顾性分析,并通过统计学分析筛选出临床中可能影响儿童TON疗效的因素,以期为临床医师在诊治TON过程中提供依据。
选取2016年11月至2020年10月北京同仁医院神经外科收治的47例视神经损伤儿童患者。本研究符合《赫尔辛基宣言》对伦理的要求,患者知情同意豁免。
1. 纳入标准:(1)年龄≤12岁;(2)明确诊断为视神经损伤;(3)失明患者受伤时间<2周;残存视力患者受伤时间<1个月;(4)患者在首都医科大学附属北京同仁医院神经外科进行手术和(或)激素冲击治疗,且资料完整。
2. 排除标准:(1)诊断为双侧视神经损伤患者;(2)伴有严重的颅脑损伤或者有意识障碍患者;(3)伴有眼球、眼底等损伤;(4)在外院已进行视神经减压手术治疗患者。
3. 受伤原因:车祸伤为41例(87.2%),打击伤4例(8.5%),坠落伤2例(4.3%)。
4. 影像学资料:患者均行视神经管薄层(1 mm)CT扫描明确视神经管骨折情况。其中视神经管无骨折10例(21.3%),线样骨折18例(38.2%),移位骨折19例(40.4%),伴有蝶窦积血31例(66.0%),蝶骨大翼骨折9例(19.1%)。同时行副鼻窦CT检查,明确蝶窦气化和副鼻窦情况,其中蝶窦正常气化29例(61.7%),不全气化18例(38.3%)。
1. 治疗方法:(1)视神经管减压术方法如下:按Messerblinger术式,0°鼻内镜下切除钩突,打开筛泡和中鼻甲基板,切除后组筛窦,开放同侧蝶窦,确认蝶窦内视神经、颈内动脉管等解剖结构,沿纸样板向后暴露并确认眶尖,磨钻磨薄眶尖、视神经管内下壁骨质后,显微剥离子剥除骨片,向内达到视神经管颅口处,必要时磨除视神经管上壁,视神经鞘膜根据情况是否切开,切开应在尽量偏离眼动脉,避免增加对视神经的损伤。对于蝶窦气化不良患者,可使用神经导航进行术中定位(典型病例见图1)。(2)激素治疗:激素冲击治疗使用甲泼尼龙30 mg/kg,首剂最大500 mg,静脉滴注,3 d后改为口服泼尼松,逐渐减量至14 d停药。同时给予神经营养和改善微循环等药物治疗。
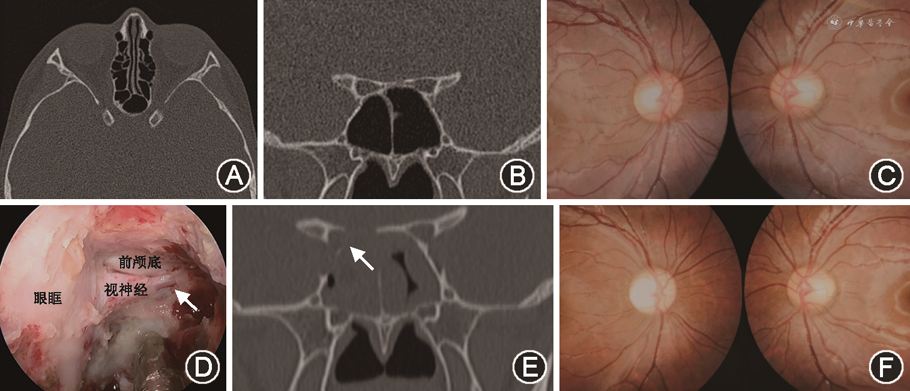

2. 视力好转判定:术后1周、1个月、3个月进行随访检查。将治疗后3个月的视力情况与治疗前视力进行比较,判定疗效。视力分为无光感、光感、眼前手动、眼前数指和视力≥0.1共5个级别。治疗后视力提高1个级别为好转,视力无提高或下降者为无好转。
应用SPSS 24.0软件进行统计学分析。计数资料以%(例)表示,采用χ²检验。将临床因素作为自变量,以疗效作为因变量纳入多因素Cox回归模型进行分析,双侧检验,检验水准α=0.05。
47例患者中,男35例,女12例。男∶女=2.92∶1,年龄3.0~12.0(7.2±2.3)岁。右侧受伤25例,左侧受伤22例。所有患者均接受EOND术,其中30例(63.8%)同时接受激素治疗。经手术以及激素治疗后,28例(59.6%)患者视力较治疗前明显好转,治疗前后视力情况见表1。
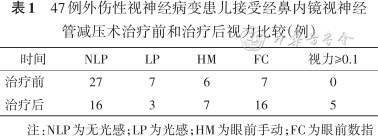
47例外伤性视神经病变患儿接受经鼻内镜视神经管减压术治疗前和治疗后视力比较(例)
47例外伤性视神经病变患儿接受经鼻内镜视神经管减压术治疗前和治疗后视力比较(例)
| 时间 | NLP | LP | HM | FC | 视力≥0.1 |
|---|---|---|---|---|---|
| 治疗前 | 27 | 7 | 6 | 7 | 0 |
| 治疗后 | 16 | 3 | 7 | 16 | 5 |
注:NLP为无光感;LP为光感;HM为眼前手动;FC为眼前数指
伤后残存视力者术后视力好转率高于伤后无视力者(P=0.002),视神经管移位骨折者术后视力好转率低于无骨折者(P=0.044),手术时间间隔≤7 d者视力好转率高于>7 d者(P=0.001)。伤后有无意识障碍者、有无伴有蝶窦积血、有无进行激素治疗者之间视力好转率比较,差异均无统计学意义(均P>0.05)(表2)。
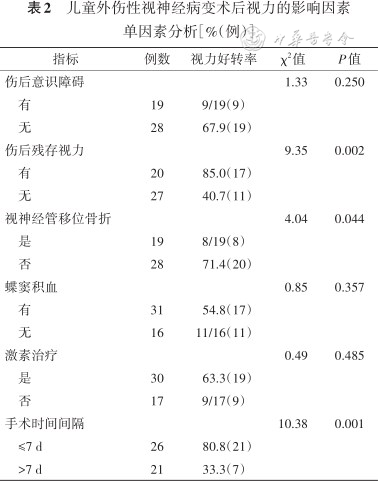
儿童外伤性视神经病变术后视力的影响因素单因素分析[%(例)]
儿童外伤性视神经病变术后视力的影响因素单因素分析[%(例)]
| 指标 | 例数 | 视力好转率 | χ2值 | P值 |
|---|---|---|---|---|
| 伤后意识障碍 | 1.33 | 0.250 | ||
| 有 | 19 | 9/19(9) | ||
| 无 | 28 | 67.9(19) | ||
| 伤后残存视力 | 9.35 | 0.002 | ||
| 有 | 20 | 85.0(17) | ||
| 无 | 27 | 40.7(11) | ||
| 视神经管移位骨折 | 4.04 | 0.044 | ||
| 是 | 19 | 8/19(8) | ||
| 否 | 28 | 71.4(20) | ||
| 蝶窦积血 | 0.85 | 0.357 | ||
| 有 | 31 | 54.8(17) | ||
| 无 | 16 | 11/16(11) | ||
| 激素治疗 | 0.49 | 0.485 | ||
| 是 | 30 | 63.3(19) | ||
| 否 | 17 | 9/17(9) | ||
| 手术时间间隔 | 10.38 | 0.001 | ||
| ≤7 d | 26 | 80.8(21) | ||
| >7 d | 21 | 33.3(7) |
将伤后残存视力、手术时间间隔≤7 d、伤后意识障碍、视神经管移位骨折、激素治疗纳入多因素Cox回归模型。伤后残存视力(P=0.037)和手术时间间隔≤7 d(P=0.034)是影响儿童TON视力预后的相关因素(表3)。伤后残存视力患者治疗后好转的可能性是失明患者的3.805倍(HR=3.805,95%CI:1.087~13.318);手术时间间隔≤7 d患者治疗后好转的可能性是手术时间间隔>7 d患者的2.883倍(HR=2.883,95%CI:1.084~7.662)。
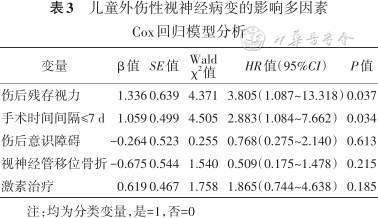
儿童外伤性视神经病变的影响多因素Cox回归模型分析
儿童外伤性视神经病变的影响多因素Cox回归模型分析
| 变量 | β值 | SE值 | Wald χ2值 | HR值(95%CI) | P值 |
|---|---|---|---|---|---|
| 伤后残存视力 | 1.336 | 0.639 | 4.371 | 3.805(1.087~13.318) | 0.037 |
| 手术时间间隔≤7 d | 1.059 | 0.499 | 4.505 | 2.883(1.084~7.662) | 0.034 |
| 伤后意识障碍 | -0.264 | 0.523 | 0.255 | 0.768(0.275~2.140) | 0.613 |
| 视神经管移位骨折 | -0.675 | 0.544 | 1.540 | 0.509(0.175~1.478) | 0.215 |
| 激素治疗 | 0.619 | 0.467 | 1.758 | 1.865(0.744~4.638) | 0.185 |
注:均为分类变量,是=1,否=0
视神经作为中枢神经,周围缺乏施万细胞的支持,因此,一旦损伤,其自我修复和再生能力差。TON损伤的机制一般认为是颅面创伤的外力传导至视神经后,通过原发和(或)继发性的复杂病理生理过程,导致视网膜节细胞(retinal ganglion cells,RGCs)凋亡[3]。TON造成RGCs的凋亡在伤后3~5 d细胞凋亡明显增加,30 d后趋于稳定[4, 5]。因此,早期有效地减少和缓解RGCs继发性凋亡对于TON的治疗和预后至关重要。RGCs损伤的细胞数量与继发的神经损伤级联反应有关,也决定了其修复能力,影响TON疗效。根据目前的研究报道,伤后残存视力是影响TON治疗疗效的关键因素之一[6, 7]。本研究中,在伤后有残存视力的20例患儿中,其中17例(85%)在治疗后视力有显著改善,与其他的研究结果基本相似。因此,伤后残存视力是影响儿童TON治疗疗效的重要因素。
糖皮质激素能够改善伤后视神经微循环、缓解损伤后炎性反应,因此是治疗TON非常重要的措施。有研究发现,约50%的TON患者在经过激素治疗后视力有明显改善[8]。尽管糖皮质激素对TON治疗的有效性缺乏前瞻性对照研究,但及时糖皮质激素治疗(甲泼尼龙500~1 000 mg/d)已经成为多数医师治疗TON的首选[9]。EOND由于其微创、有效等优点,目前已经成为治疗TON首选的手术方法。有研究结果显示,经鼻内镜视神经减压手术联合糖皮质激素治疗,无论对于TON无光感好或者有残存视力患者,其治疗后视力提高率均高于单处激素治疗[10, 11]。尽管在本研究中,手术前应用激素治疗对于TON术后视力提高率没有显著性影响,但糖皮质激素联合EOND,在治疗后视力较前有明显提高。
来自颅面部的冲击力可经颅骨传导至视神经管各壁从而造成骨折,导致视神经的直接、间接和继发性损伤[12]。视神经管骨折是诊断和判断TON损伤程度的重要因素。对于儿童来讲,颅骨及视神经管处于发育期,外力可导致视神经管骨质的变形进而导致视神经一过性的挤压而不形成骨折,或者形成线样骨折,在CT上容易漏诊。手术前CT没有发现视神经管骨折患者中,约20%术中发现有线样骨折。同时,视神经管周围蝶窦或者筛窦内积血也是判断视神经骨折的间接征象[13]。尽管目前有依据CT颅面部骨折和视神经管骨折情况建立各种评分系统用于评估视神经损伤情况以及预后,但均为小样本的回顾性研究,其有效性待于进一步的研究和验证[14, 15]。单因素结果显示,视神经管移位骨折是影响TON视力危险因素,可能与视神经损伤的生物力学机制有关。
EOND已经成为目前治疗TON的重要外科手段。但是,关于手术时机的选择,仍存在争论。动物研究结果显示,TON后3 d会出现视神经脱髓鞘、炎性反应和视神经水肿等病理性改变[16]。目前研究认为,伤后7 d,特别是伤后3 d内进行手术干预是影响预后的重要因素[17, 18]。本研究由于客观原因,很少患者在3 d内完成手术,主要是在7~10 d内完成。因而,伤后手术时间是术后视力恢复重要的决定因素之一,TON明确诊断后及早行EOND和激素治疗对于儿童TON视力恢复具有重要的作用。
综上所述,TON是导致儿童外伤性视力丧失最重要的因素。尽管TON的治疗已取得了一定的进展,但治疗的结局仍不十分满意。本研究结果提示,伤后是否有残存视力和损伤至手术的时间间隔是决定患儿预后最重要的因素。因此,对于儿童TON的治疗,早期行EOND和激素治疗,以及术后规范化的康复治疗,是促进视力恢复重要的治疗措施。
所有作者均声明不存在利益冲突



























