
甲状腺癌是头颈部最常见的恶性肿瘤,其淋巴结转移率较高。淋巴结示踪技术是甲状腺癌外科治疗中的重要辅助技术,为规范其临床应用,相关学会组织头颈外科、甲状腺外科、普外科、肿瘤外科、影像科、超声科及核医学科等专家制定本共识。本共识涵盖甲状腺癌颈淋巴结清扫、淋巴示踪原理和分类、应用技术、副作用及甲状旁腺负显影等内容,形成相对统一的流程与规范,以期使该技术得到推广,使广大甲状腺癌患者获益。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
甲状腺癌是头颈部最常见的恶性肿瘤,也是发病率最高的十大恶性肿瘤之一。近20年来,我国甲状腺癌发病率增长迅速,2003至2012年间平均每年增长约20%,甲状腺发病位列所有恶性肿瘤第7位,位列女性肿瘤第4位[1]。甲状腺癌患者出现淋巴结转移的比例较高,即使原发灶很小时也可出现淋巴结转移。目前,甲状腺癌外科治疗中的淋巴结清扫仍存在一些问题,例如颈部区域淋巴结术中识别及中央区淋巴结清扫时甲状旁腺和神经的保护等问题。淋巴结示踪技术有助于术中淋巴结的识别和甲状旁腺的保护,是甲状腺癌外科治疗中的重要辅助技术,在各级医院中广泛应用。但是,在使用过程中仍然存在适应证不明确、示踪剂应用保存不恰当及操作不规范等现象。为规范淋巴结示踪技术在甲状腺癌治疗中的应用,特制定《甲状腺癌手术中淋巴结示踪技术规范应用专家共识》(以下简称“共识”)。
共识形成过程:由中国医疗保健国际交流促进会甲状腺疾病防治分会、中华预防医学会甲状腺疾病防治专业委员会及中国人体健康科技促进会甲状腺肿瘤专业委员会组织头颈外科、甲状腺外科、普外科、肿瘤外科、影像科、超声科、内分泌科及核医学科等专家参加,形成委员会,并组织专家执笔完成初稿,后发各位委员征求意见,召开集中讨论会议,并参考美国预防医学工作组的推荐评价标准(表1),形成本共识。

共识推荐分级标准
共识推荐分级标准
| 推荐分级 | 推荐强度定义 |
|---|---|
| A | 强力推荐。循证医学证据肯定,患者可以受益,利大于弊 |
| B | 推荐。循证医学证据良好,患者可以受益,利大于弊 |
| C | 推荐。基于专家意见 |
| D | 反对推荐。基于专家意见 |
| E | 反对推荐。循证医学证据良好,患者不能受益,弊大于利 |
| F | 强力反对推荐。循证医学证据肯定,患者不能受益,弊大于利 |
| I | 不推荐或者不作为常规推荐。推荐或者反对的循证医学证据不足、缺乏或者结果矛盾,利弊无法评估 |
共识目的及目标人群:共识的目的是让从事与甲状腺外科相关的医师、麻醉医师和护士等明确职责,了解淋巴示踪的技术标准和治疗流程,从而使广大甲状腺癌患者获益。
文献查阅:通过中国知网及Medline数据库,以甲状腺癌(thyroid neoplasm)、淋巴结(lymph nodes)、示踪剂(tracers)、淋巴清扫(lymph adenectomy)为关键词检索截至2022年10月发表的论文。
有30%~80%的甲状腺乳头状癌(papillary thyroid carcinoma,PTC)患者在确诊时即存在颈部淋巴结转移,以颈部Ⅵ区(中央区)最为常见[2]。有50%~75%的甲状腺髓样癌(medullary thyroid carcinoma,MTC)患者会发生中央区淋巴结转移[3],中央区淋巴结转移≥4枚时,同侧颈侧淋巴结转移率可高达98%[4]。甲状腺癌淋巴结转移具有原发灶同侧、沿淋巴引流路径逐站转移、中央区最常见、可多区转移、“跳跃性”转移少见等特点。相对少见的淋巴结转移区域包括咽旁和纵隔。
PTC和甲状腺滤泡状癌合称分化型甲状腺癌(differentiated thyroid cancer,DTC),患者总体预后良好。其中无淋巴结转移者(pN0)10年总体生存率为80%~85%,有淋巴结转移者(pN1)10年总体生存率为75%~80%。对于<55岁的患者,pN0与pN1两组10年总生存率差距仅1%~2%,而>55岁的患者中两组差距为5%~10%[5]。淋巴结转移对于中青年患者的预后无明显影响,但对于老年患者预后有影响。对于出现颈部淋巴结复发的DTC患者,经规范治疗后,预后仍然良好[6]。若首次治疗不规范,复发率高,复发再治疗者并发症发生率高,对患者生存质量影响较大,反复复发者生存率明显下降。
MTC患者中,淋巴结转移是预后的独立危险因素。pN0患者5年总生存率约90%,而pN1患者5年总生存率约70%[7]。淋巴结的R0切除是术后解剖和(或)生化治愈的关键因素之一[8]。
颈部淋巴结清扫在解剖位置上分为中央区和颈侧区淋巴结清扫,从治疗目的上分为治疗性与预防性清扫。治疗性清扫是指术前或术中确定为转移淋巴结(cN1)的淋巴结清扫,而预防性清扫则是临床分期为cN0的颈部淋巴结清扫[9]。
中央区淋巴结清扫的绝对适应证包括初治患者考虑为cN1,或者中央区清扫术后复发;相对适应证包括临床考虑cN0并拟行预防性淋巴结清扫。颈侧区淋巴结清扫的绝对适应证是cN1b;对于cN0患者并不建议行预防性颈侧区淋巴结清扫[10]。
颈部淋巴结清扫的禁忌证包括:(1)原发灶无法治疗时;(2)身体状况不适合手术者;(3)未分化或低分化癌有远处转移者;(4)颈部病变不可切除,如颈动脉受累,椎前筋膜和肌肉以及臂丛神经受累,并延伸到颅底并入颅[11]。
中央区淋巴结清扫的范围主要为Ⅵ区,必要时包含Ⅶ区。中央区淋巴结可以根据解剖位置再进一步细分,包括喉前、气管旁和气管前淋巴结,右侧还包括喉返神经后方淋巴结,甲状腺癌淋巴结转移还可能延伸至咽后、食管后或咽喉旁淋巴结[12]。
甲状腺癌淋巴结以多区域转移为主,颈侧区Ⅱ、Ⅲ、Ⅳ区是甲状腺淋巴引流的主要区域,Ⅴ区淋巴结转移发生率可达20%以上,常见于Ⅴb区[13, 14]。因此,推荐Ⅱ、Ⅲ、Ⅳ、Ⅴb区为规范的颈侧区淋巴结清扫范围[15]。
术前评估:(1)颈部超声是首选、常规的影像学检查方法。怀疑转移时可进行超声引导下细针穿刺,行细胞学检查或者洗脱液的甲状腺球蛋白、降钙素检测。(2)颈部增强CT或磁共振成像也是评估淋巴结的重要手段,可评估颈淋巴结的大小、位置及是否存在淋巴结包膜外侵犯征象等情况,有利于制定手术计划。(3)其他:正电子发射计算机断层扫描(PET-CT)和单光子发射计算机断层扫描(SPET-CT)有时有一定价值,但不建议作为常规检查手段。
淋巴示踪剂的普遍原理是利用组织内毛细淋巴管和毛细血管的内皮间隙差距。毛细淋巴管内皮细胞的间隙为120~500 nm,淋巴示踪剂的颗粒直径一般在100~150 nm,可以直接或被巨噬细胞吞噬后进入毛细淋巴管,进而聚集在区域淋巴结中,通过其理化特性标记淋巴结,但当毛细淋巴管因肿瘤、炎症等原因堵塞,则影响其显影效果。而局部毛细血管的内皮细胞间隙为30~50 nm,淋巴示踪剂颗粒直径过大,无法进入毛细血管,即使少量进入血液循环中也会被巨噬细胞吞噬而清除。
目前,淋巴示踪剂主要包括生物染料类(如亚甲蓝、异硫蓝及示踪用盐酸米托蒽醌注射液等)、碳颗粒类、核素类、荧光染料等。不同淋巴示踪剂的特点见表2。
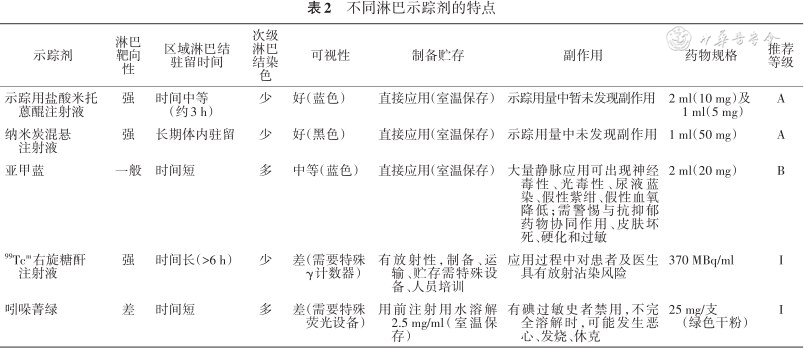
不同淋巴示踪剂的特点
不同淋巴示踪剂的特点
| 示踪剂 | 淋巴靶向性 | 区域淋巴结 驻留时间 | 次级淋巴结染色 | 可视性 | 制备贮存 | 副作用 | 药物规格 | 推荐等级 |
|---|---|---|---|---|---|---|---|---|
示踪用盐酸米托 蒽醌注射液 | 强 | 时间中等 (约3 h) | 少 | 好(蓝色) | 直接应用(室温保存) | 示踪用量中暂未发现副作用 | 2 ml(10 mg)及 1 ml(5 mg) | A |
纳米炭混悬 注射液 | 强 | 长期体内驻留 | 少 | 好(黑色) | 直接应用(室温保存) | 示踪用量中未发现副作用 | 1 ml(50 mg) | A |
| 亚甲蓝 | 一般 | 时间短 | 多 | 中等(蓝色) | 直接应用(室温保存) | 大量静脉应用可出现神经毒性、光毒性、尿液蓝染、假性紫绀、假性血氧降低;需警惕与抗抑郁药物协同作用、皮肤坏死、硬化和过敏 | 2 ml(20 mg) | B |
99Tcm右旋糖酐 注射液 | 强 | 时间长(>6 h) | 少 | 差(需要特殊 γ计数器) | 有放射性,制备、运输、贮存需特殊设备、人员培训 | 应用过程中对患者及医生具有放射沾染风险 | 370 MBq/ml | I |
| 吲哚菁绿 | 差 | 时间短 | 多 | 差(需要特殊 荧光设备) | 用前注射用水溶解2.5 mg/ml(室温保存) | 有碘过敏史者禁用,不完全溶解时,可能发生恶心、发烧、休克 | 25 mg/支 (绿色干粉) | I |
1. 生物染料类:(1)亚甲蓝注射液,又称亚甲基蓝、美蓝、品蓝等[16]。(2)异硫蓝及专利蓝,为活性染料示踪剂[17]。(3)示踪用盐酸米托蒽醌注射液:作为新型染料,其对淋巴系统具有高亲和力,染色效率高,能将淋巴结染成蓝色,显现淋巴示踪效果,且在体内可代谢,不残留[18, 19, 20]。
2. 碳颗粒类:纳米炭混悬注射液(carbon nanoparticles,CNP)是由纳米级的碳颗粒制成的示踪剂,具有淋巴趋向性强、示踪速度快、黑染率高、持续时间长等特点[21, 22, 23, 24]。
3. 放射性核素:放射性标记胶体99Tcm核素成像[25]。
4. 荧光成像剂:吲哚菁绿[26]。
不同类别淋巴示踪剂术中应用均存在一定副作用:(1)术中不慎渗漏,可能导致术野污染[20]。(2)亚甲蓝具有一定的神经毒性、光毒性。用药后药物从尿液排泄导致尿呈蓝绿色,可造成假性紫绀、假性血氧降低。术前大剂量静脉应用亚甲蓝可引起恶心、腹痛、心前区疼痛、变性血红蛋白血症等,也可引起眩晕、头痛、出汗和神志不清等蓝色脑病表现,可以给予大量液体输液并利尿[16]。(3)核素类示踪剂需要特殊试剂和设备,应用过程中对患者及医生具有放射污染[25]。(4)荧光染料类吲哚菁绿,有碘过敏史者禁用,制剂不完全溶解时,可能发生恶心、发热、休克[26]。(5)其他详见药品说明书。
1. 开放手术:(1)首先暴露甲状腺被膜,注意保护甲状腺真被膜的完整性,否则示踪剂可能外溢污染周围组织,影响术野的观察。(2)用1 ml注射器抽取示踪剂在甲状腺腺体内多点注射(一般1~4点),建议进针深度不宜过深,以2~3 mm为宜,每个点位注射0.05~0.2 ml,注意避开血管及肿瘤组织,建议注射前回抽防止药液注入血管内(对于Ⅱ度及以上肿大甲状腺或桥本甲状腺炎患者,推荐多点注射;对于肿瘤较大或者广泛外侵,已无明显正常甲状腺组织者不建议使用示踪剂)。(3)拔针后用纱布轻压针眼或用双极电凝,以免示踪剂外溢。(4)等待5 min后或者清晰地看到淋巴管及淋巴结染色后,即可行甲状腺手术。(5)注射时万一出现渗漏,可以局部以适量生理盐水冲洗。
2. 腔镜手术:(1)可以在手术前超声引导下局部注射。(2)可以在手术中使用,选择长针头经皮肤穿刺进入甲状腺。具体注意事项参照开放手术,拔针后可以用纱条轻压、能量器械局部凝闭或者以吸引器压迫吸引数秒,防止示踪剂外溢造成术区污染。退针时应保持持续回抽注射器形成负压拔针,以免皮肤染色。(3)对于非充气手术,可以用头皮针在抓钳抓持下局部注射,头皮针以软管引出体外连接注射器进行推注,具体操作注意事项同开放类手术。
1. 生物染料及碳颗粒类:按前文淋巴示踪具体应用技术中的使用方法。
2. 核素类:可术前应用,术前1 d在超声引导下注入腺体内,2 h后对颈侧正中区或两侧淋巴闪烁照相,在同位素浓集的皮肤表面做标记术中通过Y探头定位前哨淋巴结。也可以在术前数小时注射,术前Y探头探测甲状腺周围的放射性核素热点作为前哨淋巴结,以高于周围组织10倍为阳性。在热点区皮肤做标记[27, 28]。
甲状旁腺负显影是在手术局部应用染剂,通过染色甲状旁腺周围的甲状腺、淋巴结等组织,甲状旁腺不染色,以反衬甲状旁腺的“负性染色”技术。目前,甲状旁腺负显影多是甲状腺淋巴示踪的伴随结果,而被手术医生应用。主要的染色剂包括:示踪用盐酸米托蒽醌注射液、纳米炭混悬注射液及亚甲蓝等。需注意脂肪、胸腺等组织也不染色,仍需要手术医生进行判断[16,21,23]。
甲状腺癌再次手术是甲状腺手术中难度较大的手术之一,因为既往手术导致正常解剖结构丧失,周围组织粘连和慢性瘢痕形成难以识别甲状旁腺、喉返神经及喉上神经等重要结构。再次手术中甲状腺癌有残余腺体者,可在术前使用淋巴示踪剂在超声引导下腺体内注射,能够对残留的甲状腺组织和中央区淋巴结进行标识,与阴性染色的甲状旁腺形成对比,显著提高甲状旁腺的识别率,减少手术并发症[29]。但是对于仅剩少许残体,局部残余腺体难以注射染色剂或因瘢痕影响无法较好弥散,不推荐使用淋巴示踪剂[16,30]。
甲状腺癌的复发率在5%~40%,其中区域淋巴结复发最为常见[31, 32],手术是其最有效的治疗方式。虽然高频超声和薄层CT可以早期发现<1 cm的复发转移灶,然而由于解剖结构改变、局部纤维化瘢痕形成等因素,再次手术难度大。超声引导下示踪剂定位不仅可以提高复发灶的检出率,还可有效降低并发症发生率并缩短手术时长[33, 34]。
建议由经验丰富的医师操作,使用22 G~25 G针头及1 ml注射器抽取适量示踪剂,在超声引导下经皮将0.1~0.2 ml示踪剂注射入复发灶内,出针前转为负压拔针避免皮肤印记。穿刺期间注意观察患者一般情况,观察是否形成局部血肿,穿刺后局部压迫止血。根据示踪剂特点和病灶情况,优先选择转移灶内注射,其次考虑选择周边注射。建议定位术后尽快行手术,尽可能缩短间隔时间[35]。
颈部淋巴结清扫术是甲状腺癌治疗的重要手段,淋巴结示踪技术可以有效地显示区域淋巴结、负显影甲状旁腺,对提高手术效果、减少并发症均有帮助。希望本共识能在该技术的临床应用过程中,规范技术标准和治疗流程,对临床医生有所帮助,使广大甲状腺癌患者获益。
本共识制定专家委员会名单
执笔者:钟琦(首都医科大学附属北京同仁医院耳鼻咽喉头颈外科);倪松(中国医学科学院肿瘤医院头颈外科);何时知(首都医科大学附属北京同仁医院耳鼻咽喉头颈外科);朱一鸣(中国医学科学院肿瘤医院头颈外科);郭伟(首都医科大学附属北京同仁医院耳鼻咽喉头颈外科);王健(中国医学科学院肿瘤医院头颈外科);时倩(首都医科大学附属北京同仁医院耳鼻咽喉头颈外科);李瀚(中国医学科学院肿瘤医院头颈外科);赵延明(首都医科大学附属北京同仁医院耳鼻咽喉头颈外科);柳云贺、何雨沁、刘绍严(中国医学科学院肿瘤医院头颈外科);房居高(首都医科大学附属北京同仁医院耳鼻咽喉头颈外科)
讨论专家组(按姓氏汉语拼音排序):艾力根·阿不都热依木(新疆维吾尔自治区人民医院耳鼻喉诊疗中心);陈革(中国医学科学院北京协和医院基本外科);陈万军(山东第一医科大学附属肿瘤医院头颈外科);樊友本(上海市第六人民医院普外科);房居高(首都医科大学附属北京同仁医院耳鼻咽喉头颈外科);郭良(浙江省肿瘤医院头颈外科);何宁(广西壮族自治区妇幼保健院耳鼻喉科);嵇庆海(复旦大学附属肿瘤医院头颈外科);景尚华(河北医科大学第四医院耳鼻咽喉头颈外科);雷大鹏(山东大学齐鲁医院耳鼻咽喉头颈外科);黎洪浩(中山大学孙逸仙纪念医院甲状腺外科);李超(四川省肿瘤医院头颈肿瘤外科中心);李德伟(山西省人民医院甲状腺外科);李晓明(白求恩国际和平医院耳鼻咽喉头颈外科);李振东(辽宁省肿瘤医院头颈外科);廖琳(山东第一医科大学附属第一医院内分泌代谢科);林岩松(中国医学科学院北京协和医院核医学科);刘绍严(中国医学科学院肿瘤医院头颈外科);罗定存(杭州市第一人民医院肿瘤外科);罗瑞华(河南省肿瘤医院甲状腺头颈外科);倪松(中国医学科学院肿瘤医院头颈外科);倪鑫(首都医科大学附属北京儿童医院耳鼻咽喉头颈外科);潘新良(山东大学齐鲁医院耳鼻咽喉头颈外科);彭小伟(湖南省肿瘤医院甲状腺外科);秦华东(哈尔滨医科大学附属第二医院普通外科);秦建武(河南省肿瘤医院甲状腺头颈外科);孙冀(哈尔滨医科大学附属肿瘤医院头颈外科);田兴松(山东省立医院乳腺甲状腺外科);王朝晖(四川省肿瘤医院头颈肿瘤外科中心);王生才(首都医科大学附属北京儿童医院耳鼻咽喉头颈外科);王宇(复旦大学附属肿瘤医院头颈外科);吴国洋(厦门大学附属中山医院普通外科);杨安奎(中山大学肿瘤防治中心头颈外科);殷志强(上海市第十人民医院甲状腺疾病研究中心);于振坤(南京明基医院耳鼻咽喉头颈外科);曾庆东(山东大学齐鲁医院甲状腺外科);张波(北京中日友好医院超声科);张少强(西安交通大学第一附属医院耳鼻咽喉头颈外科);张园(江苏省肿瘤医院头颈外科);赵汉学(首都医科大学附属北京同仁医院超声科);赵永福(大连医科大学附属第二医院普外科);郑颖(吉林省肿瘤医院甲状腺头颈外科);钟琦(首都医科大学附属北京同仁医院头颈外科)
所有作者均声明不存在利益冲突


























