
近年来,心脏MR技术在各种缺血及非缺血性心肌病的诊断、评估中起到越来越重要的作用。本文将对心脏MR在急性心肌梗死中的应用模式、扫描序列及影像表现进行基本的介绍,旨在提高影像医师的诊断能力。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
经全国继续医学教育委员会批准,本刊开设继教专栏,每年从第1期至第10期共刊发10篇继教文章,文后附5道单选题,读者阅读后可扫描标签二维码答题,每篇可免费获得Ⅱ类继教学分0.5分,全年最多可获5分。
近年来,随着我国经济水平的提高及人口老龄化的加重,急性心肌梗死(acute myocardial infarction,AMI)已成为我国重要的卫生经济负担[1],因此,AMI的无创性诊断、评估手段也受到越来越多的重视。其中,心脏MR技术凭借其优秀的组织分辨率及较好的空间分辨率,在AMI的诊断与评估中起到了重要的作用。然而,心脏MR常用的序列与其他部位存在较大差异,加之AMI带来的病理生理变化极为多样,且一种病变往往在多个序列中均有异常表现,导致AMI的心脏MR诊断与评估较为复杂。笔者简要介绍心脏MR的检查指征及扫描技术,梳理各种病理生理的影像学表现及其随时间演变情况,以提高影像医师的诊断能力。
心脏MR检查在心肌梗死患者中的检查目标包括:(1)明确心肌梗死诊断及犯罪血管;(2)评估心肌梗死的严重程度,如收缩功能改变情况、水肿及坏死范围;(3)检测心肌梗死并发症,如心肌内出血、微血管阻塞、心腔内血栓、室壁瘤;(4)检测是否合并陈旧性心肌梗死或非缺血性心肌病。
值得注意的是,AMI患者存在再血管化治疗指征时应优先进行再血管化治疗,待一般状况稳定后再行心脏MR检查[2]。
心脏MR检查的常规扫描序列应包括以下几个方面[3]。
1.定位相:用于心脏位置及后续扫描腔位的确定,并粗略观察心脏周边结构。
2.电影:用于观察心脏及周围结构的形态结构异常、心脏局部运动功能障碍,并通过后处理获得心功能数据。扫描时应以左心室短轴(以下简称短轴)覆盖左心室区域,并添加合适的长轴。考虑到在常用的平衡稳态自由进动序列上增强后梗死区与血池的对比度减低,可能导致心肌与血池分界不清并影响心功能测定的准确度,建议在增强前扫描电影。
3.T2WI:主要用于观察心肌水肿及心肌内出血。扫描时应以短轴覆盖左心室区域,必要时添加合适的长轴。建议采用黑血与脂肪抑制序列以减少血池及脂肪对病灶观察的影响。
4.动态增强:用于观察心肌灌注情况。一般情况下,扫描时应至少在心底水平、乳头肌水平及心尖水平各采集一层短轴图像,并根据预估的梗死区位置添加合适的长轴。为保证采集到对比剂流入的过程,应在动态扫描开始数个心动周期后再开始注射对比剂。若发现可疑低灌注区但无法确认,可加扫早期强化。一般只进行静息态灌注,但当犯罪血管已再通且须检测非梗死区是否存在缺血时可考虑进行负荷灌注。
5.早期强化:用于观察局部心肌异常灌注。一般情况下,扫描时应在心底水平、乳头肌水平及心尖水平各采集一层短轴图像。在对比剂注入后1~3 min进行采集。
6.延迟强化:用于观察心肌坏死及微血管阻塞。扫描时应以短轴覆盖左心室区域,必要时添加合适的长轴。在对比剂注入10 min后进行采集。可采用黑血延迟强化序列提高对比。
除常规序列外,有条件的机构还可扫描T1 mapping、T2 mapping、T2* mapping等序列进行进一步分析。
AMI在心脏MR上的直接表现主要包括心肌坏死、心肌水肿及心肌收缩功能障碍,是冠状动脉阻塞、心肌细胞缺血后的直接表现,若不合并慢性缺血、陈旧病灶或其他心肌病,三者在AMI患者中一般共同分布于犯罪血管供血区(图1~8)。
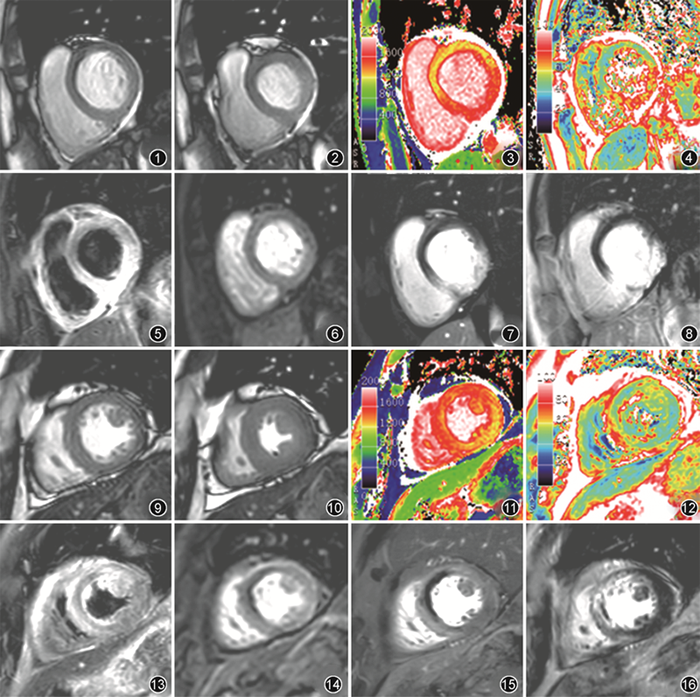

1.心肌坏死:当冠状动脉血流阻塞后,心肌细胞将由于缺血而发生坏死,这是心肌梗死最根本的特点以及在心脏MR中最重要的诊断依据。
由于坏死心肌细胞外容积增大及对比剂排空延迟,坏死心肌在延迟强化序列上呈高信号。病变位于犯罪血管供血区,且由于坏死一般从内膜下向外膜下延伸,进行检查时坏死区一般位于内膜下或呈透壁表现[4](图8),但需要注意的是在不同冠状动脉分支供血交界区由于侧支循环的存在,坏死区可能并不严格位于内膜下。除心室壁外,乳头肌同样可能受累。亦可在增强前及增强后扫描T1 mapping序列并计算细胞外容积(extracellular volume,ECV),心肌坏死区表现为增强前T1延长、ECV增大[4]。
由于血流中止后数小时内未能实现再灌注将导致相应区域的心肌细胞基本全部死亡,一般心肌梗死发生后的首次心脏MR检查即可发现心肌坏死。而心肌细胞无法通过分裂的方式再生,一片区域内心肌细胞坏死后即可认为永久性损失,但延迟强化区大小会由于再灌注治疗后早期的水肿发生、消退以及瘢痕形成过程而存在一定变化[5],因此对延迟强化区域范围变化不应简单地理解为梗死的加重或减轻。心肌坏死区域至慢性期还可能发生脂肪变[6]。
2.心肌水肿:阻塞的冠状动脉供血区心肌细胞往往由于腺苷三磷酸耗竭而快速出现细胞毒性水肿,这将使水肿区T2延长、因此在T2WI序列中呈现高信号(图5)。与心肌坏死类似,病变位于犯罪血管供血区,一般为透壁,部分可能为内膜下。但由于水肿较坏死更易发生,一般在梗死后早期心肌水肿范围将大于心肌坏死范围。除T2WI外,亦可使用T1 mapping、T2 mapping进行观察,表现为水肿区T1、T2延长[4](图6,7)。
缺血发生后心肌水肿可迅速出现,并在随访过程中逐渐消退。大部分患者在慢性期心肌水肿将完全消退,部分患者可能由于慢性炎症等因素而使病变区长期呈T2Wl高信号。
3.心肌收缩功能障碍:腺苷三磷酸耗竭及最终的心肌细胞坏死将导致局部心肌收缩功能丧失,当病变范围较大时,剩余心肌将无法进行充分代偿,使心脏整体收缩功能下降。
心肌的局段收缩功能可直接通过电影序列进行观察,收缩功能障碍表现为犯罪血管供血区心肌收缩减弱、消失或出现反向运动(即收缩期心肌反而向外膨出)[7](图1,2)。整体收缩功能障碍则需要通过电影序列进行后处理并计算心功能指标。

心肌收缩功能障碍的程度及其演变受到多种因素的影响。透壁性梗死患者心肌收缩功能障碍较非透壁性患者更严重[8]。一般梗死范围及透壁程度较小,且及时进行再灌注治疗的患者收缩功能较好且可较快恢复;梗死较严重者、尤其是出现微血管阻塞(microvascular obstruction,MVO)的患者一般收缩功能恢复缓慢[9]。
除直接表现外,AMI患者可能出现一系列并发症,这些并发症将在很大程度上决定患者的预后,且一些并发症需要特定手段进行治疗,因此对并发症进行诊断与评估同样是心脏MR检查的重要任务。需要注意的是,同一患者中可能同时出现多种不同类型的并发症(图9~16)。
1.MVO:进行再灌注治疗后,冠状动脉大血管恢复通畅,但部分患者的部分梗死区心肌仍呈现出低灌注,这一现象被称为MVO或“无复流”现象。其具体原因尚有一定争议,早期研究往往认为其由微血栓形成导致,近年来部分研究显示其还与毛细血管结构破坏、组织水肿及心肌内出血导致的毛细血管压迫等多种因素有关[10]。
MVO在MR上表现为动态增强低灌注、钆剂早期强化低信号及延迟强化低信号,且同一次检查低信号区范围随对比剂注入后时间的延长逐渐缩小,即动态增强>早期强化>延迟强化[11](图14~16)。这一变化导致增强后不同时间点采集到的MVO范围存在较大差异,因此讨论MVO范围时应首先确定采集时间。部分资料将动态增强及早期强化获得的MVO称为“早期MVO”(early MVO),而将延迟强化获得的MVO称为“延迟MVO”(late MVO)以示区分[12, 13]。
MVO在梗死后即刻出现,随梗死后时间延长,范围均逐渐缩小[14](图17~20),临床实践中发现一般梗死发生后1个月左右延迟强化上的灌注缺损即基本消失,而动态增强及早期强化上的灌注缺损可能完全消失或长期存在。
2.心肌内出血:心肌缺血发生时,除心肌细胞受到损伤外,毛细血管管壁细胞同样可能由于缺血而坏死,而毛细血管结构的受损将在再灌注等因素的作用下导致红细胞进入组织间隙,即心肌内出血[15]。
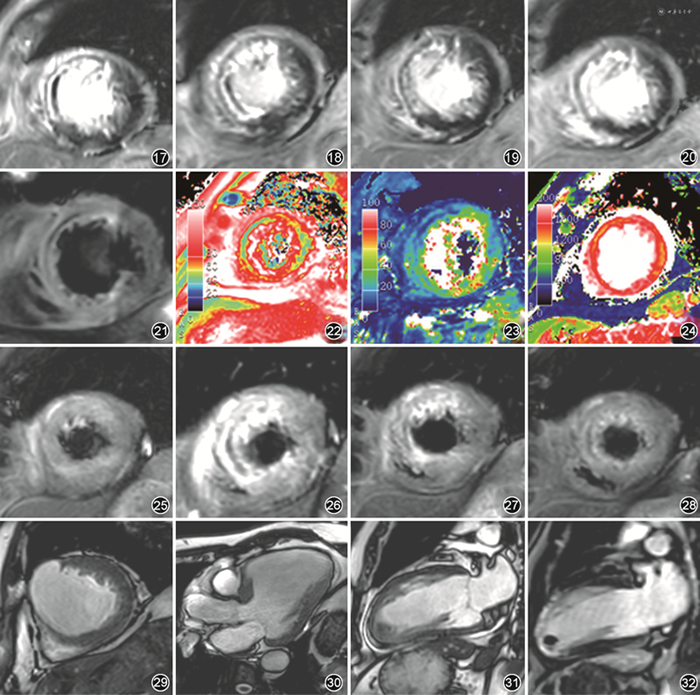
与颅内血肿类似,心肌内出血可在特定时间点使组织T1、T2、T2*缩短,使其能在相应序列中得到显示[4],其中最常用的序列为T2WI,表现为T2WI低信号,且一般被T2WI高信号的水肿区包绕。心肌内出血的定量评估则依赖于T2 mapping及T2* mapping,表现为T2、T2*缩短,其中T2* mapping对心肌内出血相对更敏感[16],但受伪影干扰更大。T1 mapping序列中同样可观察到T1缩短,但相对较少用于定量(图21~24)。
心肌内出血范围随时间变化规律同样较复杂。通过T2 mapping及T2* mapping进行评估时,早期范围逐渐增大,并在梗死后3 d左右达到峰值,后逐渐吸收[17]。至慢性期部分患者的心肌内出血吸收后可能不明显,部分患者由于含铁血黄素沉积而长期阳性(图25~28)。
值得注意的是,一般有心肌内出血的患者均有MVO,但有MVO的患者则不一定有心肌内出血[4]。
3.其他值得关注的表现:部分梗死为透壁性且范围较大的患者可能出现室壁瘤,表现为梗死区域室壁局部膨出伴反向运动,可对心功能产生较大影响,并增大心脏破裂的风险(图29,30)。另一类极为危险的相关表现称为假性室壁瘤,实质为心室破裂,但尚未撕裂至心外膜,同样表现为室壁局部膨出伴反向运动,但心内膜面结构不连续,膨出区域常与心腔呈“窄颈”连接[18]。
部分患者可能出现心腔内血栓,易发生于梗死区域,尤其是心尖部,表现为电影序列心腔内低信号灶,一般紧贴室壁、活动度小,T1WI及T2WI信号可变,新发的血栓增强后各序列均无强化[19](图31,32)。
AMI可能存在心包改变,一般梗死范围较大、心功能不全患者可能出现心包积液[20],亦有少部分患者会出现心肌梗死后心包炎,表现为心包增厚、T2WI高信号伴延迟强化[21]。
心肌梗死患者的正常心肌常出现代偿性改变,表现为正常心肌室壁增厚、收缩活动增强[22]。应注意的是代偿性改变可能导致心底水平室间隔厚度超过15 mm,此时不应将其作为肥厚型心肌病的诊断依据。增厚的心肌可能随时间推移、整体心功能恢复而有所恢复。
临床上需要与AMI进行鉴别的疾病主要包括心肌炎与应激性心肌病,两者在临床表现、心电图与心肌酶改变上与AMI存在一定交叉,因此常作为可疑AMI收治入院,但冠状动脉造影结果不足以解释其临床表现,需要进行鉴别。
1.心肌炎:心肌炎患者一般较心肌梗死患者更年轻。心肌炎的心脏MR表现包括T2WI高信号,早期强化高信号,延迟强化高信号且呈非缺血性分布,较典型者位于心肌中层及心外膜下,呈片状或线状,可能伴有心肌收缩功能减弱及心包积液[23]。
2.应激性心肌病:应激性心肌病又称心碎综合征、心尖球形综合征、Tako-Tsubo心肌病等,绝经后妇女多见,病因尚存在一定争议。其典型心脏MR表现包括心尖部收缩活动减弱至消失,导致收缩期左心室长轴呈烧瓶样改变;常有乳头肌至心尖水平T2WI高信号,但一般没有明显的延迟强化[24]。
综上所述,AMI的心脏MR表现较复杂,因此放射科医师应在充分了解心肌梗死的各种病理生理改变及其随时间演变规律的基础上进行诊断及鉴别诊断。
所有作者声明无利益冲突
吴崇文, 安东敖蕾, 陈冰华, 等. 急性心肌梗死心脏MR成像技术及影像表现[J]. 中华放射学杂志, 2023, 57(1): 110-115. DOI: 10.3760/cma.j.cn112149-20220630-00557.
1.以下序列在急性心肌梗死的心脏MR成像中相对不常用的是()
A.电影
B.T2WI
C.SWI
D.延迟强化
2.以下关于心肌梗死导致的心肌坏死的说法中,正确的是()
A.表现为延迟强化高信号
B.常分布于心外膜下
C.在心肌梗死发生数天后出现
D.慢性期范围一般明显大于急性期
3.心肌内出血可能在以下那些序列中出现信号改变()
A.T1 mapping
B.T2 mapping
C.T2* mapping
D.以上都是
4.以下关于微血管阻塞的说法错误的是()
A.表现为增强后心肌内低灌注区
B.一定伴有心肌内出血
C.同一次检查对比剂注射后随时间推移,低灌注区范围逐渐缩小
D.同一患者随访过程中一般范围逐渐缩小
5.心梗后的血栓易发生于()
A.梗死区心腔内
B.左心耳
C.心包腔内
D.冠状静脉内



























