
比较中低位局部进展期直肠癌术前采用短程放疗联合化疗的全程新辅助治疗(SCRT-TNT)和新辅助放化疗(nCRT)两种模式的安全性与有效性。
采用回顾性队列研究方法。分析2016年9月至2020年3月在福建省肿瘤医院胃肠肿瘤外科就诊的126例中低位局部进展期直肠癌患者。其中男73例,女53例,年龄23~77(56.5±9.8)岁。根据患者接受的新辅助治疗方案(2018年12月前为nCRT治疗,2019年1月后为接受SCRT-TNT治疗),将患者分为nCRT组(68例)和SCRT-TNT组(58例)。2组患者年龄、性别、肿瘤距肛缘距离、美国东部肿瘤协作组(ECOG)体力状态评分、肿瘤TNM分期等基线资料的比较,差异均无统计学意义(均P>0.05)。2组均采用三维适形调强放疗(IMRT),nCRT组放疗剂量为5周(50Gy/25次),放疗期间口服卡培他滨化疗,放疗结束休息6~8周后行直肠癌全直肠系膜切除术(TME);SCRT-TNT组给予奥沙利铂+卡培他滨(CapeOX)方案诱导化疗2周期后开始予短程放疗5 d(25 Gy/5次),巩固化疗(4周期)治疗结束后2周行手术治疗。比较分析两组放化疗不良反应、围手术期安全性以及新辅助治疗疗效。
两组患者均按计划完成新辅助治疗。nCRT组和SCRT-TNT组患者放化疗不良反应发生率相当,手术并发症发生率、手术时间、术中出血量、术后住院时间方面的差异均无统计学意义(均P>0.05)。共119例患者完成TME,nCRT组64例,SCRT-TNT组55例,均为R0切除。nCRT组完全缓解率(pCR)为10.9%(7/64),SCRT-TNT组pCR为25.5%(14/55),差异有统计学意义(P=0.038)。术后2年,2组患者的局部复发率与总生存率比较,差异无统计学意义(P>0.05);但SCRT-TNT组的临床转移率明显低于nCRT 组(20.3%比9.1%),差异有统计学意义(χ2=4.267,P=0.039)。
在中低位局部进展期直肠癌的治疗中,SCRT-TNT不增加放化疗不良反应及围手术期风险,肿瘤退缩效果良好,有临床推广应用价值。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
2020年全球癌症数据报告,结直肠癌位列最常见恶性肿瘤第3位,死亡率排在第2位,我国的发病率与死亡率在全球前列[1]。由于盆腔结构复杂,中低位局部进展期直肠癌(locali advanced rectal cancer,LARC)患者完整手术切除难度较大、保肛率低、局部复发率及并发症发生率高。目前国际上LARC的主流治疗方式是以新辅助放化疗(neoadjuvant chemoradiotherapy,nCRT)结合手术治疗为主,但部分文献报道了一定的全身转移风险[2, 3]。全程新辅助治疗(total neoadjuvant therapy,TNT),即在术前予以巩固化疗方法并与nCRT相结合治疗,结果显示该模式的依从性较高且效果良好[4]。双药或三药治疗、诱导化疗或巩固化疗、短程放疗(short-range radiotherapy combined,SCRT)联合化疗或长程放化疗以及是否联合免疫治疗等选择也是TNT研究的热点问题。术前采用SCRT联合双药化疗的TNT(SCRT-TNT)模式目前国内外报道较少。国内STELLAR[5]研究报道了短程放疗后序贯4周期巩固化疗较nCRT组获得较高的完全缓解(complete response,CR)率及3年无病生存(disease free survival,DFS)率和总生存(overall survival,OS)率。为此,本研究回顾性分析比较本中心nCRT与SCRT-TNT模式治疗LARC并发症及疗效等,旨在分析该SCRT-TNT是否可为LARC相关治疗带来新方向,以期为患者提供更佳的治疗方案,甚或为倾向非手术策略选择保留器官的等待观察患者们带来希望,现将结果报道如下。
回顾性分析2016年9月至2020年3月在福建省肿瘤医院胃肠肿瘤外科就诊的LARC(距肛缘≤10 cm,距肛缘>10 cm的高位直肠癌的治疗原则一般参见结肠癌)。纳入标准:(1)年龄18~80岁;(2)病理证实为腺癌;(3)5年内未罹患过肿瘤或行肿瘤相关治疗;(4)经磁共振成像(magnetic resonance imaging,MRI)或直肠腔内超声及多学科团队(multi disciplinary team,MDT)评估诊断为cT3~4aN0或cT1~4aN1~2;采用中国临床肿瘤学会结直肠癌诊疗指南(2021)统一的影像学标准判断淋巴结转移情况,如:淋巴结短径≥8 mm、形态不规则、边界不清楚、信号/回声不均匀等;(5)美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分0~1分或Karnofsky评分≥70分,无严重心脑肺等基础疾病,能够耐受放化疗及手术治疗。排除标准:(1)既往接受过直肠癌治疗,本次为局部复发者;(2)远处转移(M1);(3)同时性多原发癌;(4)神经内分泌肿瘤;(5)患有遗传性肿瘤或炎症性肠病;(6)临床病理资料不完整;(7)入组其他临床试验。共有126例患者纳入本研究。所有患者均接受了全面的术前检查,包括完整的病历记录和体格检查,癌胚抗原、血红蛋白、白蛋白等检验,肠镜、病理、胸部CT、腹部MRI及直肠腔内彩超等检查。本研究为回顾性队列研究,获得福建省肿瘤医院伦理委员会的批准(批号:K2018-104-01),患者及家属均签署知情同意书。
最终共126患者进入本研究,其中男73例,女53例,男女比例1.45∶1,年龄23~77(56.5±9.8)岁。根据患者接受的辅助治疗方案(2018年12月前为nCRT治疗,2019年1月后为接受SCRT-TNT治疗),将患者分为nCRT组(68例)和SCRT-TNT组(58例),治疗前均经本院结直肠癌MDT讨论通过。两组患者年龄、性别、肿瘤距肛缘距离、ECOG体力状态评分、肿瘤临床TNM分期等基线资料的比较,差异均无统计学意义(均P>0.05),见表1。
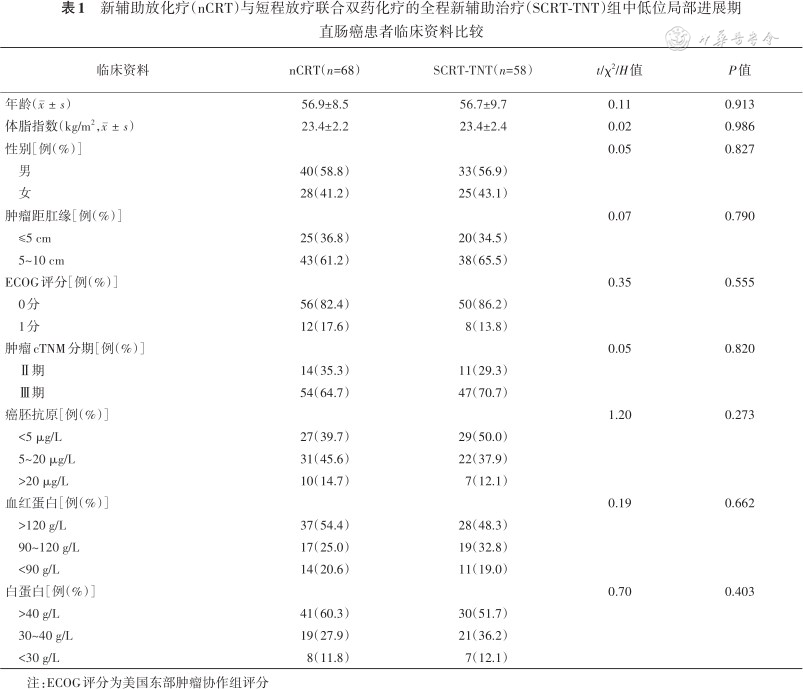
新辅助放化疗(nCRT)与短程放疗联合双药化疗的全程新辅助治疗(SCRT-TNT)组中低位局部进展期直肠癌患者临床资料比较
新辅助放化疗(nCRT)与短程放疗联合双药化疗的全程新辅助治疗(SCRT-TNT)组中低位局部进展期直肠癌患者临床资料比较
| 临床资料 | nCRT(n=68) | SCRT-TNT(n=58) | t/χ2/H值 | P值 |
|---|---|---|---|---|
年龄() 体脂指数(kg/m2,) | 56.9±8.5 23.4±2.2 | 56.7±9.7 23.4±2.4 | 0.11 0.02 | 0.913 0.986 |
性别[例(%)] 男 女 | 40(58.8) 28(41.2) | 33(56.9) 25(43.1) | 0.05 | 0.827 |
肿瘤距肛缘[例(%)] ≤5 cm 5~10 cm ECOG评分[例(%)] 0分 1分 肿瘤cTNM分期[例(%)] Ⅱ期 Ⅲ期 癌胚抗原[例(%)] <5 μg/L 5~20 μg/L >20 μg/L 血红蛋白[例(%)] >120 g/L 90~120 g/L <90 g/L 白蛋白[例(%)] >40 g/L 30~40 g/L <30 g/L | 25(36.8) 43(61.2) 56(82.4) 12(17.6) 14(35.3) 54(64.7) 27(39.7) 31(45.6) 10(14.7) 37(54.4) 17(25.0) 14(20.6) 41(60.3) 19(27.9) 8(11.8) | 20(34.5) 38(65.5) 50(86.2) 8(13.8) 11(29.3) 47(70.7) 29(50.0) 22(37.9) 7(12.1) 28(48.3) 19(32.8) 11(19.0) 30(51.7) 21(36.2) 7(12.1) | 0.07 0.35 0.05 1.20 0.19 0.70 | 0.790 0.555 0.820 0.273 0.662 0.403 |
注:ECOG评分为美国东部肿瘤协作组评分
2组患者均采用三维适形调强放疗(intensity-modulated radiotherapy,IMRT),放疗靶区均由经验丰富的副主任级别以上医师勾画确定,靶区包括原发肿瘤区域及转移淋巴结区域。两组手术均由具有10年以上丰富腔镜手术经验的胃肠肿瘤外科专业医疗组完成并详细记录。
1. nCRT组:放疗剂量为50Gy/25次,治疗5周。放疗期间口服卡培他滨化疗,卡培他滨的剂量为825 mg/m2(江苏恒瑞医药股份有限公司生产,规格:0. 5 g,国药准字号:H20133365),口服,2次/d。放疗结束休息6~8周后行手术治疗。
2. SCRT-TNT组:放疗剂量为25 Gy/5次,治疗5 d。卡培他滨和奥沙利铂(CapeOX)方案诱导化疗2周期后1周开始予放疗,放疗结束后1周开始巩固化疗(4周期),治疗结束后2周行手术治疗,放疗后至手术间隔期约10~12周。CapeOX方案为:奥沙利铂130 mg/m2(费森尤斯卡比医药有限公司产品,规格:50 mg,国药准字号:H20093892),静脉注射,第1天;卡培他滨1 000 mg/m2,口服,2次/d,第1~14天;每3周1次。
比较2组患者新辅助治疗后的临床疗效,对所有患者按首诊检查进行常规评估,包括常规血检、肿瘤标志物、腹部MRI等。
1. 放化疗不良反应:根据常见不良事件评价标准(common terminology criteria adverse events,CTCAE)5.0版[6]进行分级评估。
2. 临床疗效评估:依据实体瘤疗效评价标准(response evaluation criteria in solid tumours,RE-CIST)1.1版标准,CR定义为:综合多种临床检查和影像学检查手段(肛门指检、肠镜、超声内镜、CT、MRI等)均未发现病变残留[7]。
3. 围手术期安全性:观察术后30 d内出现的手术相关感染、出血、吻合口漏、心肺系统等并发症。
4. 病理退缩效果评估:R0切除的定义为显微镜下切缘阴性(无肿瘤细胞残留),R1和R2切除分别定义为镜下和肉眼可见的肿瘤残留。肿瘤降期定义为术后病理分期低于治疗前的临床分期。肿瘤消退分级(tumor regression grading,TRG)按照美国综合癌症网络(National Comprehensive Cancer Network,NCCN)指南推荐的改良的评估肿瘤治疗反应分级系统[8]:TRG 0 级:完全退缩,TRG 1 级:接近完全退缩,TRG 2级:部分退缩,TRG 3级:退缩不良或无退缩。对所有患者术后病理进行重新分期。所有患者的病理切片均由1位胃肠道病理专家重新复阅、评估。
5. 预后情况评估:观察比较2组患者预后情况,随访时间为24个月。比较术后2年患者的局部复发率、临床转移情况(经结肠镜、胸腹部CT等检查确定是否出现转移或者复发);分析DFS和OS情况。
建立规范的数据库并将纳入资料统一录入。应用SPSS 23.0软件对资料进行分析。符合正态分布的计量资料采用表示,两组间比较采用两独立样本t检验。计数资料采用例(%),两组数据采用χ2检验或Fisher确切概率法;等级资料采用Kruskal-Wallis秩和检验进行比较。采用双侧检验,检验水准α=0.05。
所有患者对新辅助化疗受性良好,不良反应轻,未发现4~5级严重不良反应,总体安全可控。主要放化疗相关不良反应见表2。胃肠道不良反应主要包括恶心、呕吐、腹泻、放射性肠炎;血液系统不良反应主要包括粒细胞减少、贫血等;肝功能不良反应主要为转氨酶、胆红素升高,无肾功能不良反应;外周神经毒性主要包括肢端麻木、其他神经系统障碍;皮肤毒性主要包括皮疹、脱发。两组患者在放化疗不良反应发生率方面差异均无统计学意义(P>0.05)。
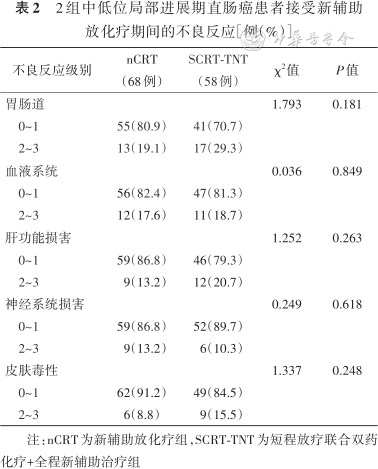
2组中低位局部进展期直肠癌患者接受新辅助放化疗期间的不良反应[例(%)]
2组中低位局部进展期直肠癌患者接受新辅助放化疗期间的不良反应[例(%)]
| 不良反应级别 | nCRT (68例) | SCRT-TNT (58例) | χ2值 | P值 |
|---|---|---|---|---|
胃肠道 0~1 2~3 | 55(80.9) 13(19.1) | 41(70.7) 17(29.3) | 1.793 | 0.181 |
血液系统 0~1 2~3 | 56(82.4) 12(17.6) | 47(81.3) 11(18.7) | 0.036 | 0.849 |
肝功能损害 0~1 2~3 神经系统损害 0~1 2~3 皮肤毒性 0~1 2~3 | 59(86.8) 9(13.2) 59(86.8) 9(13.2) 62(91.2) 6(8.8) | 46(79.3) 12(20.7) 52(89.7) 6(10.3) 49(84.5) 9(15.5) | 1.252 0.249 1.337 | 0.263 0.618 0.248 |
注:nCRT为新辅助放化疗组,SCRT-TNT为短程放疗联合双药化疗+全程新辅助治疗组
nCRT组在术前检查发现有1例患者出现远处转移,SCRT-TNT组1例腔镜探查发现腹盆腔播散型转移,未行手术治疗。nCRT组、SCRT-TNT组各有5例(7.35%)、9例(15.5%)评价为肿瘤临床客观缓解率(clinical complete remission,cCR),差异无统计学意义(χ2=2.113,P=0.166)。其中nCRT组3例、SCRT-TNT组2例拒绝行全直肠系膜切除术(TME)手术要求采取等待观察策略,目前随访2年无明显复发转移。119例手术均为R0切除,术后病理结果显示,nCRT组病理完全缓解率(pCR)为7例(10.9%),SCRT-TNT组为14例(25.9%),差异有统计学意义(χ2=4.498,P=0.034)。另nCRT组TRG 1级14例(21.9%),TRG 2级29例(45.3%),TRG 3级14例(21.9%);SCRT-TNT组TRG 1级17例(31.5%),TRG 2级13例(24.1%),TRG 3级10例(18.5%)。SCRT-TNT组的TRG分级(H=5.302,P=0.021)及术后病理再ypTNM分期结果均优于nCRT组(H=4.416,P=0.036),差异有统计学意义。
共119例患者完成TME,nCRT组64例,SCRT-TNT组55例;nCRT组放化疗结束至手术时间间隔为6~8周,SCRT-TNT组为10~12周;因各病例均有放化疗史,Dixon术式者均行预防性末段回肠造口术。手术并发症总例数21例(16.8%)。nCRT组中肠梗阻2例,盆腔感染2例,吻合口出血1例,尿潴留1例,淋巴漏1例,肺部感染2例,切口愈合不良1例,下肢深静脉血栓1例。SCRT-TNT组中肠梗阻1例,盆腔感染2例,吻合口出血1例,尿潴留1例,淋巴漏2例,肺部感染1例,切口愈合不良1例。21例并发症均经相应对症治疗后转好,无二次手术。术后30 d内2组患者均未发生死亡或继发心脑肺等严重不良事件。2组患者的手术时间、手术失血量及术后住院天数方面差异无统计学意义(P>0.05)。nCRT组64例,SCRT-TNT组55例,均为R0切除。nCRT组pCR为10.9%(7/64),SCRT-TNT组为25.5%(14/55),差异有统计学意义(χ2=4.29,P=0.038)。
术后2年,2组患者的局部复发率(7.81%比5.45%)与OS率(93.8%比94.5%)比较,差异均无统计学意义(均P>0.05);但SCRT-TNT组的临床转移率9.1%明显低于nCRT 组20.3%(χ2=4.267,P=0.039),差异有统计学意义。
近年来,“nCRT+TME+术后辅助化疗”的标准治疗模式已显著降低了LARC的局部复发率及切缘阳性率[9],但在提高DFS和OS等长期预后方面仍不够显著[10]。欧洲学者研究指出,经过nCRT之后,行术后辅助化疗并不能给患者带来生存获益[11, 12]。GCR-3研究中将108例直肠癌患者随机分为TNT与nCRT两组,尽管两组病理pCR差异无统计学意义(13.5%比14.3%),但TNT组显示出了更高的治疗依从性(91%比54%)[13]。而美国纪念斯隆-凯特琳癌症中心的回顾性研究结果显示,对于局部进展期直肠癌患者,TNT组(308例)pCR明显高于nCRT组(320例)(35.7%比21.3%,P<0.05)[14]。基于上述两项研究结果,NCCN指南中将TNT列为局部进展期直肠癌的推荐治疗策略之一。而一项荟萃28项研究,纳入2 688例患者接受TNT模式治疗的meta分析发现,接受TNT的患者pCR高于既往报道的nCRT(22.4%比13.7%,P=0.001)[15],证实了TNT的临床应用价值。但对于双药或三药治疗、诱导化疗或巩固化疗、短程放疗联合化疗或长程放化疗以及是否联合生物免疫治疗等选择成为了当前探索的热点问题。
国内中山大学附属第六医院的FOWORC研究[16]提示术前放疗结合两药化疗可以获得更高的pCR。本研究结果pCR(25.9%)与其接近(27.5%),显示出了短程放疗联合两药化疗的可行性。进一步与本研究类似的是国内知名度高的STELLAR[5]研究,其结果显示分别有16.6%和11.8%的患者达到pCR(P=0.134);部分患者术前治疗后持续肿瘤完全消退(cCR)而豁免手术,TNT组pCR+持续cCR的概率为21.5%,显著高于CRT组的12.3%(P=0.002)。本研究模式与其大致相仿,本研究结果的pCR略高STELLAR研究,考虑可能在于本研究中与短程放疗前先予2周期的诱导化疗有关。Garcia-Aguilar等[17]报告,在nCRT和TME之间增加FOLFOX巩固化疗后,pCR随着巩固化疗周期数的增加而提高。无论是巩固化疗还是诱导化疗,TNT与根治性手术的时间间隔增加,可能为肿瘤细胞退缩提供了足够的时间,从而提高pCR[18]。
传统认为长程放疗与SCRT相比,优势在于肿瘤降期明显,可提高保肛率及pCR,却未显著改善 DFS和OS。但已有多项Ⅲ期临床研究显示延长SCRT和手术之间的间歇期,可以提高pCR[19],也可以获得不劣于长程放疗的肿瘤退缩效果。因此,SCRT后适当延长等待间歇期是一个治疗的策略,但如何更好优化,从而带来更高生存获益,值得进一步探索[20]。
在围手术期安全性方面,本研究nCRT组放化疗结束至手术时间间隔为6~8周,SCRT-TNT组为10~12周;2组患者采取的手术方式比例并无明显区别,在手术时间、术中出血量、并发症类型与发生率及术后住院时间方面,CRT-TNT组较nCRT组差异无统计学意义(P>0.05),安全性良好。Cercek等[14]的研究中,TNT组的手术间隔大都在12周左右,并认为间隔期≥12周是安全的,不仅不影响患者远期生存状况,反而认为更长的时间间隔利于肿瘤的消退。在放化疗不良反应上,本研究中对128例患者行术前新辅助治疗,所有患者对放化疗的耐受性良好,安全可控,总体不良反应轻,未发现4~5级严重不良反应,且两组间的不良反应发生率差异无统计学意义(P>0.05)。Ciseł等[21]研究发现,与长程放化疗相比,短程放疗联合巩固化疗的不良反应发生率更低(P=0.006),3年总体生存率增加(73%比65%,P=0.046)。当然,在本研究中两组的不良反应率相仿,不能排除与样本例数尚少有关。
本研究结果显示,SCRT-TNT组的临床转移率明显低于nCRT 组(20.3%比9.1%),差异均有统计学意义(P<0.05)。而nCRT组在临床转移率更高的情况下,仍与SCRT-TNT组的总生存率相当,考虑可能是因为得益于当前综合治疗手段及水平的提高,后续结果仍有待更长的随访时间来验证。Jin等[5]的STELLAR研究随访3年TNT组的OS率明显高于CRT组(P=0.033),而2组的无转移生存率和局部区域复发率差异亦无统计学意义。
当然本研究也存在不足之处:(1)本研究是单中心研究且为回顾性研究,样本量较少,未进行随机对照研究,可能存在偏倚。(2)目前本研究随访的时间尚短,还需更长期的生存情况来验证效果。期待在以后的研究中能够进一步扩大样本量,开展多中心前瞻性随机对照研究,以更好地证实该治疗模式在中低位进展期直肠癌中的作用。当前,LARC的治疗已处于疗效与保器官、保功能并重的时代,目前国内多中心的多项前瞻性临床试验正在为未来直肠癌的精准化、个体化治疗提供更多的选择,笔者也将继续遵循这一原则做更多的临床实践。
综上分析,笔者认为SCRT-TNT模式治疗LARC不仅能够提高患者的临床缓解率,还能够改善患者的预后且安全性高,与相关文献报道[14]的结论与观点一致。其原因与术前治疗强度高、放化疗结束直至手术时间间隔较长有关,而这也是TNT 模式治疗的策略性优化,也是改变患者预后的重要方法。这种“SCRT-TNT”的治疗模式,具有较高的临床应用价值。相对于术前放疗,全身化疗基本上县市级医院均有开展,患者就医方便。在诊断明确后,仅需在本中心完成术前SCRT,回到当地就近医院完成新辅助化疗,二者有效结合,可减少患者外出就诊的诸多不便,可值得临床进一步推广。
陈昌江, 杨春康, 简锦亮, 等. 短程放疗联合化疗的全程新辅助治疗在中低位直肠癌治疗中的应用[J]. 中华医学杂志, 2023, 103(4): 271-277. DOI: 10.3760/cam.j.cn112137-20220514-01055.
所有作者均声明不存在利益冲突



























