
输尿管子宫内膜癌罕见,考虑其由异位到输尿管的子宫内膜发生恶变形成,而异位子宫内膜恶变的发生率仅为1%左右。本文通过分析广西壮族自治区人民医院2021年收治的1例输尿管子宫内膜异位症恶变为中分化子宫内膜样癌患者的诊疗过程,并复习相关文献资料,进一步探讨本病的临床症状、诊断方法、治疗方案及结局。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者60岁,因“反复腰痛2个月余,肉眼血尿4 h”于2021年4月26日在外院就诊,考虑泌尿系统肿瘤,建议转上级医院就诊。遂于2021年5月8日在广西壮族自治区人民医院泌尿外科住院治疗,予尿液基细胞学检查见可疑癌细胞,于2021年5月13日行右侧输尿管镜检查及活检术。术后活检组织病理检查提示:(右侧输尿管)黏膜组织间质腺体增生,见腺体及筛状结构,上皮异型增生。免疫组化法检测:异型增生上皮组织中细胞角蛋白(CK)20阴性(-),配对盒基因2(PAX-2)部分(-),CK7、雌激素受体(ER)、孕激素受体(PR)、PAX-8、特异AT序列结合蛋白2(SATB2)阳性(+),细胞增殖相关核抗原(Ki-67)60%(+),p16斑驳(+)。诊断:腺癌,可能来源于女性生殖系统。患者有子宫内膜异位症(内异症)病史,不除外内异症发生癌变可能。
患者发病以来无尿频、尿急、排尿困难,无畏寒、发热等不适。既往史:2008年因内异症行直肠切除术。2012年因体检发现右侧输尿管管腔狭窄予置入输尿管支架治疗,定期更换;2020年9月患者要求彻底解决输尿管狭窄,遂于外院行“右侧输尿管膀胱再植术”,术后排尿顺畅,自述肾功能正常,无血尿。生育史:孕3产1,1988年因输卵管妊娠行经腹输卵管妊娠病灶去除术;50岁绝经,绝经后无异常阴道流血、流液。
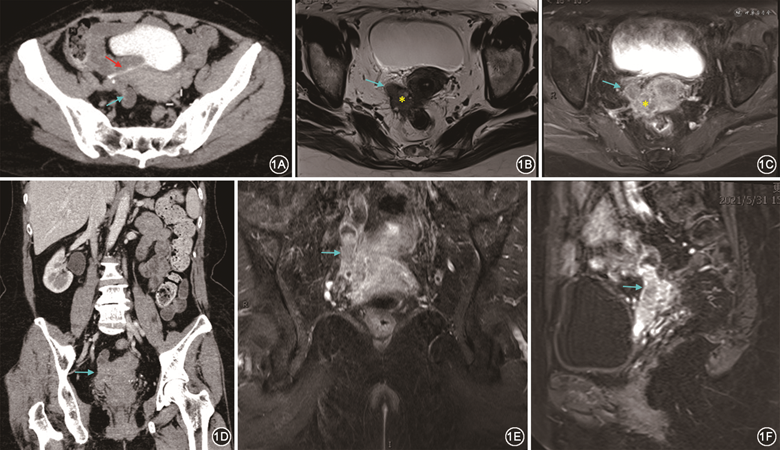
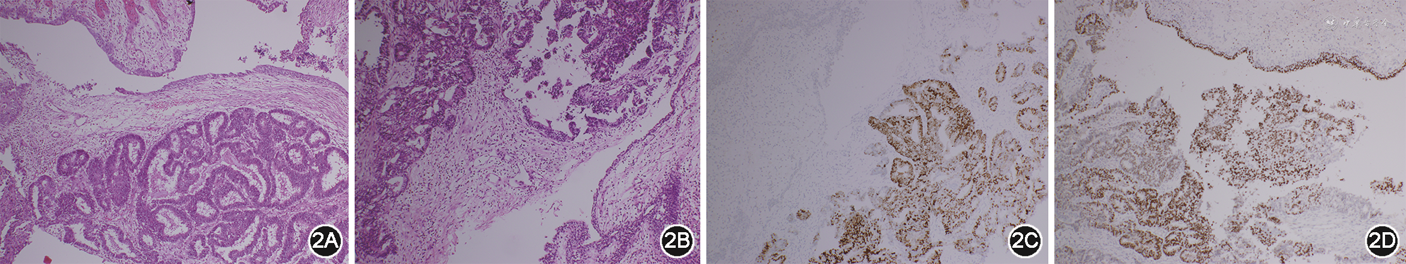
专科检查:双肾区无隆起,无压痛及叩痛。妇科检查:子宫萎缩,右侧宫旁触及一大小约4 cm肿物,质硬,活动差。泌尿外科联系本科会诊后转入本科。术前检查血清癌抗原125(CA125)水平为50 kU/L,人附睾分泌蛋白4(HE4)水平为96 pmol/L。盆腔彩超:盆腔见管状肿块,大小为3.7 cm×1.3 cm×1.1 cm,边界清,似沿输尿管走行,见稍丰富血流信号,提示:右侧输尿管癌?磁共振成像(MRI)检查:膀胱右后方、子宫右侧见团片状、柱状异常信号,与膀胱相连,大小为3.6 cm×2.7 cm×5.8 cm,考虑:肿瘤性病变,右侧输尿管残端来源?右侧附件来源?见图1。CT检查:右侧肾盂呈壶腹型扩张,右侧输尿管下段呈细线样开口于膀胱顶后壁,膀胱后方见一管状实性团块影,边界不清,与膀胱后壁、子宫颈、直肠外壁粘连,范围为2.4 cm×2.4 cm。提示:右侧输尿管下段开口异常,考虑术后改变;膀胱后方软组织肿块,考虑残余输尿管并发肿瘤性病变。正电子发射体层摄影(PET)-CT检查:子宫右侧占位性病变,大小约3 cm,与子宫及直肠粘连,与膀胱后壁关系密切,右侧输尿管下段显示不清,考虑恶性肿瘤,输尿管来源?右侧肾盂、右侧输尿管上段扩张、积水。于2021年6月11日行剖腹探查术,术中见:子宫、卵巢萎缩,膀胱盆底粘连严重,右侧输尿管再植处及原输尿管口处突起,膀胱壁外右后侧壁触及一大小约7 cm×3 cm条索形质硬组织,再植输尿管下端及输尿管残端被包裹其中。根据术中情况决定继续行经腹子宫全切除+双侧附件切除+阑尾切除+右侧盆腔淋巴清扫+肠粘连松解+右侧输尿管残端切除+右侧输尿管膀胱再植+膀胱肌瓣代输尿管成形+膀胱外肿物切除+右侧输尿管支架置入术。术后常规病理检查及免疫组化法检测提示:右侧输尿管中分化子宫内膜样癌,癌细胞浸润输尿管固有肌层及外膜,ER、PR(+),见图2;子宫腺肌病,子宫平滑肌瘤,萎缩性子宫内膜;子宫后壁浆膜面、深肌层见癌细胞累及,双侧附件未见癌细胞累及;膀胱外肿物见转移性和浸润性高分化子宫内膜样癌,见脉管内癌栓,ER 85%(+),PR 8%(+)。术后诊断:右侧输尿管中分化子宫内膜样癌,术后患者接受了多西他赛+洛铂方案的联合化疗,21 d为1个疗程,共6个疗程,化疗后随访至今无复发迹象。


内异症是指子宫内膜或类似组织在宫腔外发育的疾病,常见的发病部位为卵巢、宫骶韧带、盆腔腹膜和阴道直肠隔,病变累及泌尿系统尤其是输尿管少见,因输尿管内异症在临床表现方面缺少特异性,因此,对于临床诊断有一定困难。
1. 临床表现:内异症是育龄期妇女的常见病、多发病,通常表现为盆腔疼痛和生育功能低下,在育龄期妇女中内异症的发病率为10%~15%,而绝经后妇女的发病率不足3%[1, 2, 3]。内异症虽为良性病变,但具有类似恶性肿瘤的侵袭性、黏附性,甚至破坏周围正常组织[3]。内异症存在恶变的可能,但其发生率很低,仅有1%左右[2, 3]。80%的内异症恶变发生于卵巢,称为内异症相关的卵巢上皮性癌(endometriosis-associated ovarian cancer,EAOC),其主要病理类型为子宫内膜样癌或透明细胞癌[2];不足20%的内异症恶变发生于卵巢外,称为卵巢外内异症相关的癌(extra-ovarian endometriosis associated carcinoma,EOEAC),如发生于肠、盆腔及道格拉斯腔、剖宫产术后的腹壁切口、顺产后的会阴切口、泌尿系统等部位[4],因输尿管的内异症很少见,故输尿管内异症的恶变更为罕见。诸多证据表明,内异症病变即使在肉眼看不到的情况下,也可恶变为透明细胞癌或子宫内膜样癌,这与本例患者的输尿管内异症恶变为中分化子宫内膜样癌相符。在内异症的发生部位中,输尿管的发生率小于0.1%[5]。输尿管内异症无论是否恶变均无特异性的临床症状,故术前难以诊断。根据与输尿管的解剖关系,输尿管内异症分为管腔内型和管腔外型,两者的比例约为1∶4,管腔外型内异症的病灶是从输尿管外周侵袭压迫输尿管,而管腔内型的病灶位于输尿管内,因此,相比于管腔外型而言管腔内型早期即可出现血尿、梗阻等症状[6]。本例患者的输尿管内异症即为管腔内型,异位到输尿管管腔的子宫内膜导致患者出现肉眼或镜下血尿,与本例患者的最初临床表现相符;之后,管腔内的内异症病灶发生恶变后侵袭扩散,继而出现了输尿管梗阻、腰痛等不适,如不及时医治甚至会出现感染、发热,最终肾功能丧失等可能,本例患者与上述表现相符。事实上,累及输尿管的内异症患者中只有小部分有症状,而大部分患者表现为无症状的阻塞性尿路病变,甚至有少数患者出现肾功能衰竭才发现此病[7, 8]。
2.诊断:临床上,因为血尿、腰痛、发热等症状是非特异性的,并且由于输尿管内异症的发生率较低,往往不会首先考虑该疾病的可能,这也造成了一些患者的漏诊和延误治疗。因此,当遇到血尿、腰痛、发热的患者时应详细询问病史,通过超声、MRI、CT等影像学检查,警惕输尿管内异症尤其是其恶变的可能。研究表明,原癌基因KRAS的激活,抑癌基因TP53、ARID1A、PTEN的功能缺陷或缺失,微卫星不稳定性等分子基因的改变,与内异症的恶变具有相关性,故也可以将这些基因、分子作为肿瘤标志物进行筛查[9]。当然,最准确的诊断方法是在输尿管镜直视下观察输尿管内病变并进行病变组织的活检。Sampson早在1925年就提出了用于诊断内异症恶变的评判标准[10],包括以下内容:(1)标本中同时存在良性和恶性子宫内膜组织。(2)内异症与恶性子宫内膜组织相邻。(3)恶性组织的组织学,符合内异症来源,没有转移迹象。本例患者的镜下表现均符合以上诊断标准。
3.治疗:对于有内异症病史的患者,如存在内异症恶变的高危因素(绝经后、高雌激素、免疫抑制等),可加强随访,必要时采用药物治疗(口服短效避孕药、孕激素)或预防性手术(切除子宫、附件)。在临床工作中,需要结合这类患者的病变范围、输尿管梗阻程度、输尿管受累类型、肾功能情况及其他内异症病灶的范围和分布来制定个体化治疗方案。输尿管内异症的手术目的是解除梗阻、血尿等症状,减少内异症的复发,改善患者生命质量。治疗后仍应定期随访,警惕内异症远期恶变可能。对于输尿管内异症恶变患者,术后应辅以紫杉醇和铂类药物为主的联合化疗,必要时补充放疗,以改善患者预后,减少复发[1,11]。本例输尿管中分化子宫内膜样癌考虑是异位到右侧输尿管的子宫内膜发生恶变导致的。异位的子宫内膜恶变的发生率仅为1%左右,因此,还需对这类罕见的输尿管内异症恶变为子宫内膜样癌的患者进行更多的临床研究,以探究最佳治疗方法。
黄晓澜, 赵仁峰, 邓德茂, 等. 输尿管子宫内膜异位症恶变为中分化子宫内膜样癌1例[J]. 中华妇产科杂志, 2023, 58(1): 63-65. DOI: 10.3760/cma.j.cn112141-20220928-00597.
所有作者声明无利益冲突



























