
放射性肠炎是放射治疗引起的肠道并发症。辐射引起肠道微生态改变、肠黏膜屏障破坏,肠道共生微生物及其代谢产物通过影响肠道黏膜屏障免疫功能在辐射损伤和辐射抗性中发挥一定作用。以肠微生态为靶点的微生态制剂和菌群移植可能为预防和治疗放射性肠炎提供新的方向。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
经全国继续医学教育委员会批准,本刊开设继教专栏,每年共刊发10篇继教文章,文后附5道单选题,读者阅读后可扫描标签二维码答题,每篇可免费获得Ⅱ类继教学分0.5分,全年最多可获5分。
放射性肠炎是指盆腔、腹腔、腹膜后恶性肿瘤经放射治疗引起的肠道并发症,可分别累及小肠、结肠和直肠。放射性肠炎根据发病时间可分为急性和慢性两种,急性可于放疗后立即或3个月内发生,慢性可在9~14个月或更长时间后出现,最长可达30年[1]。急性放射性肠炎的临床表现包括但不限于便血、便急、便频、腹泻、黏液粪便、里急后重和肛门疼痛。便血通常是慢性放射性肠炎患者就诊的首要原因,可同时合并便急、便频、便秘、黏液粪便、里急后重和肛门疼痛等症状,晚期严重并发症包括直肠狭窄、穿孔、瘘管形成和肛门失禁[2]。由于放射性肠炎发病时间跨度大、临床症状表现差异大,同时某些癌症患者远期生存率和放疗后肠道并发症就诊率较低,放射性肠炎的患病率可能是被低估的。一组270例接受前列腺癌放疗的患者被要求每年接受定期全结肠镜检查,在6年随访期间136例(50%)患者观察到慢性放射性直肠炎表现,其中包括67例(25%)患者存在症状性出血[3]。放疗后的胃肠道症状影响一半以上患者的生活质量,且这种影响达到中重度[4]。研究放射性肠炎的发病机制和治疗方法对改善放疗患者的预后具有重要的意义。近年来许多研究表明肠道微生态、肠道屏障与放射性肠炎之间存在着错综复杂的关系,有望找到肠道菌群与放射性肠炎的相互作用,发现肠道黏膜屏障在两者作用机制中的地位,以期为放射性肠炎的预防和治疗提供新的靶点。
在人类生命周期的各个阶段,始终有不同种类的微生物寄居于人类体表及与人体外界环境相通的各个腔道中,其中肠道、口腔和皮肤是宿主体内微生物寄居最多的部位。肠道菌群是一个复杂多样的动态系统,受各种因素影响的肠道菌群在不同个体之间存在很大的差异。1 046名不同祖先起源但生活在相对共同环境的健康个体基因型和微生物组数据提示肠道微生物组与遗传没有显著的关联,环境在塑造人类肠道菌群方面的作用远远大于宿主基因[5]。越来越多的研究聚焦于肠道菌群变化及其代谢物对各种疾病的影响,如慢性肾功能不全、代谢综合征、糖尿病、心力衰竭、高血压、动脉粥样硬化和血脂异常等[6]。同样,早期发现无菌小鼠对致命剂量的辐射具有显著的抵抗力且辐射后的小鼠经抗生素处理的持续时间与所达到的保护程度之间存在直接关系,提示了辐射与肠道微生态的相关性。
动物实验发现暴露于电离辐射小鼠的肠道微生物群发生了显著变化。在门水平,辐射后小鼠微生物拟杆菌门/厚壁菌门比例下降,拟杆菌丰度较低,厚壁菌门丰度较高;在属水平上,辐射后拟杆菌门中的拟杆菌属、另枝菌属、普雷沃菌属、理研菌属、梭菌属,厚壁菌门中的肠球菌属、毛螺菌属、杜氏杆菌属,放线杆菌门中的蛋黄菌属,以及变形杆菌门中的大肠杆菌-志贺菌属的丰度在辐射1周均有显著变化,且该变化在辐射慢性期发生逆转[7, 8]。拟杆菌在宿主肠道中主要起到益生菌的作用,这类细菌产生丁酸等短链脂肪酸,有助于减轻炎症和维持肠壁通透性,因此,拟杆菌丰度减少、拟杆菌与厚壁菌门的比率降低部分反映了辐射后肠道微生物群失调的特征。辐射后小鼠肠道菌群的变化存在时间和剂量依赖性,将确定的辐射剂量(0.5 Gy)按照不同辐射次数(LT1、LT5、LT10次)进行分组,比较不同累计辐射剂量和不同时长的肠道菌群变化,结果显示LT1组、LT5组和LT10组辐射后物种数和香农指数明显低于对照组,且随着辐射暴露时间的延长,物种数明显呈时间依赖性减少,辛普森多样性指数随辐射暴露时间的增加呈时间依赖性增加。在门水平上,LT10组拟杆菌、巴氏杆菌的丰度呈时间依赖性下降,梭菌、螺杆菌和颤螺菌属的丰度呈时间依赖性增加[8]。此外不同辐射水平对肠道菌群的影响也存在一定的差异性,在一个关于小型猪和猕猴辐射后肠道菌群的研究中发现,低辐射水平(1.65和1.80 Gy)导致普氏杆菌的损失和类杆菌的增加,粪便杆菌和双歧杆菌的减少;高辐射水平(1.95~2.25 Gy)导致梭菌簇Ⅳ、ⅩⅣa、ⅩⅣb、欧陆森菌属和另枝菌属的增加,丁酸蓖麻单胞菌和柯林斯氏菌的减少[9]。临床一个对盆腔放疗患者荟萃分析显示,辐射后梭杆菌门和其他未分类细菌增加,而厚壁菌和拟杆菌显著减少;在目或属水平上,考拉杆菌属、毛螺菌属、韦荣球菌属、丹毒杆菌科、罗氏菌属、梭菌属、反刍菌属和甲基戊糖梭菌显著增加,而其他肠道优势属的相对丰度,如梭菌属、粪杆菌属、消化球菌属和消化链球菌属、乳酸杆菌属和其他厌氧菌显著下降,且放疗后腹泻患者肠道菌群多样性明显下降,厚壁菌门和拟杆菌门明显减少,梭菌门和其他未分类细菌增加[10]。
辐射前肠道微生物的组成对辐射抗性有一定的影响。一方面有队列研究发现,辐射后无症状患者肠道菌群基线的多样性更高[11],大多数无症状患者厚壁菌门和拟杆菌门水平高于辐射后腹泻患者;而部分患者表现为厚壁菌门、变形菌门和放线菌门水平低于辐射后发生腹泻者[10],且发现辐射后发生腹泻的患者在辐射前粪球菌出现明显富集[12]。另一方面放射后肠道菌群不同的构成与生存预后存在相关性,在小型猪中,存活者拟杆菌门显著较高,疣微菌门显著较低;在猕猴中,存活者最初携带较高的厚壁菌门和变形菌门,而较低的拟杆菌门和螺旋体门[9]。同样,有临床研究发现生存期较短患者的粪便样本显著富含卟啉单胞菌属、单胞菌和小杆菌属,而长期存活者的粪便样本显著富含志贺菌和肠杆菌[13]。此外在对辐射前后肠道菌群差异影响因素进一步的研究中发现,不同性别及昼夜节律的不同导致辐射后小鼠肠道菌群的差异,产生不同的辐射抗性。在关于辛伐他汀与高脂饮食对小鼠辐射抗性的研究中发现,口服辛伐他汀可改善雄性小鼠辐射诱导的造血损伤和胃肠道功能障碍,但对雌性动物的这些辐射综合征有不利影响。与此形成鲜明对比的是,高脂饮食喂养动物会导致明显相反的结果。辐射后高脂饮食饲养的雄性小鼠在物种水平上具有更高丰度的格氏乳杆菌和肠乳杆菌,而口服辛伐他汀雌性小鼠在物种水平上携带更高丰度的霍乱弧菌和毛螺菌[14]。另一个关于昼夜节律辐射小鼠的研究中提示,与保持在12h黑暗/12h光照正常周期下的小鼠相比,饲养在异常光照周期中的小鼠观察到的肠道细菌种类减少,肠道细菌组成发生变化,从而导致宿主辐射抗性降低[15]。
肠道黏膜屏障包括:(1)机械屏障:主要由肠上皮细胞及细胞间紧密连接组成,可阻止细菌及内毒素等物质通过肠黏膜进入血液;(2)化学屏障:主要由肠上皮细胞及杯状细胞分泌的黏蛋白和肠道正常寄生菌产生的抑菌物质构成;(3)免疫屏障:由肠道相关淋巴组织(包括肠道淋巴细胞、潘氏细胞、肠系膜淋巴结等)和肠道内浆细胞分泌型免疫球蛋白(SIgA)构成,可刺激肠道黏液分泌,加速粘连层黏液流动,从而防止细菌黏附;(4)生物屏障:即肠道内共生的微生物,是维持肠道微生物平衡的重要组成(图1)。
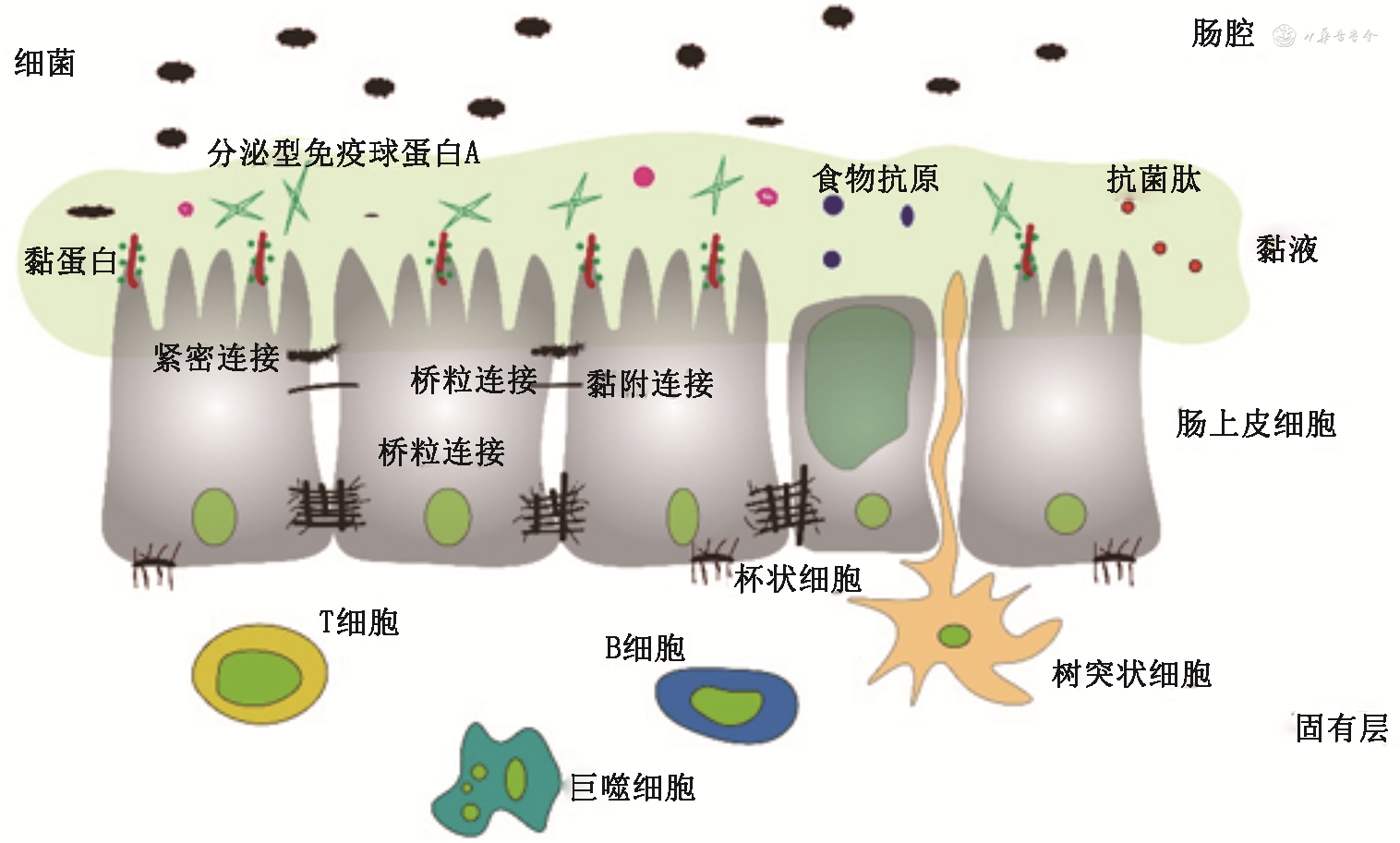

肠上皮是中间层,物质的转运主要受连接复合体的调节,连接复合体是由紧密连接(tight junction,TJ)、黏附连接、桥粒和缝隙连接组成的一组蛋白质。肠上皮内衬的黏液主要由杯状细胞分泌的高度糖基化蛋白组成,包括黏蛋白2(mucin 2,MUC2)。MUC2的糖基化保护蛋白免受宿主和细菌蛋白酶的降解,并促进与水的相互作用以形成黏液凝胶。小肠中含有大量的潘氏细胞,当细菌刺激时,潘氏细胞将其抗菌分子(包括α-防御素)释放到肠腔中,以限制细菌的积累[16]。在上皮层外,固有层提供基于先天性和获得性免疫细胞的防御,这些细胞可分泌IgA、细胞因子、趋化因子和肥大细胞蛋白酶以及由肠道神经系统介导的内分泌,发挥肠道免疫功能和推进肠道运动。因此肠道黏膜屏障在连接肠道微生物区系和黏膜免疫系统之间发挥着核心作用,肠道黏膜屏障的破坏可能使共生菌或病原菌移位,导致肠黏膜的炎症和效应性免疫细胞的激活,从而引起机体的反应。
与传统的先天免疫细胞相似,肠上皮细胞表达模式识别受体(pattern recognition receptors,PRRS)可检测常见的微生物配体,几乎所有促进上皮屏障功能的机制都受到微生物群的影响。肠道共生菌在一定条件下可与Toll样受体(Toll-like receptor,TLR)相互作用,激活核因子κB(nuclear factor kappa-B,NF-κB)信号通路引起免疫反应,同时TLRs充当病原体识别受体(pathogen recognition receptors,PRR),识别微生物相关分子模式(microbe-associated molecular pattern,MAMP),这是微生物特有的,TLRs的激活诱导了几个细胞内信号级联反应,从而导致细胞因子、趋化因子以及控制感染相关基因的转录。TLRs信号传导中的核心作用是由衔接分子髓样分化因子(myeloiddifferentiationfactor88,MyD88)、MAL蛋白(Myelin and Lymphocyte Protein,MAL)、β干扰素TIR结构域衔接蛋白(TIR-domain-containing adaptor inducing interferon-β,TRIF)和肿瘤坏死因子受体相关因子(tumor necrosis factor receptor-associated factors,TRAF)介导,且MyD88被TLR3以外的所有TLR识别。有研究表明肠道共生菌通过与TLR5、TLR9结合激活NF-κB信号传导来预防或减轻小鼠放射后的消化道症状,并通过缺乏经典NF-κB激活激酶IKK的小鼠,验证了NF-κB在体内被辐射的肠上皮细胞中发出抗凋亡反应的信号,且在另一个小鼠研究中进一步表明电离辐射以剂量和时间依赖性方式诱导肠上皮细胞中的NF-κB活化,选择性地保护小肠隐窝的肠上皮细胞免受电离辐射引起的损伤。同时通过用氢水灌胃可提高全腹部照射小鼠的存活率和体重,微阵列分析显示,氢水的施用增加了小肠组织中靶向MyD88的miR-1968-5p的水平[17]。
共生菌将复杂的膳食成分分解为乙酸、丁酸和丙酸为主的短链脂肪酸(short chain fatty acids,SCFAs)、色氨酸等代谢产物,它们是机体的能量来源,但它们也影响上皮和免疫宿主细胞功能。例如短链脂肪酸(SCFAs)可以通过调节杯状细胞中黏蛋白基因的转录来增加黏液层的产生,作为TJ屏障的外源性调节因子。色氨酸衍生的微生物代谢产物,可以增加杯状细胞相关基因MUC2的表达,并激活肠细胞芳烃受体(aryl hydrocarbon receptor,AHR)靶基因Cyp1a1的表达,诱导黏膜免疫的激活,促进IL-22产生ILC3先天性淋巴细胞(innate lymphoid cells,ILC3),诱导抗菌肽和黏液产生,抑制肠上皮干细胞的凋亡,增强肠黏膜的完整性[18]。另外尿石素A(urolithin A,UroA)为多酚类肠道微生物代谢物,通过激活芳香烃受体(aryl hydrocarbon receptor,AhR)-核因子红系相关因子2(nuclear factor erythroid 2-related factor 2,NRF2)依赖的途径来上调上皮紧密连接蛋白,从而发挥其屏障功能[19]。在关于肠道代谢物在辐射损伤机制中的研究发现,UroA可以提高辐射小鼠的存活率,且其作用与小鼠肠道微生物谱变化有关[20]。短链脂肪酸戊酸对辐射小鼠具有保护作用,角蛋白1(keratin 1,KRT1)在其中起重要作用[21]。丁酸盐可以减轻辐射损伤,增加小肠中完整肠绒毛和杯状细胞的数量[22]。吲哚-3-丙酸(indole-3-propionic acid,IPA)防止辐射相关胃肠道综合征的同时,保留了受辐射攻击小鼠的肠道细菌结构和小肠蛋白谱[23]。此外,通过研究在高剂量辐射中存活小鼠粪便的非靶向代谢组发现两种色氨酸途径代谢物,1H-吲哚-3-甲醛(indole-3-carboxaldehyde,I3A)和犬尿酸(kynurenic acid,KYNA),在小鼠体内提供长期辐射防护作用[24]。由于共生菌与肠道黏膜屏障免疫功能的密切关系,肠道菌群及其代谢物在辐射损伤和辐射抗性中作用机制有待进一步的研究。
无论是放疗患者肠道菌群基线,还是放疗后肠道菌群构成的改变均与患者放疗后是否发生放射性肠炎存在一定的相关性。以肠道微生态作为靶点预防和治疗放射性肠炎近年来已相继有文献报道。
大鼠实验表明预防性给予普氏粪杆菌可减少辐射引起的结肠上皮组织学损伤,防止辐射引起的结肠上皮屏障功能破坏,保护隐窝上皮祖细胞/干细胞池和分化的上皮簇细胞免受结肠直肠照射,维持暴露于辐射的结肠上皮的自我更新并减少黏膜溃疡[25]。辐射后的大鼠给予嗜酸乳杆菌治疗可减轻大鼠肠黏膜厚度和绒毛高度的显著降低[26]。但也有小鼠实验否定了益生菌对辐射小鼠的治疗作用,尽管辐射前给予乳杆菌可降低小肠上皮细胞凋亡,使隐窝细胞存活率增加,但在辐射后给药上述保护作用均不存在[27]。临床已有多个研究表明益生菌、益生元及合生元对于放疗引起的放射性肠炎的预防和治疗作用[28]。服用双菌株双联益生菌(嗜酸乳杆菌LAC-361和长双歧杆菌BB536)后,可降低盆腔手术后放疗患者放射性肠炎引起的2、3、4级腹泻[29];另一项对38例妇科癌症术后放疗患者的随机、双盲、安慰剂对照试验[30]显示与安慰剂组相比,益生元组的水样大便天数较少。同时在前列腺癌放射治疗期间,含有罗伊乳杆菌和可溶性纤维的合生元可减轻直肠炎腹泻症状并改善放射诱发的急性直肠炎患者的生活质量[31]。
以肠道菌群为靶点的另一项治疗措施为粪菌移植(fecal microbiota transplantation,FMT),也被称为肠微生态移植。FMT提高了给予致死辐射剂量小鼠的存活率,且当供者和受者的性别匹配时,FMT的效果最好,同时FMT改变了小鼠肠道菌群的结构,并恢复了胃肠道功能和上皮的完整性[32]。临床上关于粪菌移植治疗放射性肠炎的病例报道也相继出现(表1)。第1例关于FMT治疗难治性放射性肠炎的病例是2018年1例宫颈癌行放疗后导致放射性肠炎患者,经亲属供体FMT后症状得到显著缓解[33]。此后陆续报道了因直肠癌放疗后导致慢性放射性直肠炎的患者,经FMT后症状明显缓解,且16SrRNA测序提示FMT后在门水平上厚壁菌门/拟杆菌门的比例上升,上调变形菌门、厚壁菌门、梭菌门、疣微菌门(verrucomicrobia),下调拟杆菌门,属水平上调了拟杆菌属、副杆菌属、另枝菌属、颤螺菌属;下调普氏菌属、罗氏菌属、粪杆菌属[34]。多供体多疗程治疗放射性直肠炎患者后,患者便血、腹痛、腹泻症状缓解,且FMT后患者肠道细菌构成发生明显改变,与3名供者混合粪便菌群相似[35]。一项对5例女性放射性肠炎患者进行了FMT治疗的研究中,3例患者放射性肠炎的症状达到短期缓解,且FMT后肠道菌群发生明显改变[36]。一个以FMT为治疗组,康复新液为对照组的临床随机对照试验显示,FMT后黏膜损伤程度低于康复新液组[37]。无论是益生菌、益生元还是FMT,均证明了以肠道菌群为靶点治疗放射性肠炎的有效性,但其作用机制尚不是很明确,有待进一步研究。
粪菌移植治疗放射性肠炎
粪菌移植治疗放射性肠炎
| 作者 | 发表时间 | 研究类型 | 研究对象 | 粪菌移植方案 | 疗效 |
|---|---|---|---|---|---|
| 刘亭等[33] | 2018年 | 个案报道 | 放射性肠炎(乙状结肠) | 亲属供体 鼻肠管;每次200 ml,1次/2 d,共7次 | 腹痛腹胀明显缓解/镜下黏膜明显好转 |
| 王灿等[34] | 2020年 | 个案报道 | 放射性直肠炎 | 异体移植;第1天FMT通过肠镜灌注120 ml肠道菌群制剂至回盲部和升结肠部,第 3、5、14、21、28天用120 ml肠菌制剂进行灌肠 | 治疗5个月后,患者基本无腹痛症状,偶有腹部不适,经休息或排便后可缓解,排便每日 2~3 次,成形软便较前增多 |
| Zheng等[35] | 2020年 | 个案报道 | 放射性直肠炎 | 多供体移植;4个单独的FMT疗程,分别于3、4、5和7个月完成;1个疗程的方案为200 ml/治疗/供体,每天1次,持续3 d | 随访6个月后,便血、腹痛、腹泻均得到缓解 |
| Ding等[36] | 2020年 | 系列病例 | 放射性肠炎 | 通过鼻空肠经内窥镜肠内导管(TET)输送总计约150 ml的混悬液(包括约50 cm3富集的粪便微生物群),最大处理次数为3次 | 5例女性,中位基线RTOG/EORTC 等级为2。3例患者对FMT有反应,腹泻、直肠出血、腹/直肠疼痛和大便失禁有所改善,KPS 评分也有所下降 |
| 刘金金等[37] | 2021年 | 病例对照研究 | 放射性肠炎 | 治疗组:粪菌移植;对照组:康复新液 | 治疗组治疗总有效率高于对照组;治疗组治疗7 d后黏膜损伤程度低于对照组 |
注:FMT为粪菌移植;RTOG/EORTC为晚期放射损伤分级标准;KPS评分为功能状态评分
无论是动物实验还是临床研究均表明,辐射引起肠道菌群构成的改变。辐射后不同的肠道菌群表现出不同的临床症状,且宿主不同的肠道菌群基线表现出了不同的抗辐射性。但现有研究对于这种辐射后肠道菌群变化的描述主要集中在门、属水平,菌种、菌株水平的研究很少,未能明确对辐射起到保护作用或有害作用的菌群。菌群的改变与辐射存在时间依赖性、剂量依赖性,已在小鼠实验中被证实,但临床上还需要进一步验证。同样需要进一步研究的还包括肠道菌群之间的相互作用、不同种类代谢产物的相互作用以及诱发肠黏膜屏障免疫反应的具有途径等。临床上以肠道菌群为靶点的放射性肠炎相关治疗中,不同的益生菌种类和不同的给药时间,对疗效的影响并不清楚,且FMT治疗放射性肠炎多为病例报道,还需要大量的随机对照研究进一步证明其有效性。
希望随着研究的不断深入,能够发现与放射性肠炎发生发展密切相关的肠道菌群特征及其作用机制,加以针对性的干预,降低放射性肠炎的发生率,改善放射性肠炎患者的症状,在治疗患者肿瘤的同时提高其生活质量。
王琳, 潘飞, 彭丽华. 肠道微生态在放射性肠炎防治中的研究进展[J]. 中华内科杂志, 2023, 62(2): 206-211. DOI: 10.3760/cma.j.cn112138-20220721-00535.
所有作者声明无利益冲突
1. 急性放射性肠炎的发病时间段是指()
A. 放疗后1周内
B. 放疗后1个月内
C. 放疗后立即或3个月内
D. 放疗后6个月内
2. 肠道黏膜屏障不包括()
A. 机械屏障
B. 生物屏障
C. 免疫屏障
D. 肠上皮屏障
3. 以下哪种治疗方式不是以肠道微生态为靶点治疗放射性肠炎()
A. 益生菌
B. 谷氨酰胺
C. 益生元
D. 粪菌移植
4. 辐射对肠道菌群的改变特征包括()
A. 拟杆菌门/厚壁菌门比例下降
B. 存在时间依赖性
C. 存在剂量依赖性
D. 以上均有
5. 目前的研究已提示下列哪种肠道菌群代谢物对辐射小鼠有保护作用()
A. 戊酸
B. 甲酸
C. 乙酸
D. 丙酸



























