
光学相干断层扫描(optical coherence tomography, OCT)技术是近年来迅速发展起来的一种新的光学诊断技术。它是一种应用近红外光干涉成像,通过使用干涉仪接收并记录不同深度生物组织成分的反射光,经过计算机系统处理得到生物组织断层图像。OCT的分辨率可达10 μm,能够清楚观察到组织内部细微结构,因其结果与病理检查高度一致,在医学界被称为"光学活检"。1991年,麻省理工学院Fujimoto教授的工作小组首次在Science杂志上报道了OCT成像系统的基本原理以及在视网膜和动脉内的应用[1]。1996年,Brezinski教授[2]第一次进行了动物血管的体外OCT成像研究。直到2001年第一台用于人体冠状动脉血管内成像的时域OCT (time domain OCT, TD-OCT)面世,并由哈佛医学院麻省总院的Jang教授首次将其应用于人体冠状动脉的检测[3]。近十年来,OCT技术先后经历了多次更新和升级。从开始的需要球囊阻断技术的M2、M3成像系统到成像质量更高,成像速度更快,不需要球囊阻断血流的频域OCT (frequency domain OCT, FD-OCT)成像系统,这使得OCT技术无论在心血管研究领域还是在临床应用方面都取得了进一步的发展。最近发布的新一代ILUMIENTM OPTISTM系统在保证高分辨率、高清成像质量的前提下,将成像速度进一步提高到180帧/s,单次扫描的血管段长度可达75 mm,同时整合了基于导丝的血流储备分数(fractional flow reserve, FFR)功能,兼备形态学和功能学评估功能,使OCT的应用指征进一步拓展并在冠心病介入诊疗领域应用迅速推广。
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
光学相干断层扫描(optical coherence tomography, OCT)技术是近年来迅速发展起来的一种新的光学诊断技术。它是一种应用近红外光干涉成像,通过使用干涉仪接收并记录不同深度生物组织成分的反射光,经过计算机系统处理得到生物组织断层图像。OCT的分辨率可达10 μm,能够清楚观察到组织内部细微结构,因其结果与病理检查高度一致,在医学界被称为"光学活检"。1991年,麻省理工学院Fujimoto教授的工作小组首次在Science杂志上报道了OCT成像系统的基本原理以及在视网膜和动脉内的应用[1]。1996年,Brezinski教授[2]第一次进行了动物血管的体外OCT成像研究。直到2001年第一台用于人体冠状动脉血管内成像的时域OCT (time domain OCT, TD-OCT)面世,并由哈佛医学院麻省总院的Jang教授首次将其应用于人体冠状动脉的检测[3]。近十年来,OCT技术先后经历了多次更新和升级。从开始的需要球囊阻断技术的M2、M3成像系统到成像质量更高,成像速度更快,不需要球囊阻断血流的频域OCT (frequency domain OCT, FD-OCT)成像系统,这使得OCT技术无论在心血管研究领域还是在临床应用方面都取得了进一步的发展。最近发布的新一代ILUMIENTM OPTISTM系统在保证高分辨率、高清成像质量的前提下,将成像速度进一步提高到180帧/s,单次扫描的血管段长度可达75 mm,同时整合了基于导丝的血流储备分数(fractional flow reserve, FFR)功能,兼备形态学和功能学评估功能,使OCT的应用指征进一步拓展并在冠心病介入诊疗领域应用迅速推广。
OCT检查在以下情况应该慎用:(1)患有严重的左心功能不全或者存在血流动力学障碍;(2)单支开放冠状动脉;(3)严重的肾功能不全;(4)对造影剂过敏;(5)靶血管具有广泛的侧支循环或者与导引导管同轴的开口部病变,在后二种情况下,可造成血液清除不完全从而影响图像质量。
OCT的成像操作流程与血管内超声(intravascular ultrasound, IVUS)几乎相似,但OCT需要选择具有一定黏滞度的介质(造影剂或右旋糖酐等)冲洗并清除冠状动脉内的血液。充分清除冠状动脉内残留的血液对获取高质量的OCT图像至关重要。故建议操作者需保证指引导管与靶血管的同轴性,且在保证无压力嵌顿情况下可适当深插指引导管。对于靶血管狭窄严重或者完全闭塞的情况,为了能够最大限度地清除管腔内血液,推荐先恢复靶血管的前向血流再进行OCT检查。
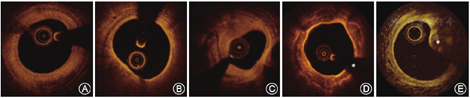
经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)术前进行OCT检查可准确识别靶血管管腔内的信息以及血管壁上的斑块分布和组织特征。介入术者可根据OCT术前提供的冠状动脉管腔信息调整PCI的策略,包括病变预处理方法、支架尺寸的大小、支架释放的位点以及支架术后相关并发症的处理等。例如靶病变部位有大量脂质沉积或血栓的形成,是术中发生慢血流或无复流以及围手术期心肌梗死的预测因素。如果靶病变部位出现严重钙化,操作者应考虑使用辅助设备,如旋磨、震波球囊、切割或棘突球囊(图1)。靶病变严重的钙化会影响冠状动脉狭窄的有效扩张,从而对PCI过程产生不利影响,并且与支架膨胀不良发生率较高有关[4]。

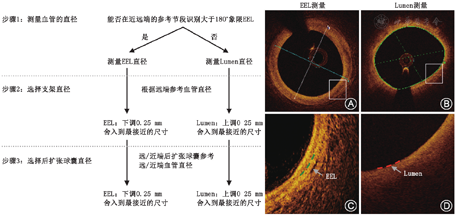
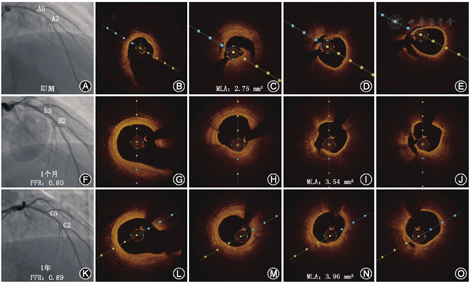
OCT可为我们提供病变长度与管腔直径的精确测量结果,根据测量的结果来选择合适的支架尺寸可明显优化PCI的过程。研究表明,选择适当尺寸的支架和充分的后扩张对患者的远期效果十分重要,术后即刻支架膨胀不良是药物洗脱支架置入后早期支架血栓形成和再狭窄的一项重要的预测因素[4,5]。目前在OCT指导支架置入实践中多推荐应用ILUMIEN Ⅲ研究中基于远端参考外弹力膜(external elastic lamina,EEL)的方式选择支架直径,而此结果显示使用OCT、IVUS与血管造影指导选择的支架直径没有差异(图2)。即当血管直径可通过EEL参考段测量值确定时,可利用平均的EEL直径选择支架尺寸,即平均EEL直径减少0.25 mm至最接近的可选择的支架尺寸。当血管斑块负荷较重导致无法测量EEL时,可利用平均管腔直径确定支架的尺寸,即平均管腔直径增加0.25 mm至最近可选择的支架尺寸。然而,在某些特殊病变(如长病变、慢性闭塞病变的远端血管或包含心肌桥部位)中,排除血管负性重构(negative remodeling)对准确评估血管直径和确保所选支架直径合适,同时又不增加引起血管破裂的风险非常重要。

支架边缘着陆区的组织特性可能会影响支架长度的选择,故术者应该将支架着陆区定位于正常或至少病变较少的参考段(EEL可以清晰识别的角度>180 °)。选择合适的支架置入部位至关重要,支架未完全覆盖病变被认为是支架失败(支架内血栓形成或再狭窄)和主要不良心血管事件(major adverse cardiovascular events,MACE)的预测因子之一,这印证了选择合适的支架长度的重要性[6,7,8]。故推荐支架着陆区应避开斑块负荷大于50%以及富含脂质组织的区域。
冠状动脉分叉病变占所有PCI治疗的15%~20%,由于分叉病变的介入治疗往往包括复杂的步骤和较高的急性并发症发生率,故分叉病变的处理仍面临着诸多挑战,其中以左主干分叉病变的介入治疗最受关注。为了进一步规范左主干分叉病变介入治疗,提高我国左主干分叉病变介入治疗的整体水平,2022年中华医学会心血管病学分会组织相关专家撰写了《中国冠状动脉左主干分叉病变介入治疗指南》,而此指南中明确指出对于左主干分叉病变,推荐使用OCT优化介入治疗(Ⅱa, B)[9]。常规冠状动脉造影在评估病变方面存在显著局限性,OCT可对分叉病变进行详尽评估并提供重要的信息,包括斑块分布、分支的开口、分叉角度和分叉嵴形状。分叉处的动脉粥样硬化的分布受血管剪切力的影响,其斑块主要分布于低剪切力区域,OCT研究证实薄帽纤维脂质斑块(thin cap fibroatheroma,TCFA)主要位于分叉嵴对侧区域,而分叉嵴很少受到影响[10]。脂质积累倾向于在与分支对侧的区域中发生发展,在IVUS虚拟组织学和OCT对分叉进行的多模态评估中发现,分支开口的近端边缘更可能包含薄纤维帽和大的坏死核心的斑块[11,12,13]。PCI术前对分叉部位行OCT评估可以预测主血管支架置入后的分支并发症的发生。术前分叉的角度可通过从主支血管的OCT回撤影像中进行测量,在主支回拉的OCT的长轴视图中,测量的嵴尖端角度作为嵴的角度。目前已经证明,根据OCT测量的分叉角度与CT测量的分叉角度具有良好的一致性[14]。Watanabe等[15]进行的OCT研究表明,主支支架置入后,分叉嵴尖端角度小于50 °,分支嵴尖端长度小于1.70 mm是分支出现相关并发症(狭窄加重、血流受限或闭塞等)的独立预测因素。
此外,OCT可对分叉结构进行三维重建(图3),充分展示主支和分支血管形态结构,特别是分支的开口,而且更容易识别介入后的分支开口解剖学变化,如在冠状动脉的OCT的三维视图中,可以清楚地显示在主支内置入支架后,嵴部向分支侧移动,从而在分支开口处形成狭窄。虽然临床实践中OCT可以为介入医师提供很多有价值的信息,但其在相关指南中对于分叉病变的证据级别仍然不高,是因为当前可获得的临床数据主要基于对少数患者的观察性研究,尚无前瞻性临床数据可证实OCT指导分叉病变的临床益处。

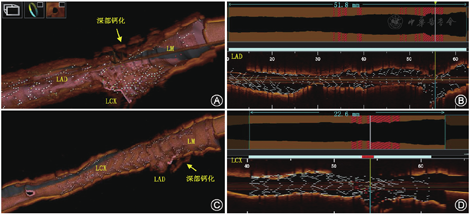
钙化病变经常见于动脉粥样硬化性疾病发展过程中,即使在药物洗脱支架时代,冠状动脉狭窄伴钙化病变的治疗仍然具有挑战性,冠状动脉钙化的严重程度与支架的即刻膨胀效果、支架贴壁不良和器械输送的失败直接相关[16,17,18,19]。2021年发布的《冠状动脉钙化病变诊治中国专家共识》中较为详尽地描述了钙化病变的发病、影像学诊断方法和基于腔内影像学的处理策略[20]。OCT可以通过提供更准确的钙化斑块定义和定量测量来克服IVUS对钙化成像的许多缺陷。在OCT成像中,钙化斑块表现为信号衰减区域,钙化区域的边缘清晰锐利。与IVUS不同,IVUS成像中钙化经常与致密的纤维组织相混淆,而OCT检测到的钙化与脂质或坏死核心相混淆。然而,钙化的信号衰减区域边界清晰,而脂质或坏死核心的信号衰减区域则边界不清晰或弥散。不同于IVUS,OCT对钙化斑块的穿透能力大于其他组织类型,故其对钙化斑块负荷方面评估似乎比IVUS更准确,因为它在钙化环范围之上还提供了其他可测量的参数。Fujino等[21]研究表明,OCT对钙化病变进行分析测量后,可根据OCT测量的结果包括最大角度>180 °、最大厚度>500 μm和长度>5 mm对钙化的严重程度进行积分,较高的积分与支架膨胀不良直接相关。另一项研究表明,与IVUS相比,OCT指导钙化病变的介入治疗中会选择更大的旋磨头,而这与术后获取良好的支架膨胀直接相关[22]。
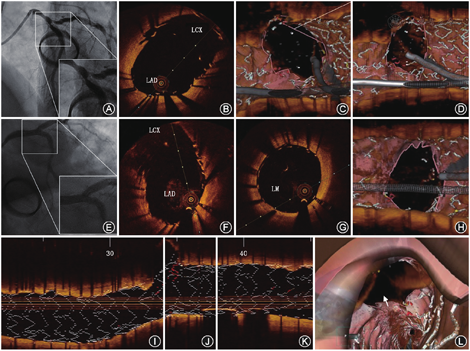
OCT指导的钙化病变的准备工作通常需要完成2个步骤:(1)在支架置入前获得精确而详细的钙化特征和斑块在整个血管的分布;(2)通过OCT对钙化斑块的识别选择合适的方法对其进行斑块修饰和准备。在钙化病变的PCI中,充分的病变预处理对于保证支架置入过程以及置入效果至关重要。对于严重的环形表浅钙化,冠状动脉内旋磨术、切割球囊、棘突球囊以及震波球囊可以达到良好的预处理效果(图4)。多数专家认为对于较大弧度并且纤维帽较厚的钙化(钙化角度>180 °),棘突球囊比普通球囊能够获得更好的预处理效果;对于弥漫的浅表环形钙化(钙化角度>270 ° )、结节样钙化旋磨术更为合适。

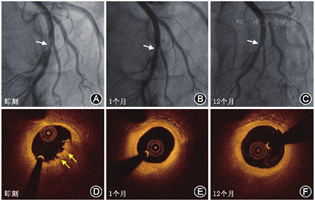
在急性冠状动脉综合征(acute coronary syndrome,ACS)患者中,OCT最大的优势在于可识别罪犯病变节段斑块的性质,进而改变部分患者术中的介入策略。OCT可精确识别ACS患者罪犯病变导致的急性血栓性事件的发生机制,尤其在识别斑块破裂、斑块侵蚀、钙化结节或残留的血栓等方面优于IVUS[23]。Jia等[24]利用OCT首次在体识别ACS发病机制,包括斑块破裂、斑块侵蚀和钙化结节,并分别提出相关的OCT定义和诊断标准,3种常见的斑块形态发生的概率与既往病理尸检研究基本一致。斑块破裂一直以来被认为是导致ACS的罪魁祸首,但是近年来随着OCT在ACS患者中的广泛应用,研究者发现斑块侵蚀的比例约占全部ACS患者的1/3。在临床实践过程中,发现ACS患者斑块侵蚀的介入治疗策略可能与常规急诊PCI置入支架有所不同。在Prati等[25]的一项回顾性研究中,斑块侵蚀且管腔残余狭窄小于50%的患者未置入支架,并且在2年随访期间也无额外血运重建事件的发生。前瞻性EROSION研究表明,在OCT发现的由于斑块侵蚀发生ACS的患者中,单独的抗栓治疗是可行的,可以减少不必要的支架置入[26]。而且随后的EROSION研究的1年和4年的随访结果证实,绝大多数由斑块侵蚀引起的ACS患者在没有支架的情况下接受了抗栓治疗是安全有效的,无MACE发生(图5)[27,28]。此研究提出"介入无置入"的再灌注治疗理念,引领了国际ACS介入治疗策略的转变,同时也写入了国际腔内影像学应用专家共识[29]。另外,在ACS临床治疗过程中,在EROSION研究的基础上,笔者团队发现部分ACS患者在血栓抽吸后的OCT结果提示为斑块破裂,但其残余的管腔面积足够大,经过严格的抗栓治疗后也可以避免或者延缓支架的置入(图6)。此项研究目前正在进行中,在不远的将来其研究结果也会公布于众,可能会进一步改变ACS的治疗策略和理念。


另外,如在原位冠状动脉的急性ST段抬高型心肌梗死(ST-segment elevation myocardial infarction, STEMI)介入治疗中,不推荐常规应用远端保护装置,但是如果OCT发现富含大量血栓或者为脂质的斑块,选择性地使用远端保护装置可以防止无复流或者围手术期心肌梗死的发生[30,31]。在ACS患者的罪犯病变的OCT分析表明,薄纤维帽的易损斑块容易发生破裂,且脂质斑块负荷大的位置破裂更容易导致ACS血栓性事件的发生,此研究也为ACS的防治提供了有力的依据[32]。
高分辨率OCT在支架置入后可辅助判断支架即刻效果,比较理想的优化支架置入效果是支架贴壁、膨胀良好,且不伴有支架边缘夹层、组织脱垂或支架内血栓的发生。腔内影像学检查可以发现更高比例的支架置入后并发症,如支架边缘夹层、组织脱垂、支架内血栓等。而OCT对识别支架贴壁不良、组织脱垂和支架边缘夹层的敏感度较IVUS更具有优势。
支架膨胀率是指最小支架横截面积的绝对数值与平均参考面积的比值(参考面积可以是近端、远端、最大或者平均参考面积),即支架膨胀率=最小支架面积(minimal stent area,MSA)/平均参考血管面积× 100%。支架长度通常被分为2个等长节段(近端和远端),分叉病变除外(目测估计分支≥ 2.5 mm)。当出现分叉时,并非将支架分成两半,而是基于近端最近分支的中点进行分割。结合既往的IVUS研究,目前较为公认的PCI术后支架扩张效果判断标准可分为3种:第一,支架膨胀良好,即近端支架段的MSA不小于近端参考管腔面积的90%和/或远端支架段的MSA不小于远端参考管腔面积的90%;第二,可接受的支架膨胀,即近端支架段的MSA不小于近端参考管腔面积的80%和/或远端支架段的MSA不小于远端参考管腔面积的80%;第三,支架膨胀不良,即近端支架段的MSA小于近端参考管腔面积的80%和/或远端支架段的MSA小于远端参考管腔面积的80%。原则上,支架的膨胀率越高,支架术后长期通畅性和临床结果更好,支架失败风险更低。在DOCTORS研究中,基于PCI术后冠状动脉FFR>0.90对应的支架膨胀率> 79.4%[33]。基于上述研究及临床实践,MSA值> 80%(相对于两端参考血管面积)是合理判定支架膨胀是否良好的界值。
支架贴壁不良指支架小梁与血管壁(管腔边界/斑块表面)明显分离。支架贴壁不良可能发生在术后即刻,也可能在术后随访期间出现;后者很可能是血管壁的炎症反应和正性重构所致。支架贴壁不良可进一步分为2种:(1)重度,与不可接受的支架膨胀不良有关;(2)轻度,与可接受的支架膨胀不良有关。尽管目前不同类型支架贴壁不良与临床事件的相关性和可能的预后尚不明确,但大样本的支架内血栓相关研究结果与体外研究结果一致,都表明应避免支架置入后的严重支架贴壁不良,并且在血管解剖可行的情况下应尽量予以纠正。如果PCI术后OCT提示重度贴壁不良则应该根据OCT测量的血管直径实施进一步支架扩张。
在冠状动脉介入临床实践中,支架置入术后以支架边缘夹层和组织脱垂最为常见。OCT因为分辨率较高,发现这些支架相关并发症的能力优于IVUS。在ILUMIEN Ⅲ研究中,比较OCT和IVUS指导下PCI治疗效果,研究结果显示,OCT发现的支架边缘夹层发生率至少是IVUS的3倍[34]。CLI-OPCI Ⅱ研究结果表明,支架术后OCT检查存在>200 μm的支架远端边缘夹层是MACE的独立预测因子[35]。然而,较小的支架边缘夹层可能与支架术后的远期不良事件无关[36]。边缘夹层可分为:(1)重度,夹层累及角度占该部位血管围度≥60°且长度≥3 mm;(2)轻度,可见边缘夹层的血管围度< 60°且长度<3 mm。如果术后OCT提示重度边缘夹层,则建议再次置入一枚支架以覆盖夹层的支架段,尤其是夹层部位位于远端支架边缘时。如果术后OCT提示轻度边缘夹层,则可于术后严密观察症状和体征,部分患者可以不需要支架置入。
组织脱垂通常定义为支架小梁间的组织突入管腔,包括斑块脱垂和ACS中的血栓脱垂。既往的OCT研究显示组织脱垂是早期支架内血栓形成的独立预测因子,并且与PCI术后短期预后不良相关[37,38,39]。多项临床研究表明,ACS患者PCI术中不规则脱垂更为常见,而且此类脱垂更易导致临床事件,是术后1年不良临床事件的独立预测因子[12]。如果支架内组织脱垂或血栓在支架小梁的管腔边缘内脱垂至少0.2 mm,则可进一步分类为重度脱垂-血栓和轻度脱垂-血栓。重度脱垂判断标准为组织脱垂处的面积/支架面积≥10%,且最小支架内血流面积(MSA-脱垂面积)小于各近端或远端参考面积的90%;轻度脱垂判断标准为组织突起处的脱垂面积/支架面积<10%或者≥10%但是最小支架内血流面积不小于各近端或远端参考面积的90%。如果PCI术中通过OCT检查发现支架内有组织脱垂,而且该脱垂符合严重脱垂标准,则建议考虑进行血栓抽吸、进一步高压球囊扩张或置入支架等处理。
近年来随着科学技术的不断进步,新一代的OCT整合了多种智能分析软件系统,从而为介入术者在术前、术中和术后提供更为简捷、高效、全面的评估信息。新型的软件系统主要包括造影融合功能(angio co-registration, ACR),自动智能分析支架的膨胀与贴壁功能,以及三维重建功能。上述新型功能不仅可为术者提供实时高清且精准的成像效果,而且可自动计算分析支架膨胀和贴壁情况,从而实现智能量化评估的治疗效果,提高患者的即刻手术结果和远期获益。
ACR即OCT影像与血管造影同步融合技术,开创性地将OCT与冠状动脉造影进行自动匹配,使两者之间可实时精确地实现点对点对应关系,即实时同步成像,使得PCI由"粗测"进入到"精准"时代。ACR可使OCT图像能够准确对应血管造影图中的相应位置,进而为术者提供病变定位、支架精准释放等非常有价值的信息。在目标血管段置入支架时可通过与血管造影显示的位置进行匹配确认,以提高支架置入位置的准确性(图7)。这项技术可以简化影像学指导的支架置入过程,同时降低支架置入位点与预期理想位点不匹配的发生率。ACR的应用优势主要包括:(1)术中减少了辐射的剂量,其可在一次造影过程中收集到目标血管的所有信息;(2)在一定程度上缩短了OCT学习曲线并减少了评估OCT位置所需时间;(3)通过对造影和OCT信息的同步分析,可减少支架置入期间发生的地理丢失,进一步增强精准性。故在临床介入过程中,如果使用的OCT具备此项功能,则推荐在ACR指导下施行支架置入术。
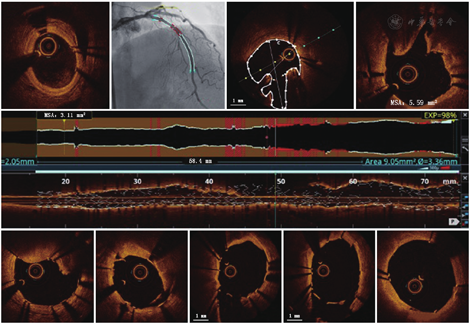

支架置入后,支架小梁自动检测软件能够评估支架贴壁是否良好(图7)。图示长轴中的白线部分表示此节段支架贴壁良好,如果长轴中出现有红线的部位则提示此节段贴壁不良。另外,其还可以通过软件的智能分析评估支架的膨胀不良。OCT图像中长轴显示支架贴壁不良或膨胀不良的位置可利用ACR的功能与冠状动脉造影图像一一对应,可指导术者更加精准地对贴壁不良或膨胀不良的区域进行优化处理。
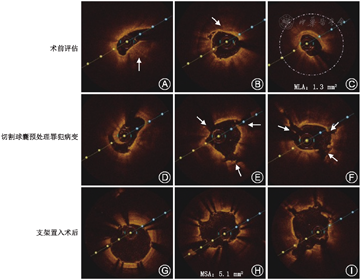
OCT的三维重建(3 dimensions-optical coherence tomography,3D-OCT)于2008年首次被提出,凭借其技术优势在临床上得到广泛应用,尤其在分叉病变的PCI过程中发挥了很好作用[40]。通过使用3D-OCT,介入医师可以较为容易地识别扫描段血管的整体结构、斑块的分布位置与形态、支架小梁与血管壁之间的关系、分叉病变中分支开口的位置与形态,以及导丝再次通过主支支架网眼的位置(近端或者远端)(图8)[41]。研究表明,根据3D-OCT分析实时确认分支导丝的具体位置并进行相应调整,可显著减少分叉病变支架贴壁不良的发生率[42].

随着OCT成像技术的不断进步和临床应用越来越广泛,其在冠状动脉介入治疗中的证据也越来越充分,而且指南推荐的级别也在稳步提升。2011年,美国心脏病学会(American College of Cardiology,ACC)/美国心脏协会(American Heart Association,AHA)冠状动脉介入指南对IVUS在PCI中应用的推荐等级为Ⅱa,而对OCT的推荐等级因循证医学证据不足尚未确立。2012年CLI-OPCI研究表明,与单纯造影指导的PCI治疗相比,OCT指导下的PCI治疗可显著改善患者的预后[43]。随后,在2013年欧洲心脏病学会关于稳定型冠心病管理指南中,OCT对于评估病变特征及优化支架置入均被列为Ⅱb类推荐(证据水平为B),总体证据水平等同于IVUS. 2015年发表的ILUMEIN Ⅰ研究表明PCI术前和/或术后行OCT检查可影响术者的介入治疗策略达57%以上[44]。同时,ILUMEIN Ⅱ研究结果表明OCT在指导支架膨胀方面不劣于IVUS[45]。2016年经导管心血管介入治疗(Transcatheter Cardiovascular Therapeuties,TCT)学术会议上发布的ILUMEIN Ⅲ试验比较了OCT、IVUS以及造影指导的三组冠状动脉支架置入的预后,结果表明,OCT指导支架置入的策略不劣于IVUS指导下的支架置入,OCT指导的PCI严重夹层与支架贴壁不良的发生率较低。基于多个注册研究、随机对照临床试验和荟萃分析,OCT已被证实其可明显改善即刻介入效果以及长期临床预后。2018年欧洲心脏病学会(European Society of Cardiology, ESC)/欧洲心胸外科协会(European Association for Cardio-Thoracic Surgery, EACTS)心肌血运重建指南中指出对于合适的部分患者(如非ST段抬高型ACS患者),OCT或IVUS指导的PCI优化治疗级别为Ⅱa类推荐(证据水平为B),对于OCT用于支架内再狭窄相关机制的判断及指导治疗也是Ⅱa类推荐(证据水平为C)[46]。ILUMEIN Ⅳ是正在进行的一项前瞻性、多中心、随机对照研究,比较OCT和造影指导复杂冠状动脉PCI术后2组MACE的发生率,此项结果的公布有可能进一步改变OCT指导冠状动脉介入手术的证据级别[47]。
OCT在临床冠状动脉介入治疗过程中既可以评估动脉粥样硬化斑块组成和稳定性、优化介入治疗的过程,又可评估介入治疗的长期有效性和安全性。目前,冠心病的诊断和介入治疗的理想情况是根据患者临床与病变情况的差异制定个体化的最优策略。随着OCT成像器械和技术的不断研发创新及进展、临床研究证据越来越充足以及介入医师利用OCT指导PCI理念日益深入,OCT在未来冠状动脉介入诊疗的过程中应用场景会越来越多,最终使冠心病患者获益。
陈涛,于波.如何利用光学相干断层扫描技术优化冠状动脉介入治疗[J/OL].中华心血管病杂志(网络版),2022,6: e1000137(2023-01-30). http://www.cvjc.org.cn/index.php/Column /columncon/article_id/315. DOI:10.3760/cma.j.cn116031.2022.1000137.


























