
输尿管支架在输尿管狭窄治疗中起着重要的作用,它能够支撑狭窄尿道和保证尿液通畅,从而缓解狭窄对肾功能的影响。传统的输尿管支架留置于体内时易产生结石、细菌感染、炎症和再次狭窄等并发症。系统综述了输尿管支架的性能要求,介绍了不同结构与功能和不同材料的输尿管支架及其制备加工技术,分析了输尿管支架的关键问题和未来研究方向,为理想输尿管支架的研究提供参考依据。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
输尿管狭窄是指由各种病因而引起输尿管部分或全段梗阻,从而引起不同程度的上尿路梗阻和肾积水,进而损害肾功能或导致肾衰竭[1]。目前治疗输尿管狭窄的方法主要有成形术、扩张术、内切术等外科手段。成形术是治疗输尿管狭窄的主要方法,长期治疗效果较好,但手术难度高,创伤大[2]。输尿管扩张术术式简单,术后恢复快,但效果不确切,只能暂时缓解梗阻,无法从根本上解决问题,治疗成功率较低[3]。输尿管镜内切开法适用范围广,在治疗输尿管末端狭窄、非缺血性狭窄和短段狭窄时可以取得较好的效果,但是对于狭窄程度较严重的患者来说有一定的局限性[4]。所以目前针对输尿管狭窄尚缺乏一种较为理想的治疗方法。输尿管支架可以有效地治疗狭窄,能在病变部位起到支撑和引流作用,成为治疗输尿管狭窄不可缺少的手段之一,也有越来越多的学者致力于输尿管支架的研究以此满足临床的需求,但目前仍没有一种理想的输尿管支架[5]。因此,本文对输尿管支架的性能要求、种类、加工技术及其关键问题和未来发展方向的研究进展进行系统综述。
输尿管支架在体内主要起支撑和引流作用,其力学性能非常重要,输尿管的力学性能主要有拉伸性能、抗压性能、弯曲柔韧性和弹性回复等方面。输尿管支架在人体内起支撑作用,因此抗压性能尤为重要。弹性也是衡量输尿管支架力学性能的一个重要参数,一定的弹性回复可以避免输尿管支架在被压缩时完全闭合,保证了引流作用。因此要确保输尿管支架具有较好的力学性能[6,7]。
生物性能包括生物耐久性、生物可降解性和生物相容性。生物耐久性是指输尿管支架置入人体后,随着时间的推移,支架能否持续发挥作用[8]。生物可降解性能是可降解支架的一个重要性能,支架的生物可降解性能主要与支架的材料以及支架所处的环境有关。输尿管支架必须具有良好的生物相容性,不会引起自身免疫排斥反应,对机体无毒。
可视性是指输尿管支架在显影设备下具有一定的显影效果,输尿管支架置入时或者置入后需要X射线明确[9]。市面上使用金属材料制成的输尿管支架具有较好的可视性,其他材料的可视性依然较差。
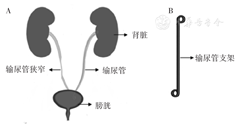
随着科技的进步,不同材料、结构和功能的输尿管支架不断涌现。近年来,科学家和临床医生一直致力于寻找输尿管支架的最佳材料。人体泌尿系统和常见的输尿管支架如图1所示,输尿管支架一般是由聚合物或金属材料制成的柔性管组成,支架的两端为"J"形(也称为猪尾末端),可以将支架固定在肾盂和膀胱中,从而防止支架移位[10]。不同输尿管支架及其材料特点见表1。

不同输尿管支架及其材料特点
不同输尿管支架及其材料特点
| 支架类型 | 材料 | 优缺点 | 参考文献 |
|---|---|---|---|
| 可降解人工合成支架 | 聚乙交酯、聚己内酯、聚乳酸等可降解人工合成材料 | 优点:具有良好的生物相容性和生物可降解性 | [6,11] |
| 缺点:降解时产生的二氧化碳可能会聚集炎症细胞 | |||
| 不可降解人工合成支架 | 硅胶、聚氨酯等不可降解材料 | 优点:制备工艺简单,软韧性好,成本低 | [12,13,14] |
| 缺点:不可降解,易滋生细菌,出现尿盐沉积现象 | |||
| 裸金属支架 | 镍钛合金、钴、铬、钼等金属材料 | 优点:具有优异的支撑性能 | [15,16,17] |
| 缺点:易产生结壳 | |||
| 覆膜金属支架 | 镍钛合金、聚四氟乙烯等 | 优点:具有金属和覆膜的双重优势,既可以提供良好的力学支撑,又可以防止息肉向内生长 | [18] |
| 缺点:生物相容性差,支架管易结垢 | |||
| 药物洗脱支架 | 镍钛合金、药物等 | 优点:可以持续释放药物,并能够达到特定功能化治疗的效果 | [19,20] |
| 缺点:药物搭载量少 | |||
| 组织工程支架 | 小肠黏膜下层、膀胱无细胞基质、丝素蛋白、胶原蛋白、海藻酸钠等天然生物材料 | 优点:可以保持组织本身的三维结构,炎症细胞大大减少 | [21,22,23] |
| 缺点:种子细胞培养过程繁琐且困难 |

在输尿管支架研究中常用的人工合成高分子材料主要有聚乳酸(polylactic acid,PLA)、聚乙交酯(polyglycollide,PGA)、聚乳酸-羟基乙酸共聚物[poly(lactic-co-glycolic acid,PLGA]、聚己内酯(polycaprolactone,PCL)等[24,25]。这些人工合成高分子材料在生物医用方面有着广泛的应用,由于其具有良好的生物相容性和生物可降解性,且降解产物无毒,易于排出体外,而被广泛应用到输尿管支架、神经组织修复和伤口敷料等方面的研究中[26,27,28]。如图2A的UripreneTM支架是由乙交酯、ε-己内酯、三亚甲基碳酸酯所制备而来的可降解输尿管支架[29]。Zhang等[30]成功研制了一种甲氧基聚乙二醇(methoxy polyethylene glycol,mPEG)-PCL/聚乳酸己内酯[poly(lactic-co-caprolactone),PLACL]输尿管支架,该支架具有优异的抗结垢作用,将该支架置入大鼠膀胱,支架的炎症评分和沉积量均低于疏水性的输尿管支架。由人工合成高分子可降解材料制成的输尿管支架,既可以起到力学支撑的作用,又可以在一定时间内降解,降解产物对人体无害,避免了二次取出,大大减轻了患者的痛苦,因此深受研究者的喜爱,但目前可降解输尿管支架尚无临床应用,还需要解决好可控降解性能和力学稳定性能之间的平衡关系。
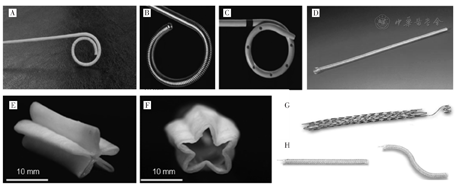

A—UripreneTM可降解支架;B—Resonance®金属支架;C—传统"J"输尿管支架;D—Memokath 051热膨胀形状记忆支架;E~F—天然生物材料(胶原)可降解支架;G—Allium覆膜支架;H—Uventa覆膜支架
硅胶是输尿管支架的第1代材料,其置入体内后无毒,制备工艺简单,但由于硬度较低,因此不能提供良好的支撑力[31]。Cormio等[13]研究发现,由硅胶制成的输尿管支架引起的尿路上皮损伤较轻,但会造成严重的尿盐沉积。因此,硅胶并不是较理想的输尿管支架材料。
聚氨酯也是输尿管支架中常用的材料,该材料制成的输尿管支架具有毒性小、成本低等特点,由于其较好的力学性能,置入人体后不易发生滑移和断裂,但其表面容易导致细菌和蛋白质黏附,易结壳,不宜长久置入[32]。近年来,已有研究者研制出改性聚氨酯,可以减少表面结壳和表面细菌的黏附,以提高聚氨酯支架的置入时间。
常用的金属输尿管支架材料有硅镍合金、镍钛材料等,由金属材料制备的输尿管支架具有优异的力学性能,可以提供良好的力学支撑,但金属支架的留置容易引起尿盐沉积,出现结壳现象,且难以取出。由镍钴铬钼合金制成的紧密盘绕的金属丝组成的Resonance®支架如图2B所示,它的近端和远端弯曲,与传统的"double-J"支架(图2C)相似,但其末端闭塞[33]。Miyazaki等[34]研究置入Resonance®金属输尿管支架治疗恶性梗阻的效果,对患者进行了1年的长期随访,该支架治疗成功率为70.3%,并未出现严重的并发症,表明该支架可以安全有效地治疗恶性梗阻。另一种Memokath 051(图2D)是由镍钛合金组成的热膨胀形状记忆支架,其紧密的螺旋结构可防止尿路上皮细胞生长[35]。
自然界中存在着众多的天然生物材料,如丝素蛋白、胶原蛋白、海藻酸钠等。它们均具有良好的生物相容性,近年来被应用于构建输尿管支架的研究中。如图2E、2F所示,Versteegden等[36]制备的星形管状胶原支架具有形状恢复效应,支架的径向扩张和收缩性能优异,富有径向弹性。Klekiel等[37]制备了一种基于海藻酸钠的可吸收尿道支架,用于治疗尿道狭窄,体内研究证实该支架具有良好的抗压性能,且可以有效地在尿道内扩张,排尿通畅。丝素蛋白是一种具有良好力学性能和生物相容性的新型生物材料。加工后的丝素蛋白可制成各种材料,如管、膜、凝胶、支架、纤维和微球等。Liu等[38]采用静电纺丝和湿法处理制备了一种含基质细胞衍生因子-1α排列的丝素蛋白/三维多孔膀胱无细胞基质移植物复合支架,该支架能够促进尿道黏膜、平滑肌和微血管系统的再生,使细胞增殖,减少胶原沉积,可用于尿道再生和修复。通过将不同的天然生物材料混合来制备输尿管支架可避免一种材料带来的弊端,这不失为提高输尿管支架性能的方法。
覆膜支架是指由金属支架和覆膜组成的双层架构输尿管支架。覆膜支架既具有金属支架良好的力学支撑性能,可以保证尿液引流,减少尿路刺激,其覆膜又可以防止细菌黏附和感染以及防止息肉增生而导致支架管内堵塞[39]。目前,覆膜支架已经广泛应用到输尿管狭窄的治疗中,Allium输尿管支架(图2G)是一种新型的自膨胀式覆膜金属支架,该支架由镍钛合金材料制成,再使用聚合物涂层覆膜后得到最终的支架,可用于多种疾病引起的输尿管狭窄[40]。高宇等[39]将覆膜金属支架植入到7例输尿管狭窄的患者中,结果发现6例患者在术后的症状明显改善,并且术后无泌尿系统感染、腰部胀痛、血尿等不适症状,表明该覆膜支架可以安全有效地治疗输尿管狭窄。另外一种Uventa覆膜金属支架(图2H)是3层的网状结构,2层镍钛诺丝网中间夹着1层聚四氟乙烯膜,远端聚四氟乙烯膜埋置的引线有利于支架的拔除[41]。
药物洗脱支架是指在原有支架的基础上,搭载抗狭窄药物,并将药物持续释放到输尿管损伤的部位,达到特殊治疗效果。洗脱生物活性物质的支架配备了一种特殊的涂层系统,用于在支架表面涂层药物。药物洗脱支架主要由支架平台、药物载体和搭载药组成。目前,药物洗脱支架主要有抗菌、抗炎、抗狭窄和抗肿瘤等作用,常用的药物主要有雷帕霉素、紫杉醇、酮洛酸、三氯生等[6,20,43,44]。Kram等[19]在输尿管造口术大鼠模型中将紫杉醇涂层聚氨酯支架置入输尿管内,结果表明该支架对尿路上皮细胞发挥抗增殖作用,可以预防重建手术后引起的狭窄,减少输尿管组织的增生。药物洗脱支架的特殊点在于其载药性,可以实现靶点治疗的效果。传统的药物递送系统存在着许多局限性如药物控制释放不良、缺乏靶向性、水溶性差以及对耐药性的敏感性等[20]。基于纳米粒子的药物递送系统已被广泛用作局部药物控释系统的有效手段,并已广泛应用于生物医学的各个领域[45,46]。目前药物洗脱支架已经成为了生物医用材料研究方向的热点,且在治疗输尿管狭窄等方面有良好的前景。
组织工程支架是指用生物材料所构成的支架,其作为种子细胞的载体,对于输尿管的再生和修复有重要意义。目前组织工程支架材料主要为天然脱细胞基质。天然的脱细胞基质材料不仅保持了组织本身的三维结构,而且还含有多种生长因子,有利于种子细胞的生长和增殖[21]。Wang等[23]将细菌纤维素和膀胱无细胞基质结合起来模拟天然尿道,设计了一种三维仿生尿道支架来促进血管生成和内皮化,该支架通过促进人脐静脉内皮细胞生长、内皮功能相关蛋白的表达和毛细血管的形成来促进血管生成,从而修复和重建尿道。这一项研究为尿道组织工程支架的设计提供了新思路,也充分说明了组织工程支架在尿道或输尿管治疗方面的应用前景。
纺织成型技术是指将材料在模具上纺织成为支架管,该方法又分为机织、针织、非织或编织,纺织成型技术制备方法简单,制得的支架有较好的强度、稳定性,且可以通过调整模具的参数获得不同规格的输尿管支架,如图3A所示[47]。Cui等[7]设计了一种编织型可降解输尿管支架,并对其拉伸性能、径向支撑性能、体外降解、抗弯曲等性能进行了研究,结果表明该支架测试后仍能保持结构稳定,力学性能均符合临床要求,引流性能优异。
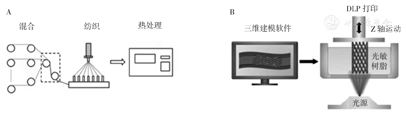

A—输尿管支架的编织过程;B—3D个性化支架的创建
浸涂成型法是指将制备输尿管支架所用材料的溶液,多次浸渍一定直径的芯棒,或将溶液均匀的涂到芯棒表面,达到一定的厚度后,通过干燥将溶液凝固成型,定型后将芯棒取出,得到支架管。该方法操作简单,但是极易造成制备的输尿管支架管壁薄厚不均匀,且有较差的力学性能,无法实现规模化生产。通过选择不同的浸提、涂覆顺序可以改变输尿管支架的特性[6]。
3D打印技术是一种快速成型技术,它以数字模型文件为基础,将所用材料逐层打印来构造一种物体。医学是3D打印的热点领域,3D打印的主要优势是可以精确制作个体组织器官的模型,实现对组织结构的3D直观认识[48],对不同的患者可以实现不同的展示,实现个体化治疗,图3B为从医学扫描中获得的3D模型,用于创建个性化支架[49]。目前3D打印技术已经被应用到心血管疾病的治疗中,刘桂栋和严中亚[50]在对15例患者的术后随访观察到该支架可以避免传统手术的术后出血量大、术后并发症多等问题,证实了利用3D打印技术制造的覆膜支架可以取得较好的治疗效果。目前在输尿管方面的应用还较少,未来随着该技术的不断发展,3D打印技术可以在输尿管支架中得到广泛的应用。
输尿管支架已成为临床中不可缺少的医疗耗材。目前使用的大多数支架都是由金属和合成聚合物制成的,输尿管置入人体后,输尿管支架可能会引起一系列的并发症,如尿失禁、血尿、腰部疼痛等。覆膜输尿管支架有良好的力学支撑、可阻止息肉向内生长等优点,但其成本极高,存在后期难以拔除等缺点。药物洗脱支架可以将药物输送到特定位置,避免了全身给药的问题,但目前的药物洗脱支架释放速率过快,无法达到缓释治疗的效果。组织工程支架是近年来的研究热点,但现在仍处于研究过程中,还未应用到临床中,且其目前存在种子细胞难以获取、增殖能力达不到临床需求,工艺过程过于复杂等问题。
合格的输尿管支架应该具备以下特点[6,51]:良好的力学性能,可以提供一定的支撑;良好的生物相容性,不会引起人体的免疫排斥反应;产生的生物膜较少,减少表面细菌和蛋白质的黏附;置入操作简单,且易于拔除;B超或X光下不透光;价格经济,降低患者的经济负担。但目前仍未有一种输尿管支架可以完全符合上述要求。但随着对输尿管支架的不断研究,研究人员通过对输尿管支架进行功能化改性如表面抗菌涂层、搭载抗菌整理剂等进一步克服其目前存在的问题。Gao等[52,53]制备了一种长期抗菌且可生物降解的输尿管支架,通过在支架纤维表面产生超支化聚酰胺-胺接枝聚多巴胺微粒(约300 nm)来实现,该支架具有快速的灭菌特性和抗生物膜功能,可以减少蛋白质和微生物的吸附,并降低了炎症和坏死细胞的水平。在输尿管支架的内部搭载抗菌剂可以杀死表面的细菌,防止尿路感染等问题[54]。Wu等[55]用编织机制备了一种含黄连素的丝素蛋白抗菌缝合线,该缝合线具有良好的抑菌效果,且细胞毒性小,炎症反应少。未来可以尝试在输尿管支架上涂覆含有黄连素的丝素蛋白膜,来抑制细菌并防止生物膜的形成。总之,对输尿管支架进行涂层,内表面修饰可以减少细菌和特异性蛋白的吸附和生物膜的形成,克服输尿管支架的结垢和阻塞等难题,是未来输尿管支架的趋势之一。
输尿管支架对于现代泌尿科医生来说已经成为一种不可或缺的医疗器械,主要用于肾结石或其他病因引起的梗阻性尿路疾病和急性肾绞痛等。但置入输尿管支架后可能会引起上尿路症状、三角区刺激和疼痛等并发症,从而给患者的经济和生活都带来了负担。输尿管支架的研究方向主要集中在支架材料、支架设计和功能化改性等方面,主要目的是为了减少输尿管膀胱反流、支架移位和组织增生等问题。虽然研究者已经在输尿管支架方面做了诸多研究,但是目前还没有一种理想的支架。输尿管支架研究是涉及多学科交叉融合的前沿研究,需要生物材料、工程技术和医学临床的多学科人才团队协同创新。随着不断涌现的新型输尿管支架材料、药物和制备技术,研究者们将可以解决支架不适、结痂和感染等常见问题,研制出理想的多功能输尿管支架,给广大患者带来福音。
所有作者均声明不存在利益冲突



























