
报道1例椎管内室管膜瘤转移至心脏的病例。患者男,65岁。入院后发现右心房占位性病变,以“黏液瘤”行肿块切除。镜下观察:肿瘤细胞排列呈片状,可见室管膜腔隙,肿瘤细胞立方形或多角形,细胞核卵圆形,胞质丰富嗜酸性。患者3年后再次入院,CT发现全身多处静脉内瘤栓及骨质多发转移。行髂骨穿刺活检见大量血管周围假菊形团。两次标本免疫组织化学均胶质纤维酸性蛋白、S-100蛋白阳性,上皮细胞膜抗原核旁点状阳性,N-MYC基因未见扩增。患者第二次入院穿刺确诊后行化疗1个周期,出院后4个月死亡。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者男,65岁。以双下肢疼痛4年,伴色素沉着1年于2013年11月7日入院。体检:双下肢色素沉着,左下肢为重,左侧内踝处溃烂,皮温及足背动脉搏动均正常。曾于10年前行“椎管内肿瘤切除术”,诊断室管膜瘤。实验室检查:双下肢静脉造影显示双下肢静脉瓣膜关闭不全并交通支开放,浅静脉曲张。心电图显示左心室高电压。心脏超声显示:右心房内异常高回声,大小约41 mm×15 mm,随心脏搏动,可拖入右心室,考虑黏液瘤;动脉瓣、二尖瓣、三尖瓣轻度关闭不全;轻度肺动脉高压;左心室舒张功能下降。头颅磁共振成像(MRI)未见异常强化信号。患者遂行“右心房黏液瘤切除”。术中见:病变位于右心房下腔静脉口处,大小约41 mm×15 mm,半透明状,有蒂与心房壁相连。病理检查:灰红碎组织一堆,大小30 mm×20 mm×10 mm。镜下观察:肿瘤细胞排列呈实性、片状、巢状,可见微囊状结构,局灶可见被覆柱状上皮的室管膜腔隙,并可见少量黏液,肿瘤细胞呈立方形或者多角形,核圆形或卵圆形,染色质细腻,核仁不明显,未见核分裂象,胞质丰富嗜酸性,并可见胞质内空泡(图1,2)。免疫组织化学染色CD56、胶质纤维酸性蛋白(GFAP)弥漫性胞质阳性,S-100蛋白弥漫核质阳性,上皮细胞膜抗原(EMA)核旁点状阳性,Olig2个别细胞核阳性,广谱细胞角蛋白(CKpan)、突触素、癌胚抗原、结蛋白、MyoD1、Myogenin、Calretinin、D2-40均阴性,Ki-67阳性指数约5%(图3~6)。病理诊断:转移性室管膜瘤。患者于2013年12月8日出院,未行放化疗。患者于心脏手术后3年,于2016年10月7日再次以双下肢疼痛入院,CT显示下腔静脉至双侧髂静脉管腔内占位性病变,盆腔及相应肌间隙多发占位性病变,双侧髂骨、骶骨、部分腰椎多发骨质破坏并软组织肿块形成;布-加综合征。头颅MRI未见异常强化信号。行髂骨穿刺送病理检查。
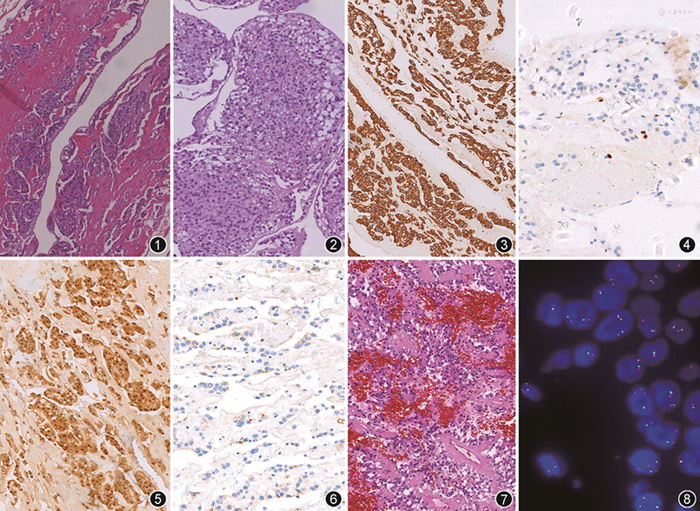

病理检查:送检灰红碎组织一堆,大小15 mm×10 mm×7 mm,镜下可见大量的血管周围假菊形团,肿瘤细胞围绕血管呈放射状排列,血管周围可以见到无核区(图7)。免疫组织化学染色CD56、GFAP弥漫胞质阳性,S-100蛋白弥漫核质阳性,EMA核旁点状阳性,突触素局灶胞质阳性,Olig2个别细胞核阳性,CKpan、细胞角蛋白(CK)7、CK20均阴性,Ki-67阳性指数约2%。
病理诊断:转移性室管膜瘤。
随访:两次标本行N-MYC荧光原位杂交(FISH)检测均未见扩增(图8)。患者行“依托泊苷+卡铂”化疗1个周期。于2016年10月30日出院,出院后4个月死亡。
讨论:室管膜瘤是相对少见的中枢神经系统肿瘤,主要见于儿童,该肿瘤颅外转移罕见,可以通过血道和淋巴道转移到肺、肝和淋巴结等部位[1, 2, 3];也可通过脑室腹腔分流播散至腹腔[4],转移至心脏少见报道。
心脏转移性肿瘤以心包最为常见,其次为心外膜和心肌,而心腔转移性肿瘤最为罕见[5]。心脏转移性肿瘤的症状与累及的心脏部位和肿瘤的大小有关。转移至心包的肿瘤,可导致恶性的心包积液,而转移至心肌的肿瘤,可以出现心律失常、心力衰竭甚至心脏破裂等严重的并发症[6, 7]。转移至心腔的肿瘤可导致流出道梗阻,甚至肺栓塞、心源性休克猝死等[8, 9]。本例患者肿瘤位于右心房,患者首次就诊并无心脏相关的临床表现,这可能是由于肿瘤体积较小,且与右心房粘连紧密,所以未导致明显的流出道梗阻等血流动力学障碍。布-加综合征是肝静脉流出道部分或者完全梗阻导致的一组疾病,可引起门脉高压及下腔静脉高压症状[10]。梗阻的部位可以包括肝静脉、下腔静脉或者右心房。本例患者后期出现下肢静脉阻塞及布-加综合征,可能和肿瘤阻塞下腔静脉,导致下肢静脉回流受阻有关。
由于心脏转移性肿瘤症状的非特异性,诊断需要依赖辅助检查。最常用的心电图及胸部X线难以发现心脏转移性肿瘤。超声心动图具有较高的灵敏度和特异度,可以全面评估肿瘤的大小、位置等[11]。因此对于有恶性肿瘤病史的患者,应常规进行超声心动图检查,避免漏诊。
本例患者心脏手术后,送检肿瘤组织形态缺乏经典的室管膜菊形团,可见室管膜腔隙结构,肿瘤细胞以片巢状为主,局部可见黏液,极易误诊为心脏黏液瘤。需仔细观察切片,寻找室管膜腔隙等证据,正确诊断还需结合患者的病史及免疫组织化学。由于心脏的转移性肿瘤较原发肿瘤多见[11],对于有恶性肿瘤病史的心脏肿瘤患者,要首先排除转移肿瘤。
心脏转移性的室管膜瘤要和以下肿瘤鉴别:(1)心房黏液瘤:心房黏液瘤是心脏最常见的原发肿瘤。大体也呈胶冻样,与室管膜瘤大体表现类似,但是心房黏液瘤多见于左心房,镜下观察肿瘤细胞散在分布于大量的黏液背景中,细胞呈星芒状、圆形或者梭形,缺乏室管膜瘤的特点:假菊形团、室管膜菊形团及室管膜腔隙,免疫组织化学不表达GFAP、EMA、S-100蛋白等标志物[12]。(2)心脏转移癌:转移癌患者多有病史,癌细胞表达多种上皮标志物,而室管膜瘤上皮标志物为阴性。(3)黏液乳头型室管膜瘤:该肿瘤几乎都位于脊柱圆锥、马尾和终丝,可以见到较多的黏液成分,肿瘤细胞梭形或者上皮样,围绕玻璃样变的血管呈放射状排列,但是不见室管膜腔隙及室管膜菊形团,并且表达上皮标志物CKpan[13]。(4)神经鞘瘤:神经鞘瘤可有黏液背景,镜下可见到伴有丰富Verocay小体的Antoni A区及疏松的Antoni B区,免疫组织化学S-100蛋白、SOX10可弥漫阳性,GFAP局灶阳性,但是神经鞘瘤缺乏前面提到的室管膜分化的特点,仔细观察肿瘤的形态不难鉴别。
脊髓室管膜瘤含有多种基因的改变,包括NF2突变、N-MYC扩增等[13]。根据2021年WHO中枢神经系统肿瘤分类[14],伴有N-MYC扩增的脊髓室管膜瘤为一新增亚型,该亚型病程呈侵袭性,快速进展,早期转移,形态上可见较多的乳头及假乳头,血管内皮增生常见[15]。而本例患者两次标本缺乏乳头结构,也未见血管内皮增生,行N-MYC FISH检测,结果均为阴性。这提示该病例可能存在其他导致侵袭性的基因改变,有待进一步研究。
心脏肿瘤患者的治疗方式与肿瘤为原发还是转移、良恶性以及是否造成梗阻等因素有关[16]。本例患者骨转移后行化疗1个周期,出院后4个月死亡。室管膜瘤除了传统的放疗及化疗外,目前有多种针对酪氨酸激酶受体、KIT基因、mTOR及IDH1基因的药物临床试验[17]。对于转移性室管膜瘤,相信未来会有更多新的治疗方法,从而改善患者的预后。
本文报道了1例脊髓室管膜瘤转移至心脏,3年后又转移至骨的病例,该类病例罕见,明确诊断需结合病史,并与多种心脏原发肿瘤鉴别,从而避免误诊。
韩静, 高献争, 许跃, 等. 心脏转移性室管膜瘤1例[J]. 中华病理学杂志, 2023, 52(2): 181-183. DOI: 10.3760/cma.j.cn112151-20220527-00463.
所有作者声明无利益冲突



























