
微小残留病(MRD)已被用于包括急性白血病在内的恶性血液病的复发预警、指导治疗方法选择等方面。文章基于第64届美国血液学会(ASH)年会报道的MRD相关内容,以急性髓系白血病为主要着眼点讨论MRD指导的恶性血液病的个体化治疗进展。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
微小残留病(MRD)已被广泛用于各类恶性血液病的疗效评估、复发预警及指导治疗方法选择等[1,2,3]。2021年,中华医学会血液学分会实验诊断学组和欧洲白血病网络(ELN)MRD工作组分别发布了急性髓系白血病(AML)患者MRD检测和临床解读的专家共识[1,2]。然而恶性血液病MRD研究领域仍存在诸多未解之谜,如AML患者诱导治疗后MRD预后预测价值是否受到不同诱导方案的影响?预后中等患者诱导治疗获得MRD阴性的形态学缓解是否需要接受异基因造血干细胞移植(allo-HSCT)?MRD能否指导多发性骨髓瘤(MM)患者停用药物?2022年第64届美国血液学会(ASH)年会上,国内外学者围绕AML、急性淋巴细胞白血病(ALL)、MM、慢性淋巴细胞白血病(CLL)等恶性血液病患者的MRD相关问题进行了大量报道,ASH继续教育手册中也就AML患者的MRD问题进行了讨论[4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21]。文章主要聚焦于MRD指导的AML患者个体化治疗方面的进展。
第64届ASH年会上,许多学者报道了AML患者MRD检测技术以及MRD指导的AML分层治疗的进展,现总结如下(图1)。
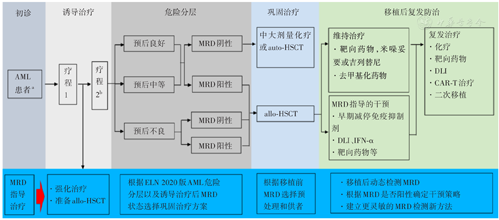

注:MRD为微小残留病;AML为急性髓系白血病;auto-HSCT为自体造血干细胞移植;allo-HSCT为异基因造血干细胞移植;DLI为供者淋巴细胞回输;IFN-α为干扰素α;CAR-T为嵌合抗原受体T细胞;ELN为欧洲白血病网络;;a初诊AML患者应该确定白血病异常免疫表型(LAIP)、融合基因或白血病特异突变等评估MRD的靶点分子;b部分研究认为应该根据巩固治疗后的MRD水平确定是否进行allo-HSCT
目前,多参数流式细胞术(MFC)、二代测序(NGS)、单细胞测序技术等多种方法被用于AML患者的MRD评估,上述方法可检测循环游离DNA(cfDNA)、白血病干细胞(LSC)、基因突变等[1,4,5,6,7,8,9,10]。Hourigan[9]对NGS和MFC检测AML患者MRD后出现的假阴性和假阳性原因进行了解析(表1)。Pasca等[10]发现移植后90 d cfDNA MRD阳性(变异等位基因频率≥0.25%)患者的2年无复发生存(RFS)率(46.2%比84.0%,P<0.001)和总生存(OS)率(53.8%比87.2%,P=0.001 3)显著低于cfDNA MRD阴性患者。

AML患者不同检测方法导致MRD结果差异的潜在原因
AML患者不同检测方法导致MRD结果差异的潜在原因
| MRD结果 | 差异存在的原因 |
|---|---|
| MFC结果真阳性、NGS结果假阴性 | 无合适的突变用于MRD检测 |
| 检测的靶基因中不包含有预后意义的基因:核结合因子白血病患者无KIT突变或其他RTK突变;复杂核型AML无TP53突变;染色体非整倍体或结构变异 | |
| NGS灵敏度不够或缺乏可靠的MRD靶基因 | |
| NGS结果真阳性、MFC结果假阴性 | 无合适的MFC检测靶分子(无LAIP或D-F-N特异性不足) |
| MRD检测方法之间的互补性 | |
| 白血病细胞抗原表达异质性或飘移 | |
| NGS结果假阳性、MFC结果真阴性 | NGS方法存在技术缺陷 |
| NGS靶基因选择不当(孤立的DNMT3A突变) | |
| 胚系突变或不能导致白血病复发的突变存在 | |
| MFC结果假阳性、NGS结果真阴性 | 化疗或异基因造血干细胞移植后骨髓再生造血细胞抗原表达不同于健康人骨髓造血细胞表达的抗原 |
注:AML为急性髓系白血病;MRD为微小残留病;MFC为多参数流式细胞术;NGS为二代测序;LAIP为白血病异常免疫表型;D-F-N为正常骨髓细胞表型相鉴别
美国约翰霍普金斯大学和MD安德森癌症中心研究均显示,诱导治疗后获得MRD阴性是预测AML患者复发的重要指标,其预测价值不受去甲基化药物(HMA)/维奈克拉或强烈化疗等治疗方式的影响[11,12]。另一项来自美国和波兰的多中心回顾性研究入组了302例接受allo-HSCT的成年AML患者,中位年龄为44岁(18~68岁);22%患者按照2010年ELN共识被划分为中危-Ⅱ或高危。Czyz等[13]发现移植前MFC检测的MRD阳性率为47%(143/302);中位随访30个月(1~97个月)后,MRD阳性组患者的无白血病生存(LFS)率(54%比69%,P=0.007)和OS率(62%比77%,P=0.013)均显著低于MRD阴性组患者;多因素分析显示,移植前MRD阳性(HR=1.53,P=0.033 2)、ELN预后分层为中危-Ⅱ或高危(HR=1.87,P=0.003 1)以及患者年龄≥45岁(HR=1.65,P=0.011)是LFS的独立影响因素;具有0、1、2和3个危险因素患者的3年LFS率分别为75%、68%、51%和27%(P<0.000 1),3年OS率分别为81%、77%、57%和44%(P=0.000 6)。该研究提示移植前MFC检测MRD水平≥0.1%是独立于ELN预后分层和患者年龄的预后不良因素。
2016年,加拿大学者Ng等[14]基于AML患者LSC表达的17个基因(GPR56、AKR1C3、CD34、NGFRAP1、EMP1、SMIM24、SOCS2、CPXM1、CDK6、KIAA0125、DPYSL3、MMRN1、LAPTM4B、ARHGAP22、NYNRIN、ZBTB46和DNMT3B)建立了一个积分系统(LSC17),可很好预测初诊AML患者的预后。第64届ASH年会上,Ng等[15]报道的一项研究入组190例AML患者,LSC17中位值为0.51(0~1.25),其中高LSC17和低LSC17组分别为84例和106例;按照2022版ELN关于AML诊治的共识,将190例患者分为预后良好(44例)、预后中等(53例)和预后不良(93例)组,结果显示三组患者的LSC积分分别为0.24(0~0.8)、0.48(0.04~1.13)和0.73(0.14~1.25)(P<0.001)。诱导治疗后74%(141/190)的患者MRD阳性,多因素分析显示ELN预后分层(OR=5.56,P=0.02)和高LSC17(OR=3.98,P=0.007)是诱导治疗后MRD阳性的独立影响因素。以上研究不仅提示LSC17(≥0.51)是诱导治疗后MRD阳性的高危因素,而且提示可根据LSC17调整AML患者的诱导治疗策略[14,15]。
目前,国内外学者尚未就预后良好和预后中等组患者的allo-HSCT适应证选择达成共识。第64届ASH年会上,我国王建祥教授团队对3个临床试验的769例AML患者进行了回顾性分析[16],中位年龄为38岁(14~60岁),按照ELN共识将患者分为预后良好(427例)、预后中等(230例)和预后不良(112例)组。用MFC检测到MRD即定义为MRD阳性。与MRD阴性患者相比,第1个疗程(C1)或第2个疗程(C2)后MRD阳性患者较MRD阴性患者具有高3年累计复发(CIR)率(44.6%比28.3%,P<0.001;53.5%比31.0%,P<0.001)和低RFS率(47.0%比66.9%,P<0.001;41.0%比63.0%,P<0.001)、低OS率(52.5%比78.6%,P<0.001;48.0%比75.6%,P<0.001)[16]。
亚组分析显示,预后良好、预后中等和预后不良组C1后MRD阳性患者的3年CIR率均高于阴性患者(34.5%比23.1%,P=0.077;47.2%比36.0%,P=0.009;62.6%比37.1%,P=0.026),导致低3年OS率(71.0%比85.8%,P=0.007;47.8%比72.9%,P<0.001;21.2%比55.5%,P=0.002)。无论是预后良好组还是预后中等组患者,C2后MRD阳性患者的3年CIR率均高于阴性患者(预后良好:40.7%比25.2%,P=0.019;预后中等:61.5%比35.2%,P<0.001),导致OS率显著降低(预后良好:57.6%比84.0%,P<0.001;预后中等:44.2%比70.7%,P<0.001)[16]。
所有患者中223例在CR1接受了allo-HSCT,其中预后良好、预后中等、预后不良组患者分别为89例(39.9%)、81例(36.3%)和53例(23.8%),结果发现allo-HSCT可使预后良好组C2后MRD阳性患者生存获益(HR=0.383,P=0.004);移植既可使预后中等组C1后MRD阳性患者获益(HR=0.529,P=0.008),还可以使C2后MRD阳性患者获益(HR=0.467,P=0.004);对于C1或C2后MRD阴性的预后良好或预后中等组患者而言,allo-HSCT并未使其生存获益。对于预后不良组患者而言,无论MRD阳性还是阴性均获益于allo-HSCT。该研究提示早期评估AML患者MRD可作为预测预后的重要生物学标志物,预后良好组患者C2时间点MRD阳性,预后中等组患者C1或C2时间点MRD阳性均为allo-HSCT移植的适应证[16]。
总之,诱导治疗或巩固治疗后MRD阳性的AML患者或MRD转阴后再转阳的患者预后差,应给予allo-HSCT等治疗[16,17]。英国伯明翰大学的Craddock[18]认为,对于诱导治疗后获得CR1的AML患者,临床医生需要考虑如下问题以便决定患者是否进入移植程序:如果患者仅接受强烈化疗巩固后,白血病复发是多少?allo-HSCT后患者的非复发相关死亡(NRM)率是多少?如果患者接受强烈化疗后的复发率高于40%~45%,那么这些患者就应该接受allo-HSCT治疗。此外,还应该考虑移植后的NRM问题,尤其是对于老年患者,既要考虑共患病指数,又需考虑到老年患者的护理等问题(表2)。因此,Craddock[8]推荐除预后良好C2后MRD阴性的AML患者外,预后良好C2后MRD阳性、预后中等或预后不良后无论MRD阴性还是阳性的AML患者,都是allo-HSCT的适应证;只不过强烈化疗AML C2后MRD阴性患者接受移植时,造血细胞移植合并疾病指数(HCT-CI)应该<2。

不同预后分层的急性髓系白血病患者诱导治疗后获得完全缓解应该进行allo-HSCT的条件
不同预后分层的急性髓系白血病患者诱导治疗后获得完全缓解应该进行allo-HSCT的条件
| 预后分层 | 诱导治疗2个疗程后MRD | 巩固治疗后预计复发率(%) | 考虑移植时能耐受的最高NRM积分 | ||
|---|---|---|---|---|---|
| 强烈化疗 | allo-HSCT | HCT-CI积分 | 2年NRM率(%) | ||
| 预后良好 | 阴性 | 30~40 | 15~20 | 不建议进行移植 | - |
| 阳性 | 70~80 | 30~40 | ≤3~4 | <35 | |
| 预后中等 | 阴性 | 50~60 | 25~30 | ≤2 | <20 |
| 阳性 | 70~80 | 30~35 | ≤3~4 | <35 | |
| 预后不良 | 阴性/阳性 | >90 | 40 | ≤3~4 | <35 |
注:allo-HSCT为异基因造血干细胞移植;MRD为微小残留病;HCT-CI为造血细胞移植合并疾病指数;NRM为非复发相关死亡;-为无此项
多数研究表明,移植前MRD阳性是allo-HSCT后高复发率的独立影响因素,由此移植前将阳性的MRD通过强烈化疗等手段转阴后再进行allo-HSCT能否改善患者的预后?在一项比较CPX-351和DA(柔红霉素+阿糖胞苷)方案作为老年继发性AML患者诱导治疗的随机、对照临床试验中,Lancet等[19]发现CPX-351组较DA组诱导治疗后接受allo-HSCT患者更能显示出生存优势。Stone等[20]在另一项随机对照临床试验中发现,对于初诊伴FLT3-ITD突变的AML患者,接受DA+米哚妥林较单用DA方案诱导治疗后进行allo-HSCT的生存获益更明显。尽管这两项研究都没有评估MRD水平,而且尚不明确试验组接受移植患者的生存获益是归因于低移植相关死亡(TRM),还是归因于低CIR,但这些研究支持应该开展前瞻性、随机对照临床试验来证实更多疗程或增大诱导治疗强度是否能使MRD阳性患者阴转而改善移植预后。
在未获得更高水平的循证证据之前,Craddock[18]认为移植医生尝试采取策略使移植前MRD阳性患者转阴时,需考虑如下问题:由于预后中等组和预后不良组AML的疾病生物学特性尚不清晰,这些患者移植前MRD阳性对预后影响的程度亟待阐明;部分患者可能会由于化疗不良反应或多疗程化疗增加TRM而不能获益于移植带来的生存优势;移植前增加化疗疗程可能加速克隆演化,导致TP53等基因的突变,进而增加移植后白血病复发。
综合会议摘要和继续教育材料,现将第64届ASH年会上关于降低移植后AML患者复发率、提高生存率的策略总结如下[18,19,20,21]。
AML患者移植后免疫抑制剂强度与复发密切相关;临床上移植医生应密切监测环孢素A(CSA)的浓度,使CSA浓度处于最佳水平,以达到既可控制移植物抗宿主病(GVHD),又不影响抗白血病作用、避免移植后MRD形成最终导致疾病复发的目的。
对于接受移植的AML CR1患者,尚未确定的CSA或他克莫司等免疫抑制剂开始减量的最佳时间点,CSA等减量时需要考虑如下问题:(1)复发的风险;(2)供者干细胞来源,如外周血干细胞移植后CSA用药时间需长于单纯采取骨髓干细胞作为移植物的患者;(3)供受者人类白细胞抗原(HLA)不合程度;(4)GVHD预防方案,移植前是否应用抗胸腺细胞球蛋白(ATG)或阿仑单抗;(5)是否发生GVHD?(6)移植后是否早期出现MRD阳性?Craddock[18]认为,如果高危AML患者接受ATG或阿仑单抗为基础的GVHD预防方案后未发生GVHD,+60 d前就应该考虑减少CSA或他克莫司的用量;特别是移植后60 d内出现MRD阳性的患者更应尽快减少免疫抑制剂用量。因此亟待开展前瞻性、随机对照临床试验以探讨高危AML患者移植后CSA或其他免疫抑制剂开始减量的最佳时间点。
对于有FLT3-ITD突变的患者,移植后可给予索拉菲尼或米哚妥林或吉列替尼维持治疗。综合本届ASH年会的报道,我们认为维持治疗需要考虑如下问题:哪些患者需要接受维持治疗;患者对维持用药的耐受程度;开始维持治疗的最佳时间点;维持治疗的最佳疗程;维持治疗期间如何评估MRD;可否根据MRD调整维持治疗药物或疗程。
国内外研究提示,AML患者移植后MRD指导DLI抢先治疗可以降低复发率、改善预后。此外,DLI还可用于高危AML患者移植后复发的预防或治疗;临床给予患者预防性DLI时要考虑如下问题:T细胞的混合嵌合情况;患者是否发生GVHD。目前,尚鲜见预防性DLI在AML患者移植后应用的随机、对照临床试验报道。
另外,接受预防性DLI的患者应密切监测MRD,一旦MRD转阳即可进行抢先治疗,包括DLI、干扰素、靶向药物等。临床前研究显示四价双特异性CD123/CD16抗体可以介导表达CD16A的自然杀伤(NK)细胞靶向杀伤CD123+的AML细胞或LSC,该药物的临床试验结果值得期待。对于预防或干预无效发生血液学复发的患者,应该给予相应的治疗。
除AML以外,第64届ASH年会上针对MRD在ALL、MM等恶性血液病个体化治疗中的应用也有多项研究报道,我们对部分研究成果进行了总结。
欧洲学者开展的成年人ALL研究组(GRAALL)2014临床试验入组743例成年ALL患者,该研究的目的是探讨年龄指导的化疗强度选择以及MRD(诱导治疗后MRD>10-3或巩固治疗后MRD>10-4)指导的移植适应证选择能否改善预后。Boissel等[22]发现与GRAALL 2005临床试验组(787例)相比,GRAALL 2014组患者诱导治疗死亡率显著降低(3%比6%,P=0.005),诱导死亡率的差异主要体现在44~59岁年龄组的患者(3%比11%,P=0.001)。借助3个月时间点的Landmark分析,Boissel等[22]发现GRAALL 2014临床试验组的211例依据CR1后MRD阳性接受allo-HSCT的患者,其RFS时间显著延长(HR=0.46,P=0.004)。该研究提示MRD驱动的移植治疗显著改善了诱导或巩固治疗(也称为治疗早期)后MRD反应不佳ALL患者的临床预后。
MRD在MM患者预后评估和指导治疗选择方面的价值已经得到国内外学者公认[23]。第64届ASH年会上,一项来自美国的前瞻性、多中心研究入组了72例MM患者,研究者旨在探讨MRD指导的停药可行性。该研究中的MRD评估方法包括PET-CT、MFC[最低检出限(LOD)为1×10-5]或NGS(LOD为1×10-6)。MRD阴性患者停止治疗后的3年内,每3个月用外周血标本评估1次MRD,每年评估1次骨髓MRD以及PET-CT。截至2022年7月13日,38例患者停用药物,中位随访14个月后,4例失访,2例疾病进展,2例退出临床试验且退出临床试验前MRD均为阴性。5例(13%)MRD复发,其中2例M蛋白阳性,疾病进展。停药后1年MRD持续阴性率为84%(21/25)。尽管仍需进行更长时间的随访,但是该研究提示MRD指导的MM患者停药的可行性,使MM患者看到了疾病被治愈的曙光[24]。
第64届ASH年会上关于MRD在恶性血液病诊疗中应用的报道还很多[25,26,27],由于篇幅所限,不再一一叙述。综上所述,技术进步将使恶性血液病患者MRD检测的灵敏度和特异度不断提升,假阳性和假阴性率降低。此外,双特异性抗体及异基因白血病来源的树突细胞疫苗在MRD清除方面的进展将使临床医生拥有更多对抗白血病细胞的手段。预计未来5~10年内随着恶性血液病MRD生物学特性的逐步阐明,MRD制导(类似于雷达预警)和清除MRD方法(类似于拦截导弹)的有机结合,将进一步提升恶性血液病的分层治疗水平,改善临床预后,造福更多患者。
所有作者均声明不存在利益冲突



























