
足细胞内陷性肾小球病(podocyte infolding glomerulopathy,PIG)是近年提出的一种足细胞独立病理类型的肾小球病,特征是电镜下观察到足细胞相关的超微结构如微球、微管折叠进入肾小球基底膜(glomerular basement membrane,GBM)。目前国内外关于此病的报道尚不多见,且多集中在日本。PIG的临床特点、发病机制尚不明确。本文报道了1例临床表现为肾病综合征患者,肾活检提示为PIG,经糖皮质激素、羟氯喹联合他克莫司治疗后患者临床症状缓解,尿蛋白减少。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者,女,54岁,汉族,因“发现眼睑及双下肢水肿1周余”于2021年5月12日入院。患者1周前无明显诱因出现眼睑及双下肢水肿,伴有腹部胀痛。患者自诉少量泡沫尿数年,平素尿量不多,具体不详,双侧脸颊有光过敏反应,无关节疼痛,无腰酸乏力,无恶心呕吐,无呕血便血。至当地医院就诊,查白蛋白25.7 g/L,尿常规示尿蛋白3+,24 h尿蛋白量1.43 g。腹部CT示:结肠管壁明显增厚、水肿,周围脂肪间隙模糊;腹盆腔积液;肝右叶点状钙化灶;左肾结石,轻度积水。当地医院考虑“肾病综合征”,予以禁食、灌肠、补充蛋白等对症治疗。现患者为进一步诊治收住入科。患者2020年9月6日因“粘连性肠梗阻”全麻下行“腹腔镜探查+腹腔粘连+腹腔冲洗引流术”,否认高血压、糖尿病、心脏病等慢性疾病史,否认肝炎、结核等传染病史,否认其他重大手术外伤输血史,否认药物、食物过敏史。体格检查:血压131/68 mmHg,贫血貌,双侧眼睑轻度水肿,双下肢轻度水肿。实验室检查:血常规:白细胞计数2.01×109/L,红细胞计数3.71×1012/L,血小板计数162×109/L,淋巴细胞计数0.57×109/L,中性粒细胞计数1.14×109/L,血红蛋白95 g/L。尿常规:尿隐血1+,尿蛋白3+,尿红细胞59.79个/μl,尿胆红素阴性,尿胆原阴性。尿蛋白/尿肌酐13.374 g/g,24 h尿蛋白量10.14 g。肝功能:总蛋白46.9 g/L,白蛋白22.4 g/L,谷丙转氨酶70.3 U/L,谷草转氨酶128.4 U/L,总胆红素4.30 μmol/L,直接胆红素1.4 μmol/L,间接胆红素2.9 μmol/L。肾功能:尿素5.6 mmol/L,血肌酐62.2 μmol/L。血脂:三酰甘油2.53 mmol/L,高密度脂蛋白胆固醇0.55 mmol/L。电解质分析:钾3.33 mmol/L,钙1.87 mmol/L。超敏C-反应蛋白5.90 mg/L,血沉47 mm/h,降钙素原0.06 μg/L。体液免疫:IgG 10.10 g/L,IgA 3.24 g/L,IgM 0.39 g/L,C3 0.66 g/L,C4 0.16 g/L。ANA抗体谱:抗核抗体检测可疑(1∶100),抗SS-A抗体强阳性(3+),抗Ro-52抗体阳性(2+),抗Sm抗体阴性,抗ds-DNA抗体阴性。抗中性粒细胞胞质抗体、抗肾小球基底膜抗体、抗磷脂酶A2受体抗体、血清固定电泳、甲状腺功能、乙型肝炎、丙型肝炎、艾滋病、梅毒均阴性。影像学检查:胸部CT平扫:双肺多发小结节,左肺上叶纤维灶,纵隔肿大淋巴结质;肾脏彩超:双肾皮回声稍增强,左肾结石,双肾肾窦回声分离;常规心电图检查未见异常。
肾活检病理:全片共见约20个肾小球,其中约4个小球球性硬化,个别肾小球稍缺血皱缩,少部分肾小球节段有轻度系膜细胞增生或系膜基质增多,但毛细血管壁明显增厚、僵硬,毛细血管腔开放良好,未见袢坏死或新月体形成,PASM染色见毛细血管壁增厚,部分节段可见钉突和包裹(见图1)。肾小管上皮细胞变性坏死不明显,偶见个别小管萎缩,少数小管中有蛋白管型,间质偶见少量炎细胞浸润,间质纤维化轻微。免疫荧光检查:全片共见约10个肾小球,其中IgA(-),IgM(-),IgG(+),C1q(-),C3(±),Kappa(±),Lambda(±),弥漫性,球性,细颗粒样或线样以毛细血管壁沉积为主。电镜:少部分系膜区可见轻度系膜细胞增生和系膜基质增多,系膜区、内皮下和上皮下电子致密物不明显,内皮细胞胞质内见管网状包涵体,肾小球基底膜(glomerular basement membrane,GBM)明显增厚,基底膜内可见大量微球样膜样结构,足突明显融合(见图2)。肾小管间质未见明显电子致密物。
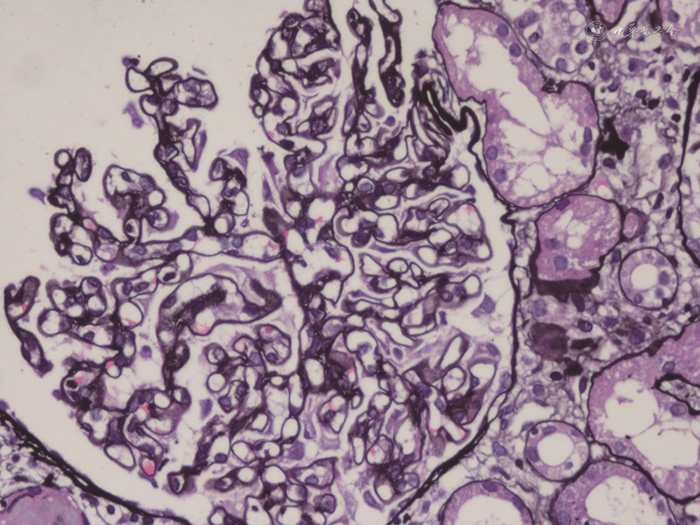

注:毛细血管壁增厚,部分节段可见钉突和包裹
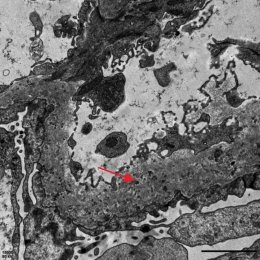

注:肾小球基底膜明显增厚,基底膜内可见大量微球样膜样结构(见红色箭头)
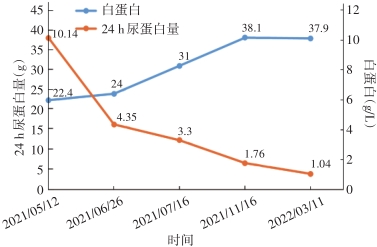
结合临床症状、实验室检查及病理表现,患者被诊断为足细胞内陷性肾小球病(podocyte infolding glomerulopathy,PIG),给予甲泼尼龙片32 mg/d+羟氯喹0.2 g/d,同时辅以保肝、护胃、抗凝、补钙、补钾、纠正贫血、促进粒细胞生长等综合治疗。患者水肿明显缓解,2021年6月26日患者复查尿蛋白/尿肌酐3.559 g/g,24 h尿蛋白4.35 g,血清白蛋白24.0 g/L,加用他克莫司2 mg/d,后续随访。2021年9月患者甲泼尼龙片减至16 mg/d,2021年12月调整为12 mg/d,后续每半月减2 mg,目前患者甲泼尼龙片6 mg/d维持治疗。患者2021年12月15日查他克莫司药物浓度为11.11 μg/L,调整剂量为1.5 mg/d。患者羟氯喹剂量未予调整。随访过程中患者肾功能正常,24 h尿蛋白及血清白蛋白变化见图3。

患者为老年女性,临床表现为大量蛋白尿、低蛋白血症,实验室检查虽有SS-A阳性,但无其他结缔组织病相关表现,诊断为结缔组织病依据不充分。患者肾脏病理电镜下可见GBM内大量微球样膜样结构,足突明显融合,因此诊断为PIG。PIG是指电镜下可见GBM内微球、微管或足细胞折叠样结构[1],这是一种较为罕见的病理学改变。
目前PIG的发病机制尚不明确,推测可能与以下几方面相关:(1)基因改变:中国Xiong等[2]报道了1例Schimke免疫骨营养不良伴有PIG的患者,在患者体内发现了一种新型SMARCAL1基因突变。虽然此类报道目前仅有1例,尚不能确定是否为偶然结果,但此报道也提示,对患者进行遗传及分子的研究将有助于进一步揭示PIG的发病机制。(2)免疫异常:有学者指出补体参与了PIG的发病。Nakajima等[3]对各种肾小球疾病的细胞外结构进行分析,发现细胞外结构的膜上分布的是一些补体或补体片段,如C1s、C3d和C9。Fujigaki等[4]对PIG合并系统性红斑狼疮患者进行免疫电镜分析,发现波形蛋白在大部分GBM微管结构中呈阳性,补体C5b-9复合物在GBM的整个上皮侧和一些微结构上呈阳性,认为C5b-9复合物攻击足细胞是引起足细胞内折叠和GBM内微结构形成的部分原因。本例患者免疫荧光检查可见IgG(+),C3(±),Kappa(±),Lambda(±),使用糖皮质激素及免疫抑制剂治疗后患者症状缓解,提示免疫系统参与疾病的发生发展。(3)足细胞损伤:在膀胱输尿管反流引起的继发局灶节段性肾小球硬化相关的PIG患者及PIG合并多发性骨髓瘤患者中分别观察到了足细胞扁平化、微绒毛形成、肌动蛋白丝增多[5, 6],提示PIG的发生可能与足细胞损伤相关。(4)GBM异常:GBM的组成成分如Ⅳ型胶原、层粘连蛋白、硫酸肝素主要来源于足细胞[7],这些成分合成和降解的不平衡可能会导致GBM功能障碍,足细胞和GBM的相互作用发生改变,更容易引起足细胞内陷[8]。PIG的发病机制需要更加深入的研究。2008年日本肾脏学会通过对日本25例病例进行回顾性分析,提出了PIG的病理诊断标准为:光镜下观察到GBM中的非嗜银空泡;电镜下GBM内有50~150 nm的微球和/或微管,免疫复合物可有或无[1]。PIG的微粒结构主要分为两类,一类是原发性足细胞胞质内陷,在光镜下可观察到钉突样结构,另一类是GBM内超微结构,包括微球体和微管样结构,对应表现为GBM内空泡样结构[1]。基于此,PIG可分为三种类型,A型:单纯足细胞胞质内陷;B型:足细胞胞质内陷合并GBM内超微结构;C型:单纯GBM内超微结构[1]。本例电镜下GBM内可见大量微球结构,足突明显融合,属于B型。
PIG的临床表现无明显的特异性,目前报道的大多数病例合并有自身免疫相关性疾病,如系统性红斑狼疮[9]、干燥综合征[10]等。Zhang等[10]对31例报道的PIG进行综合性分析,发现所有患者均有不同程度的蛋白尿,6例(19.35%)伴有血尿,10例(32.26%)血压升高,患者肾功能大多正常,仅有6例(19.35%)患者血清肌酐升高,由此可见蛋白尿是PIG的主要临床表现。
迄今为止PIG尚无标准治疗方案,糖皮质激素是被选用最多的治疗药物。大部分患者接受了不同剂量的泼尼松治疗,包括单用糖皮质激素及糖皮质激素联合免疫抑制剂,包括霉酚酸酯、环孢霉素、羟氯奎、他克莫司、利妥昔单抗等。本例患者有大量蛋白尿,初予糖皮质激素联合羟氯喹治疗后尿蛋白仍偏高,加用他克莫司后尿蛋白逐渐减少,临床症状缓解。也有其他治疗方案的相关报道,日本的1例膀胱输尿管反流引起肾脏局灶节段性硬化伴PIG患者,仅通过放置导尿管,蛋白尿明显减轻,水肿消退,肾功能改善[5]。一例4岁男患儿患有SMARCAL1基因突变的Schimke免疫骨营养不良,肾活检提示为PIG,只使用利尿剂及血管紧张素转化酶抑制剂治疗,水肿也逐渐消退,肾功能恢复正常[2]。
综上所述,PIG是一种罕见的肾脏疾病,虽然有学者对其发病机制提出假说,但具体机制至今未明确,因此国内外关于此病的诊治尚没有达成共识。目前我们仍需要收集病例,对患有系统性疾病及其他可导致肾损伤的疾病的患者积极行肾穿刺病理检查,以了解PIG的病理特征进而明确患者病变原因及程度,从而为制定个体化的诊疗方案,改善患者预后提供参考。
贾梦婷, 周玲, 李建中, 等. 足细胞内陷性肾小球病1例[J]. 中华肾脏病杂志, 2023, 39(2): 142-144. DOI: 10.3760/cma.j.cn441217-20220526-00542.
所有作者均声明不存在利益冲突



























