
选取2021年7至12月在北京大学人民医院规律血液透析且存在骨量减少或骨质疏松的患者共20例(男8例,女12例),年龄(64.8±13.9)岁,给予地舒单抗60 mg皮下注射。患者血钙在用药1个月时平均降低0.31 mmol/L,此时40%(8/20)的患者血清校正钙<2.1 mmol/L。患者骨转换指标在用药3 d后即出现下降,并持续降低至用药后5个月。多因素logistic回归分析未发现低钙血症相关的独立危险因素(R2=0.516,P=0.021)。可见,地舒单抗能明显降低血液透析患者的骨转换速率,但用药后更易发生低钙血症。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
慢性肾脏病患者容易发生骨量减少、骨脆性增加,从而导致骨折发生风险增高[1]。这一风险随着肾功能的下降而增加,在终末期肾脏病患者中更为突出。研究显示维持性血液透析(MHD)患者骨折发生风险较普通人群增加1.5~8.0倍,骨折相关住院风险和死亡风险增加3倍[2]。目前预防骨折发生的手段主要包括维持血钙、血磷和甲状旁腺素在理想范围内,以及使用抗骨质疏松的药物如双膦酸盐、特立帕肽或地舒单抗等。
地舒单抗是一种全人源单克隆抗体,以高特异性和高亲和力与核因子-κB受体活化因子(RANK)配体(RANKL)结合,阻止RANKL与其受体RANK结合,抑制破骨细胞形成和活化,从而减少骨吸收、增加骨量、改善骨强度,在治疗骨质疏松症中显示出良好的疗效[3],且肾功能减退对地舒单抗的药代动力学没有显著影响[4]。
地舒单抗在国内上市不久,应用经验不多,尤其在MHD患者中的报道更少。国外有文献报道MHD患者使用地舒单抗后更易发生严重的低钙血症[5]。因此本研究通过前瞻性观察MHD患者在使用地舒单抗前后血钙和骨转换指标的变化,初步探讨其在MHD患者中应用的安全性和有效性。
1. 研究对象:单臂研究。选取2021年7至12月在北京大学人民医院血液净化中心规律MHD的患者为研究对象。纳入标准:(1)年龄>18岁;(2)规律MHD>3个月,每周透析3次,每次4 h;(3)存在骨量减少(左股骨颈T值<-1.5)或骨质疏松(左股骨颈T值<-2.5);(4)血清校正钙>2.1 mmol/L;(5)未使用过地舒单抗。排除标准:(1)未控制的活动性肿瘤;(2)开始研究前3个月内曾接受或准备接受侵入性口腔手术。本研究已获得北京大学人民医院伦理委员会批准(批件号:2022PHB199-001),所有患者均签署知情同意书。
2. 研究方法:给予患者单次皮下注射地舒单抗60 mg(普罗力,美国安进公司)。以患者使用地舒单抗前3个月内的数据为基线,记录患者性别、年龄、体质指数(BMI)、透析龄、肾脏原发病、合并症、透析方案、骨密度和化验结果。同时收集患者钙剂、活性维生素D及其类似物和拟钙剂的用药情况。检验项目包括血红蛋白、血钙、血磷、白蛋白、碱性磷酸酶(ALP)、全段甲状旁腺素(iPTH)、25羟维生素D、抗酒石酸酸性磷酸酶(TRACP)、骨特异碱性磷酸酶(BAP)、骨钙素(OCN)、Ⅰ型胶原羧基端β交联肽(CTx)和总Ⅰ型胶原氨基端延长肽(P1NP)等。血红蛋白测定使用十二烷基硫酸钠法,血钙检测使用偶氮胂Ⅲ法,血磷使用磷钼酸法,白蛋白检测使用溴钾酚绿法,ALP使用碱性磷酸酶检测试剂盒法,iPTH、25羟维生素D、OCN、CTx和P1NP的检测均使用电化学发光法。TRACP和BAP的检测使用酶联免疫吸附测定法。超出检测范围上限的数据估算为上限值。血清校正钙计算公式:校正钙(mmol/L)=血清钙(mmol/L)+ 0.02×[40-白蛋白(g/L)]。低钙血症定义为血清校正钙<2.1 mmol/L。
给药后3 d和1、2、3、4和5个月时分别进行抽血化验,检测项目同上,并根据化验结果调整并记录用药方案和透析方案。
3. 统计学方法:采用SPSS 21.0统计软件进行数据分析,正态分布的计量资料采用表示,非正态分布的计量资料采用M(Q1,Q3)表示,计数资料采用例数和百分比表示。使用地舒单抗前后血清校正钙、血磷、iPTH和骨转换指标的变化采用单因素重复测量的方差分析(正态分布资料)和Friedman检验(非正态分布资料),两两比较采用Bonferroni法校正检验水准。使用Pearson相关分析检验血清ALP和BAP的相关性。采用单因素logistic回归模型分析低钙血症的相关因素,P<0.15的变量再纳入多因素logistic回归分析。均为双侧检验,检验水准α=0.05。
1. 一般情况和基线资料:本研究共纳入20例MHD患者,其中男8例,女12例,年龄(64.8±13.9)岁。3例(15%)合并糖尿病,8例(40%)有残余肾功能。透析龄8.0(4.2,11.5)年,BMI(21.3±2.3)kg/m2。其中7例(35%)正在使用钙剂治疗,平均元素钙补充量为879 mg/d;8例(40%)在使用骨化三醇或帕立骨化醇;8例(40%)在使用西那卡塞。
患者用药前血红蛋白(112.2±9.1)g/L,白蛋白(38.6±2.9)g/L,血清校正钙(2.5±0.2)mmol/L,iPTH 250(104,372)ng/L,25羟维生素D 94(47,139)nmol/L,尿素清除指数(Kt/V)为1.6±0.2。腰椎骨密度为(0.99±0.17)g/cm2,T值为-1.4(-2.2,0)。左股骨颈骨密度平均值为(0.64±0.15)g/cm2,T值为-2.7±1.1(表1)。
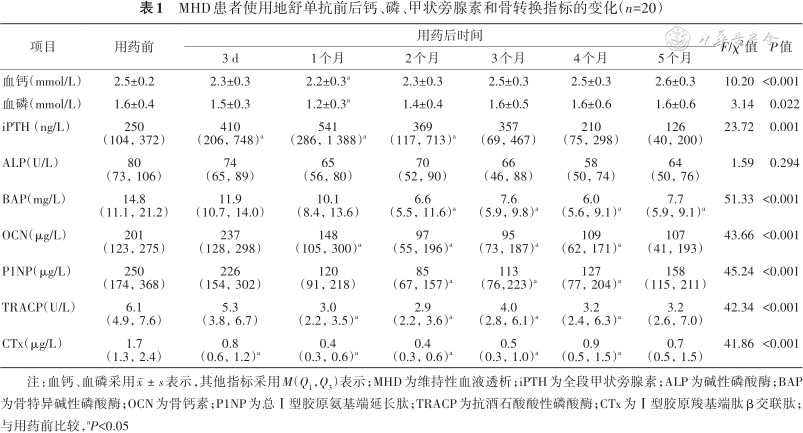
MHD患者使用地舒单抗前后钙、磷、甲状旁腺素和骨转换指标的变化(n=20)
MHD患者使用地舒单抗前后钙、磷、甲状旁腺素和骨转换指标的变化(n=20)
| 项目 | 用药前 | 用药后时间 | F/χ2值 | P值 | |||||
|---|---|---|---|---|---|---|---|---|---|
| 3 d | 1个月 | 2个月 | 3个月 | 4个月 | 5个月 | ||||
| 血钙(mmol/L) | 2.5±0.2 | 2.3±0.3 | 2.2±0.3a | 2.3±0.3 | 2.5±0.3 | 2.5±0.3 | 2.6±0.3 | 10.20 | <0.001 |
| 血磷(mmol/L) | 1.6±0.4 | 1.5±0.3 | 1.2±0.3a | 1.4±0.4 | 1.6±0.5 | 1.6±0.6 | 1.6±0.6 | 3.14 | 0.022 |
| iPTH(ng/L) | 250 (104,372) | 410 (206,748)a | 541 (286,1 388)a | 369 (117,713)a | 357 (69,467) | 210 (75,298) | 126 (40,200) | 23.72 | 0.001 |
| ALP(U/L) | 80 (73,106) | 74 (65,89) | 65 (56,80) | 70 (52,90) | 66 (46,88) | 58 (50,74) | 64 (50,76) | 1.59 | 0.294 |
| BAP(mg/L) | 14.8 (11.1,21.2) | 11.9 (10.7,14.0) | 10.1 (8.4,13.6) | 6.6 (5.5,11.6)a | 7.6 (5.9,9.8)a | 6.0 (5.6,9.1)a | 7.7 (5.9,9.1)a | 51.33 | <0.001 |
| OCN(μg/L) | 201 (123,275) | 237 (128,298) | 148 (105,300)a | 97 (55,196)a | 95 (73,187)a | 109 (62,171)a | 107 (41,193) | 43.66 | <0.001 |
| P1NP(μg/L) | 250 (174,368) | 226 (154,302) | 120 (91,218) | 85 (67,157)a | 113 (76,223)a | 127 (77,204)a | 158 (115,211) | 45.24 | <0.001 |
| TRACP(U/L) | 6.1 (4.9,7.6) | 5.3 (3.8,6.7) | 3.0 (2.2,3.5)a | 2.9 (2.2,3.6)a | 4.0 (2.8,6.1)a | 3.2 (2.4,6.3)a | 3.2 (2.6,7.0) | 42.34 | <0.001 |
| CTx(μg/L) | 1.7 (1.3,2.4) | 0.8 (0.6,1.2)a | 0.4 (0.3,0.6)a | 0.4 (0.3,0.6)a | 0.5 (0.3,1.0)a | 0.9 (0.5,1.5)a | 0.7 (0.5,1.5) | 41.86 | <0.001 |
注:血钙、血磷采用表示,其他指标采用M(Q1,Q3)表示;MHD为维持性血液透析;iPTH为全段甲状旁腺素;ALP为碱性磷酸酶;BAP为骨特异碱性磷酸酶;OCN为骨钙素;P1NP为总Ⅰ型胶原氨基端延长肽;TRACP为抗酒石酸酸性磷酸酶;CTx为Ⅰ型胶原羧基端肽β交联肽;与用药前比较,aP<0.05
2. MHD患者使用地舒单抗后血清校正钙、磷和iPTH的变化:观察期间共有3例患者发生有症状的低钙血症(肌肉痉挛),5例增加了口服钙剂用量,8例增加了活性维生素D及其类似物的用量,3例上调了透析液钙浓度。
重复测量资料的方差分析结果显示,不同时间点的血清校正钙的差异有统计学意义(F=10.197,P<0.001)。组间两两比较结果显示,与基线比较,使用地舒单抗后1个月时患者血清校正钙下降明显,比用药前平均降低0.31 mmol/L(95%CI:0.13~0.49 mmol/L)(P<0.001)。此时低钙血症(<2.1 mmol/L)发生率为40%(8/20)。用药后2、3、4和5个月时,血钙与基线比较差异均无统计学意义(均P>0.05)。
不同时间点血磷差异有统计学意义(F=3.137,P=0.022)。与基线比较,使用地舒单抗后1个月时患者血磷下降明显,比用药前平均降低0.40 mmol/L(95%CI:0.06~0.68 mmol/L)(P=0.013)。用药后2、3、4和5个月时,血磷与基线比较差异均无统计学意义(均P>0.05)。
Friedman检验结果显示不同时间点血清iPTH差异有统计学意义(χ2=23.723,P=0.001)。与基线比较,使用地舒单抗后3 d、1和2个月时iPTH较基线升高,3 d时iPTH平均升高331 ng/L(P=0.030),1个月时平均升高527 ng/L(P=0.001),2个月时平均升高246 ng/L(P=0.014)。3个月时恢复至基线水平(表1)。
3. MHD患者使用地舒单抗后骨转换指标的变化:不同时间点血清ALP差异无统计学意义(χ2=1.589,P=0.294)。与基线比较,使用地舒单抗后患者血清BAP明显下降,最低点发生于用药后4个月,此时ALP和BAP较基线下降幅度分别为26.19%(17.51%,32.29%)和52.61%(27.72%,65.65%)。对每个时间点的ALP和BAP进行相关性分析,结果显示基线时(r=0.710,P=0.001)和使用地舒单抗后1个月(r=0.895,P<0.001)、2个月(r=0.838,P=0.005)、3 个月(r=0.848,P=0.002)、4个月(r=0.946,P<0.001)、5个月(r=0.881,P=0.002)时患者ALP和BAP均呈正相关。
与基线比较,使用地舒单抗后患者骨形成指标血清OCN和P1NP也均下降。OCN最低点发生于用药后4个月,此时较基线下降幅度为52.33%(21.50%,59.39%);P1NP最低点发生于用药后2个月,此时下降幅度为56.07%(28.41%,68.16%)。与基线比较,使用地舒单抗后患者骨吸收的指标血清TRACP和CTx也均下降,最低点均发生于用药后1个月,此时较基线下降幅度为54.51%(44.22%,60.01%)和74.12%(58.01%,81.92%)(表1)。
4. MHD患者使用地舒单抗后低钙血症的相关因素分析:单因素logistic回归分析结果显示年龄、透析龄、基线血钙与低钙血症的发生相关(P<0.15)(表2)。将上述因素纳入多因素logistic回归模型结果显示,年龄、透析龄、基线血钙均与低钙血症的发生不相关(均P>0.05)(R2=0.516,P=0.021)(表3)。
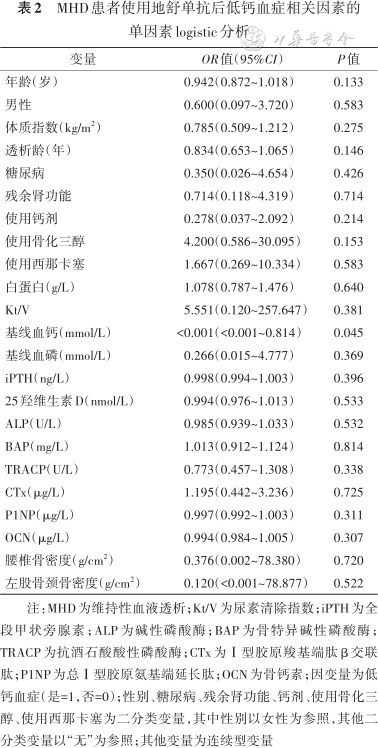
MHD患者使用地舒单抗后低钙血症相关因素的单因素logistic分析
MHD患者使用地舒单抗后低钙血症相关因素的单因素logistic分析
| 变量 | OR值(95%CI) | P值 |
|---|---|---|
| 年龄(岁) | 0.942(0.872~1.018) | 0.133 |
| 男性 | 0.600(0.097~3.720) | 0.583 |
| 体质指数(kg/m2) | 0.785(0.509~1.212) | 0.275 |
| 透析龄(年) | 0.834(0.653~1.065) | 0.146 |
| 糖尿病 | 0.350(0.026~4.654) | 0.426 |
| 残余肾功能 | 0.714(0.118~4.319) | 0.714 |
| 使用钙剂 | 0.278(0.037~2.092) | 0.214 |
| 使用骨化三醇 | 4.200(0.586~30.095) | 0.153 |
| 使用西那卡塞 | 1.667(0.269~10.334) | 0.583 |
| 白蛋白(g/L) | 1.078(0.787~1.476) | 0.640 |
| Kt/V | 5.551(0.120~257.647) | 0.381 |
| 基线血钙(mmol/L) | <0.001(<0.001~0.814) | 0.045 |
| 基线血磷(mmol/L) | 0.266(0.015~4.777) | 0.369 |
| iPTH(ng/L) | 0.998(0.994~1.003) | 0.396 |
| 25羟维生素D(nmol/L) | 0.994(0.976~1.013) | 0.533 |
| ALP(U/L) | 0.985(0.939~1.033) | 0.532 |
| BAP(mg/L) | 1.013(0.912~1.124) | 0.814 |
| TRACP(U/L) | 0.773(0.457~1.308) | 0.338 |
| CTx(μg/L) | 1.195(0.442~3.236) | 0.725 |
| P1NP(μg/L) | 0.997(0.992~1.003) | 0.311 |
| OCN(μg/L) | 0.994(0.984~1.005) | 0.307 |
| 腰椎骨密度(g/cm2) | 0.376(0.002~78.380) | 0.720 |
| 左股骨颈骨密度(g/cm2) | 0.120(<0.001~78.877) | 0.522 |
注:MHD为维持性血液透析;Kt/V为尿素清除指数;iPTH为全段甲状旁腺素;ALP为碱性磷酸酶;BAP为骨特异碱性磷酸酶;TRACP为抗酒石酸酸性磷酸酶;CTx为Ⅰ型胶原羧基端肽β交联肽;P1NP为总Ⅰ型胶原氨基端延长肽;OCN为骨钙素;因变量为低钙血症(是=1,否=0);性别、糖尿病、残余肾功能、钙剂、使用骨化三醇、使用西那卡塞为二分类变量,其中性别以女性为参照,其他二分类变量以“无”为参照;其他变量为连续型变量
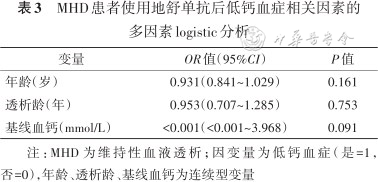
MHD患者使用地舒单抗后低钙血症相关因素的多因素logistic分析
MHD患者使用地舒单抗后低钙血症相关因素的多因素logistic分析
| 变量 | OR值(95%CI) | P值 |
|---|---|---|
| 年龄(岁) | 0.931(0.841~1.029) | 0.161 |
| 透析龄(年) | 0.953(0.707~1.285) | 0.753 |
| 基线血钙(mmol/L) | <0.001(<0.001~3.968) | 0.091 |
注:MHD为维持性血液透析;因变量为低钙血症(是=1,否=0),年龄、透析龄、基线血钙为连续型变量
骨质疏松是骨吸收超过骨形成的累积效应所致。双膦酸盐类药物可抑制骨吸收,进入人体后会长期留存在骨组织中,部分经肾清除,因此美国食品药品监督管理局建议除非有明确指征如骨活检结果的支持,肌酐清除率<30或35 ml/min的患者应尽量避免使用双膦酸盐[6]。特立帕肽是重组的甲状旁腺素,主要通过刺激骨形成增加骨密度,不适用于伴甲状旁腺功能亢进、高磷血症的MHD患者。因此地舒单抗或许是MHD患者的更优选择。
地舒单抗发挥抗骨质疏松的作用主要是通过降低骨转换速率。在绝经后女性中,用药1个月时CTx可下降77.7%~89.0%[7, 8]。本研究监测了患者BAP、OCN、P1NP等骨形成的标志物以及TRACP和CTx等骨吸收标志物,结果显示在用药3 d后骨形成和骨吸收即开始减少,并维持至整个观察期结束。这说明MHD患者在用药后骨转换指标的降低与其他人群接近,肾功能损害并未影响地舒单抗的作用效果。由于很多地区难以常规检测OCN、P1NP和CTx等骨转换标志物,因此本研究分析了ALP和BAP的相关性,结果发现二者明显相关,这提示如果不具备条件,可以监测ALP的动态变化来替代BAP。
地舒单抗的可能不良反应包括导致血钙降低和iPTH升高。本研究结果显示,MHD患者使用地舒单抗1个月时血钙较基线平均下降0.31 mmol/L,40%患者发生低钙血症;iPTH较基线平均升高527 ng/L。一项荟萃分析结果显示MHD患者使用地舒单抗后低钙血症发生率为42%(95%CI:29%~55%)[9],与本研究的报道相似,远高于其他人群。据统计约90%的低钙血症发生在使用地舒单抗后1个月内,血钙最低点通常发生于用药后5~7 d[10, 11]。这提示至少应在用药后5~7 d时检测血钙,用药后1个月内均应严密监测血钙水平。地舒单抗导致MHD患者低钙血症的机制可能与甲状旁腺切除术后的骨饥饿综合征相似:MHD患者通常存在iPTH过度分泌,促进骨吸收以使钙从骨骼释放到血液中来维持钙稳态;地舒单抗阻断了这种iPTH依赖的骨吸收,骨骼释放的钙明显减少,导致急性低钙血症[4]。但也有文献报道在补充充分的钙剂和维生素D(元素钙1 200 mg/d,骨化三醇 1 μg/d)情况下,终末期肾脏病患者使用地舒单抗后无一例发生有症状的低钙血症[12],提示补充钙剂和维生素D的重要性。本研究中,由于患者基线血钙正常或偏高,且均存在明显的血管钙化,因此未在使用地舒单抗的同时强化补钙和维生素D。既往有研究显示基线iPTH、BAP和TRACP可能与低钙血症的发生有关[10],但本研究中未观察到此现象,可能与样本量较小有关。
使用地舒单抗后iPTH升高也比较常见。有文献报道绝经后女性使用地舒单抗1、3个月时iPTH分别较基线升高33.9%和19.7%[6]。本研究中,MHD患者使用地舒单抗后iPTH升高的绝对值和幅度均更为显著,但随着血钙的回升,iPTH很快恢复至基线水平,提示地舒单抗对iPTH的影响是短期的。
本研究存在一些局限性。首先,由于地舒单抗在我国获批上市不久,本研究观察的时间较短,主要评价的是地舒单抗对MHD患者骨代谢的短期影响,对骨密度的影响还需要长期随访。第二,本研究为单中心研究,样本量较小,后续还可扩大样本量进一步观察。
综上所述,本研究结果提示MHD患者使用地舒单抗后骨转换指标的降低与其他人群相近,但更易发生低钙血症,在用药至少1个月内需严密监测血钙。
王琰, 朱丽, 杨冰, 等. 地舒单抗对维持性血液透析患者血钙和骨转换指标的影响[J]. 中华医学杂志, 2023, 103(8): 594-597. DOI: 10.3760/cma.j.cn112137-20220913-01935.
所有作者均声明不存在利益冲突



























