
探讨供者在体左/右半肝劈裂技术的改进和创新及应用于临床肝移植的安全性。
回顾性分析2021年3月至2022年6月宁波大学附属李惠利医院实施在体左/右半肝劈裂供肝(27例)及相应受者(49例)的临床资料,按供肝采用的劈裂肝技术分为常规劈裂组(A组,13例)和创新劈裂组(B组,14例),相应受者分为常规劈裂受者组(C组,25例)和创新劈裂受者组(D组,24例)。比较分析A、B两组供者的临床资料及相应两组受者近期疗效,随访截至2022年9月30日。
27例供者中男性23例,女性4例,死亡原因颅脑外伤12例,自发性脑出血13例,缺血缺氧性脑病2例。B组供者体重和体重指数大于A组,血钠水平低于A组(P< 0.05)。A组供肝劈裂中位手术时间230 min高于B组的175 min(P=0.022)。左/右半供肝脉管分配比例A和B组差异无统计学意义。供肝下腔静脉劈裂A组1例,B组10例(P=0.001)。20例需要Ⅴ/Ⅷ段流出道重建的右半肝移植中,A组12例和B组3例采用传统的独立架桥重建(独立式),B组5例采用创新的下腔静脉成型联合重建(联合式),组间差异有统计学意义(P=0.004)。受者临床资料比较发现,C组与D组手术时间、无肝期及手术出血量比较差异无统计学意义。C组中7例留置"T"管,D组为14例,差异有统计学意义(P=0.032)。近期疗效比较,49例受者中12例出现26起Clavien-Dindo分级≥Ⅲ级并发症,其中C组7例,D组5例,但Ⅲ级及以上胆道并发症C组6例,D组0例,两组差异有统计学意义(P=0.016)。因术后严重并发症死亡2例,其中C、D组各1例。移植肝6个月和1年的存活率分别为95.9%和87.7%,受者6个月和1年存活率分别为95.9%和92.4%。
左/右半肝劈裂式肝移植经一定手术量的积累和技术的改进,手术时间可趋向缩短。改进的下腔静脉劈裂术式和创新的Ⅴ/Ⅷ段静脉回流联合下腔静脉重建术式经临床应用证明是可行和安全的。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肝移植已成为治疗终末期肝病和部分肝恶性肿瘤的有效手段,但供肝资源短缺严重制约其进一步发展。劈裂式肝移植(split liver transplantation,SLT)可将一个完整供肝劈裂成两个具有独立解剖和功能的移植物,分别移植给两个受者。作为一种增加供肝来源的重要技术,避免了活体肝移植对器官捐献供者的身体创伤和潜在的健康损害,成为当今肝移植技术研究的一个热点[1,2]。随着相关技术的发展,受者范围从成人-儿童受者拓展到成人-成人受者。供肝劈裂方式也从体外劈裂发展到在体劈裂。经过精准评估,劈裂的左、右半肝可以分别移植给两个成年受者,成倍扩大供肝来源、减少受者移植等待时间,尤其是解决了小体型、低体重成人的器官短缺问题。受供者条件和医疗技术水平的限制,国内开展该项技术的中心不多,文献报道的例数亦有限。宁波大学附属李惠利医院于2021年起在活体肝移植(living donor liver transplantation,LDLT)基础上,先开展成人-儿童经典原位劈裂式肝移植(conventional SLT,cSLT),此后开展了成人-成人的尸体供肝在体完全左右半肝劈离式肝移植(full-size SLT,fSLT),并在实践中不断改进和创新fSLT技术,现将初步应用结果报告如下。
经评估后为潜在fSLT供者在确定死亡及家属有捐献意愿后尽可能行中上腹CT增强扫描并行计算机三维重建及肝体积计算(图1)。在体完全左右半肝劈裂(full-size SLT,fSLT)捐献者除符合一般器官捐献供者标准外,尚需符合下述标准:年龄≤55岁;体重≥50 kg;体重指数≤25 kg/m2;标准肝体积计算≥1 200 ml;血流动力学稳定或低剂量升压药;肝脾CT值比≥1,无脂肪肝或肝脏脂肪比例≤10%;丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST)≤3倍上限,总胆红素≤2倍上限;心肺复苏≤2次;无明确全身感染;血清钠≤160 mmol/L;计算机三维重建未见无法重建的胆道及血管变异。基础条件较好捐献者,年龄可以适当放宽至≤60岁[1,2,3,4]。
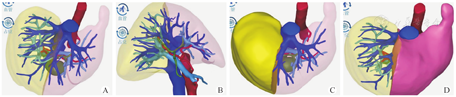

按照终末期肝病模型(model for end-stage liver disease,MELD)评分结合体重选择合适受者,需符合以下标准:非二次肝移植;既往至多1次肝脏手术史;预估移植物受者体重比率[graft recipient weight ratio,GRWR,实际计算时采用供肝体积(ml)与受者体重(g)之比]≥1.2%,如供者条件优越可适当放宽至≥1.0%;无或1~2级门静脉/肠系膜上静脉血栓形成;无严重血管变异[1,2,4]。所有供器官均经中国人体器官分配与共享计算机系统(China Organ Transplant Response System,COTRS)分配。
本研究为回顾性研究,经宁波市医疗中心李惠利医院伦理委员会批准(伦理号:KY2022PJ019)。所有供、受者及家属术前均签署知情同意书。
供者进手术室宣告死亡后按常规手术程序进行。进腹后根据肝脏颜色、质地、大小再次评估是否适合劈裂式肝移植,怀疑脂肪肝时需行快速冰冻切片组织病理学检查明确脂肪肝比例。先切除胆囊,胰腺上方结扎离断胆总管,显露并悬吊肝右动脉及门静脉右支,不过分骨骼化左肝蒂。术中超声再次定位肝中静脉,阻断肝右动脉及门静脉右支,沿缺血线及肝中静脉右侧标记左右半肝劈裂线。游离肝脏,离断镰状韧带及左右三角韧带,离断肝胃韧带时需留意副肝左动脉的存在,如该动脉大于2 mm,需要保留并追溯到胃左动脉,以待重建。完全游离右半肝,结扎离断右肝后细小的肝短静脉,大于4 mm的肝短静脉予以保留。建立肝后隧道,离断下腔静脉前方尾状叶直至右肝蒂,在下腔静脉前方,肝右静脉左侧及右肝动静脉内侧留置牵引带悬吊肝脏。不阻断肝门,超声外科吸引器(cavitron ultrasonic surgical aspirator,CUSA)离断肝实质,双极电凝及钛夹处理肝断面管道,2 mm及以上肝内管道需要0-1号丝线结扎,预防术后胆漏和出血。Ⅴ/Ⅷ静脉流出道血管牵引带保护后离断。肝实质离断后自胆总管断端置管行术中胆道造影,以精确定位胆道离断点,避免胆道变异造成失误(外院获取时暂不离断胆管,留待肝移植术前台下处理)。供者胆管离断后,供者全身肝素化,用量为普通肝素钠[125×体重(kg)×3]单位。常规获取肝脏及双肾,获取双侧髂血管备用(图2)。
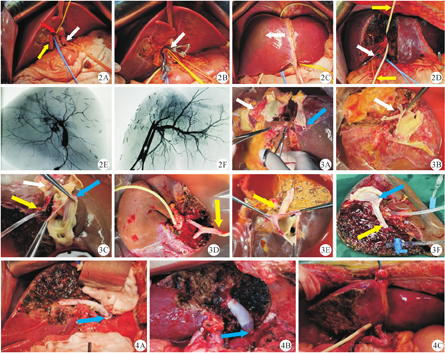

供肝修整一般原则同全肝移植。腹腔干通常归左肝,当肝右动脉发自肠系膜上动脉时,则左右半肝均能得到一大口径的动脉襻。门静脉主干(main portal vein,MPV)视供受者血管解剖特点决定归属。前12例供肝下腔静脉均留给左半肝以保证尾叶静脉的回流,第13例供肝开始实施下腔静脉的完全劈裂(特殊情况例外)。具体操作技术:自背面剪开浸泡在冷保存液中供肝的下腔静脉后壁,确认下腔静脉内膜上需保留的左/右半肝静脉开口的直径和数目后,将下腔静脉劈裂成左、右两半,然后遵循便于吻合的原则修剪成型,右侧下腔静脉壁的修剪尚需考虑后续Ⅴ/Ⅷ段流出道可能联合成型的要求(图3A、3B)。左半供肝修整:通常6-0血管缝线连续缝闭门静脉右支断端开口,下腔静脉流出道修整成型,同时注意缝闭尾叶至左右肝管汇合部被离断的细小胆管开口,胆管和动脉不再做其他修整(图3C)。右半供肝修整核心是Ⅴ/Ⅷ段静脉回流的重建,术前影像评估或术中发现离断的Ⅴ/Ⅷ段静脉直径≥5 mm时均应重建。重建方法分为独立式和联合式。独立式选用供肝的"Y"型髂血管(静脉或动脉),与Ⅴ/Ⅷ段形成一共同开口或各自桥接,待移植肝门静脉开放后独立与下腔静脉吻合(图3D);联合式将Ⅴ/Ⅷ段静脉桥接后直接与下腔静脉襻联合成型,无肝期与受者腔静脉侧侧吻合一次完成,无需门静脉开放后再吻合(图3E、3F)。左肝管断端开口6-0可吸收线连续缝闭,动脉及门静脉不再做其他修整。
遵循活体肝移植的手术原则,病肝切除时尽可能将管道留长,原则上应在肝门板离断肝动脉和门静脉左右支及胆管,以利于随后的吻合,但必须注意保护胆道血管丛。左、右半肝移植时原则上均采用背驮式。右半肝移植时,侧壁钳阻断下腔静脉后切除病肝,测量修整受者肝右静脉开口,使之与供肝开口匹配,4-0血管缝线连续吻合。原则上供肝和受者肝流出道吻合口径应大于3 cm。门静脉重建时在右肝后方置入冰大纱垫,既可减少吻合时的张力,亦可避免血管过长造成扭曲。肝脏恢复灌注后将Ⅴ/Ⅷ段架桥血管吻合于下腔静脉(图4A),如Ⅴ/Ⅷ段静脉回流采用联合式重建,则此步骤省略(图4B)。根据血管口径,连续(≥3 mm)或间断(<3 mm)缝合重建肝右动脉。原位重建胆管或胆肠内引流。左半肝移植也采用背驮式,遵循如下原则:①病肝切除时可先结扎切断门静脉右支和切断缝合肝右静脉;②病肝切除后修整成型肝中、肝左开口,与供肝已修整的下腔静脉开口匹配后连续吻合;③门静脉重建应遵循"宁紧勿松"原则,注意吻合结束后左半移植肝移位可能,关腹前需在门静脉血流最通畅位置将左半移植肝镰状韧带固定膈肌上;④受者行胆管-胆管端端吻合时易成角或口径不匹配,常规留置"T"管;吻合困难时也可考虑胆肠吻合(图4C)。当实际GRWR小于0.8%时,为避免小肝综合征的发生,需常规切除脾脏,术后应用生长抑素或特利加压素降低肝门静脉压力。血管吻合完成后常规进行彩色多普勒超声测量血流。
检索宁波大学附属李惠利医院肝移植临床数据库和中国肝移植注册中心(https://cltr.cotr.cn/),提取2021年3月至2022年6月共27例fSLT供者和相应49例受者的一般资料和临床数据。按供肝手术所采用的劈裂肝技术分为常规劈裂组(A组,13例)和创新劈裂组(B组,14例),相应受者分为常规劈裂受者组(C组,25例)和创新劈裂受者组(D组,24例)。对A、B组供者的基本信息,劈裂式肝移植手术资料进行比较,同时比较C、D组受者的一般资料和治疗结果。供肝组织病理学检查证实肝脏存在脂肪变性者定义为肝脂肪变性。MELD评分按肝功能状态评定,忽略肝癌特例评分。术后并发症提取小肝综合征和Clavien Dindo并发症分级系统≥Ⅲ级并发症的发生情况[5],小肝综合征诊断标准参照《中国活体肝移植小肝综合征临床诊治指南(2016版)》[6]。将胆漏和胆管狭窄等归为胆道并发症;肝动脉、门静脉和下腔静脉的血栓形成或狭窄等则归为血管并发症;同1例受者发生多个并发症在合计时以最高等级计入。术后死亡定义为术后住院死亡或术后30 d内死亡。术后3 d内每日行移植肝血管超声多普勒检查,术后1~2周常规CT检查。出院后随访采用门诊和电话方式,随访截至2022年9月30日,随访时间9个月(5,13)个月。
采用SPSS 25.0软件进行数据处理,连续性变量以M(Q1,Q3)描述,使用秩和检验;分类变量采用[例(%)]表示,采用χ2检验或Fisher确切概率法进行统计分析。P<0.05为差异有统计学意义。
2021年3月至2022年6月共对27例符合fSLT标准捐献者实施在体左半肝/右半肝获取。27例供者中男性23例,女性4例。死亡原因12例为颅脑外伤,13例为自发性脑出血,2例为缺血缺氧性脑病。A、B组供者基本信息比较,B组体重和体重指数大于A组,血钠水平低于A组,差异均有统计学意义(均P<0.05),表明采用技术创新后供者选择时对体重和血钠水平要求增高,体重指数适当放宽。其他信息比较差异均无统计学意义(表1)。
27例在体劈裂式肝移植供者一般资料比较[M(Q1,Q3)]
27例在体劈裂式肝移植供者一般资料比较[M(Q1,Q3)]
| 组别 | 例数 | 年龄(岁) | 男[例(%)] | 体重(kg) | BMI(kg/m2) | 死亡原因[例(%)] | ||
|---|---|---|---|---|---|---|---|---|
| 颅脑外伤 | 自发性脑出血 | 缺血缺氧性脑损伤 | ||||||
| A组 | 13 | 38.0(30.0,49.0) | 11 | 65.0(60.0,69.0) | 22.8(21.0,23.3) | 6 | 6 | 1 |
| B组 | 14 | 48.0(32.0,54.5) | 12 | 70.0(67.5,75.0) | 24.2(23.4,25.5) | 6 | 7 | 1 |
| 合计 | 27 | 42.0(32.0,50.0) | 23(85.2) | 70.0(60.0,72.5) | 23.4(22.3,24.4) | 12(44.4) | 13(48.2) | 2(7.4) |
| P值 | - | 0.243 | 1.000 | 0.014 | 0.002 | 1.000 | ||
| 组别 | ICU住院时间(d) | 脂肪变性[例(%)] | 血钠(mmol/L) | AST(U/L) | ALT(U/L) | TB(μmol/L) | 心肺复苏[例(%)] |
|---|---|---|---|---|---|---|---|
| A组 | 6.0(4.5,9.0) | 2 | 152.2(148.2,160.9) | 83.0(36.0,327.5) | 63.0(32.2,93.5) | 15.0(9.2,24.0) | 5 |
| B组 | 6.5(5.7,10.0) | 6 | 145.2(138.4,153.0) | 46.0(31.0,105.0) | 36.0(27.0,59.5) | 16.8(8.6,36.6) | 1 |
| 合计 | 6.0(5.0,10.0) | 8(29.6) | 148.4(141.5,158.4) | 70.0(36.0,187.5) | 39.0(30.7,80.0) | 15.0(8.7,24.7) | 6(23.1) |
| P值 | 0.508 | 0.204 | 0.042 | 0.166 | 0.225 | 0.627 | 0.160 |
注:BMI为体重指数;AST为天冬氨酸转氨酶;ALT为丙氨酸转氨酶;TB为总胆红素;A组为常规劈裂术式供者组;B组为创新劈裂术式供者组
供肝获取手术数据比较,A组手术时间中位数为230 min,B组为175 min,两组差异有统计学意义(P=0.022),反映了手术技术的熟练和改进。表2提示B组预估肝体积亦大于A组(P=0.020),两组实际供肝重量差异达临界水平(P=0.075)。此外,体外供肝修整中位时间A组为61 min,B组为90 min(P=0.090),导致B组供肝冷缺血时间较A组延长了30 min(P=0.099),说明创新技术供肝(主要是右肝)体外修复技术更复杂(表2)。27例左、右半供肝的脉管分配比较见表3。A、B组腹腔干、门静脉主干和胆总管归属左、右半肝比较,差异无统计学意义(均P>0.05),数据显示多数情况下腹腔干归左半肝,胆总管归右半肝,门静脉主干归左半肝或右半肝比例相近,另外肝中静脉主干均分配给左半肝。但肝后下腔静脉劈裂A组只有1例,B组有10例,两组差异有统计学意义(P=0.001)。经COTRS分配本中心共获得23例右半肝(其中包括A组供肝12例,B组供肝11例),经评估20例供肝需实施Ⅴ/Ⅷ段回流静脉重建(A组供肝12例,B组供肝8例),另3例(B组供肝)无需重建。A组供肝12例进行独立式Ⅴ/Ⅷ段回流静脉架桥重建,B组供肝3例独立式重建,5例将架桥的Ⅴ/Ⅷ段静脉与劈离的下腔静脉成型重建(联合式),Ⅴ/Ⅷ段回流静脉重建术式比较,两组差异有统计学意义(P=0.004)。
27例在体劈裂式肝移植供者手术数据比较[M(Q1,Q3)]
27例在体劈裂式肝移植供者手术数据比较[M(Q1,Q3)]
| 组别 | 例数 | 劈裂时间(min) | 出血量(ml) | 虚拟肝体积(ml) | 台下修整时间(min) | 实际质量(g) | 冷缺血时间(min) |
|---|---|---|---|---|---|---|---|
| A组 | 13 | 230(191,244) | 250(200,300) | 1 476(1 249,1 711) | 61(51,77) | 1 338(1 268,1 518) | 240(180,270) |
| B组 | 14 | 175(142,184) | 300(200,312) | 1 847(1 526,2 073) | 90(50,120) | 1 591(1 424,1 685) | 270(217,322) |
| 合计 | 27 | 183(150,240) | 300(200,300) | 1 629(1 354,1 921) | 63(52,105) | 1 470(1 298,1 625) | 240(210,300) |
| P值 | - | 0.022 | 0.365 | 0.020 | 0.090 | 0.075 | 0.099 |
注:A组为常规劈裂术式供者组;B组为创新劈裂术式供者组
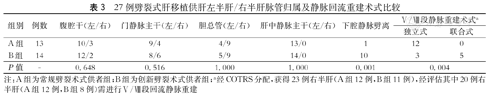
27例劈裂式肝移植供肝左半肝/右半肝脉管归属及静脉回流重建术式比较
27例劈裂式肝移植供肝左半肝/右半肝脉管归属及静脉回流重建术式比较
| 组别 | 例数 | 腹腔干(左/右) | 门静脉主干(左/右) | 胆总管(左/右) | 肝中静脉主干(左/右) | 下腔静脉劈离 | Ⅴ/Ⅷ段静脉重建术式a | |
|---|---|---|---|---|---|---|---|---|
| 独立式 | 联合式 | |||||||
| A组 | 13 | 10/3 | 9/4 | 4/9 | 13/0 | 1 | 12 | 0 |
| B组 | 14 | 12/2 | 8/6 | 5/9 | 14/0 | 10 | 3 | 5 |
| P值 | - | 0.648 | 0.516 | 1.000 | 1.000 | 0.001 | 0.004 | |
注:A组为常规劈裂术式供者组;B组为创新劈裂术式供者组;a经COTRS分配,获得23例右半肝(A组12例,B组11例),经评估其中20例右半肝(A组12例,B组8例)需进行Ⅴ/Ⅷ段回流静脉重建
经在体完全劈裂,27例供肝共产生54例可供移植的肝段(27例左半肝,27例右半肝)。经COTRS系统分配,本中心获得49例(左半肝26例,右半肝23例),另5例供肝(4例右半肝,1例左半肝)分至外院。49例受者按相应的供肝分为C组(25例)和D组(24例),两组的临床资料及近期疗效比较见表4。
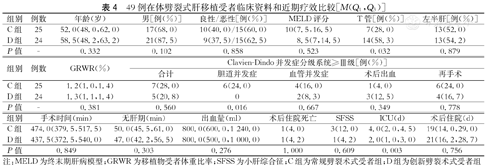
49例在体劈裂式肝移植受者临床资料和近期疗效比较[M(Q1,Q3)]
49例在体劈裂式肝移植受者临床资料和近期疗效比较[M(Q1,Q3)]
| 组别 | 例数 | 年龄(岁) | 男[例(%)] | 良性/恶性[例(%)] | MELD评分 | T管[例(%)] | 左半肝[例(%)] |
|---|---|---|---|---|---|---|---|
| C组 | 25 | 52.0(48.0,62.0) | 17(68.0) | 10(40.0)/15(60.0) | 10(7.5,16.5) | 7(28.0) | 13(52.0) |
| D组 | 24 | 58.5(48.2,63.2) | 21(87.5) | 9(37.5)/15(62.5) | 8.5(7,14.5) | 14(58.3) | 13(54.2) |
| P值 | - | 0.332 | 0.102 | 0.858 | 0.523 | 0.032 | 0.879 |
| 组别 | 例数 | GRWR(%) | Clavien-Dindo并发症分级系统≥Ⅲ级[例(%)] | ||||
|---|---|---|---|---|---|---|---|
| 合计 | 胆道并发症 | 血管并发症 | 术后出血 | 再手术 | |||
| C组 | 25 | 1.2(1.0,1.4) | 7(28.0) | 6(24.0) | 4(16.0) | 1(4.0) | 6(24.0) |
| D组 | 24 | 1.3(1.1,1.4) | 5(20.8) | 0 | 2(8.3) | 3(12.5) | 4(16.7) |
| P值 | - | 0.381 | 0.560 | 0.016 | 0.667 | 0.349 | 0.778 |
| 组别 | 手术时间(min) | 无肝期(min) | 出血量(ml) | 术后住院死亡 | SFSS | ICU(d) | 术后住院(d) |
|---|---|---|---|---|---|---|---|
| C组 | 474.0(379.5,517.5) | 50.0(45.5,61.0) | 800.0(600.0,1 240.0) | 1(4.0) | 3(12.0) | 4.0(2.0,4.5) | 19(14.0,29.0) |
| D组 | 437.5(372.5,540.0) | 47.0(42.2,56.5) | 800.0(500.0,1 000.0) | 1(4.2) | 1(4.2) | 2.0(1.0,3.0) | 21(16.2,28.7) |
| P值 | 0.849 | 0.303 | 0.276 | 1.000 | 0.609 | 0.003 | 0.756 |
注:MELD为终末期肝病模型;GRWR为移植物受者体重比率;SFSS为小肝综合征;C组为常规劈裂术式受者组;D组为创新劈裂术式受者组
C组和D组在良恶性疾病占比、MELD评分,左半肝占比和GRWR等临床参数比较,差异无统计学意义(均P>0.05)。手术数据比较手术时间和无肝期及术中出血量,D组较C组似有下降趋势,但差异均无统计学意义。"T"管留置C组7例(28.0%),D组14例(58.3%),差异有统计学意义(P=0.032)。近期疗效比较,49例受者中有12例出现了Clavien-Dindo分级系统≥Ⅲ级并发症,术后严重并发症发生率为24.5%,其中C组为28.0%(7/25),D组为20.8%(5/24),两组比较严重并发症发生率差异无统计学意义,但Ⅲ级及以上胆道并发症C组6例(24.0%),D组0例,两组比较差异有统计学意义(P=0.016);6例受者发生了Ⅲ级及以上血管并发症共8例次,分别是肝动脉血栓形成2例次,门静脉血栓4例次,下腔静脉栓塞2例次,其中C组4例(16.0%),D组2例(8.3%),两组比较差异无统计学意义。其他严重并发症和小肝综合征(small-for-size syndrome,SFSS)发生率,两组差异均无统计学意义(均P>0.05)。因术后严重并发症死亡2例,其中C组1例(4.0%)术后2周死于术后严重胆道和血管并发症,D组1例(4.2%)术后3周死于移植物抗宿主病引起的严重感染,两组比较,差异无统计学意义(P=0.349)。C组术后留驻ICU中位时间比D组长(4 d比2 d,P=0.003)。C组和D组移植术后住院中位时间分别为19 d和21 d,差异无统计学意义(P=0.756)。随访至2022年9月底,1例受者实施二次肝移植,49例移植肝的6个月和1年存活率分别为95.9%和87.7%,受者的6个月和1年存活率分别为95.9%和92.4%,C组和D组受者中位随访时间分别是13个月和5个月,差异较大,故未进行存活率的比较。
活体肝移植的蓬勃发展,一定程度上缓解了目前供肝缺乏的困境。但受限于传统观念、少子化家庭、供受者匹配等原因,成人活体肝移植发展缓慢。本中心自2019年起实施成人活体肝移植至今共15例,年均不到5例。劈裂式肝移植可成倍扩大供肝来源,减少受者移植等待时间,尤其是可解决小体型、低体重成人的器官短缺问题,自问世以来即深受移植界关注。在一些欧洲国家,cSLT发展很快,主要为了扩大小儿肝移植的供肝来源,并已成为一种强制性政策[7,8]。但用于两个成人受者的fSLT则举步维艰,国内外大样本量病例报告不多,且术后严重并发症发生率和死亡率均较高[3,9,10,11]。本中心2021年开展了cSLT,在此基础上于2021年3月至2022年6月对27例尸体供肝实施了原位左/右半肝劈裂,共获取54个有效左半肝/右半肝移植物,劈裂供肝利用率为100%。在实践中不断优化供肝劈裂技术和左、右半肝脉管分配策略,改进了下腔静脉劈裂方法,创新了Ⅴ/Ⅷ段静脉回流重建技术。将2021年采用常规技术劈裂的13例定义为A组,2022年采用改进和创新技术劈裂的14例定义为B组,分析A组和B组的中位劈裂手术时间,发现后者较前者缩短了55 min,表明在掌握活体肝移植技术的基础上,经过一定量原位肝劈裂的学习曲线后,完全左、右半肝劈裂技术可趋向成熟。改进的下腔静脉劈裂技术和创新的Ⅴ/Ⅷ段静脉回流重建技术,经相应前25例和后24例受者近期疗效的比较,证明是安全可行和有效的。据国内外文献检索,本研究是单位时间段内(2021年3月~2022年6月)增长例数最快,国内(不含台湾地区)单中心报道的例数最多、近期疗效亦较好的完全半肝原位劈裂式肝移植报告。
目前对fSLT供者的选择标准尚未完全统一。本中心目前的标准是参考国内外文献并根据实践逐渐形成[1,2,4]。具体实施时根据各项指标适当调整,最终是否劈裂由具备经验的供肝获取医师通过观察肝脏外观、色泽、质地等决定,必要时送冰冻切片辅助判断。虽然供、受者筛查时要求实际的GRWR≥1.2%,但现有各种术前预估体积的计算和实际获取称重仍存在一定的误差。为了减少冷缺血时间,受者手术常在劈裂的供肝未完全修整称重前进行,因COTRS系统分配后不能更改,故本研究8例受者的GRWR<1.0%(A组6例,B组2例)。作为儿童供肝主要来源的cSLT,供者年龄应不超过40岁,而作为成人供肝的供者只要其他条件符合,年龄可适当放宽,ICU治疗时间亦不应限定太严,关键是排除全身感染[4]。
SLT经过20余年的发展,在供肝获取方式上已达成共识,即尽可能采用不阻断肝门的原位劈裂技术[2,12,13]。较之离体劈裂,在体劈裂有许多优势,特别是肝脏断面止血确切,可减少移植术中止血难度,同时常规术中胆道造影,可减少术后胆道并发症的发生等。左/右半肝脉管的分配是fSLT实施时需要认真评估讨论的一个难点[2,12]。由于肝门的解剖特点,通常将腹腔干留给左肝,胆总管留给右肝,但门静脉主干和下腔静脉的归属各中心多有不同[13,14,15]。本中心2021年实施的13例,基本参照活体肝移植手术方式结合肝脏体积和胆管血供,将肝中静脉、尾状叶及下腔静脉、腹腔干留给左半肝,胆总管留给右半肝,门静脉主干则视供受者肝脏血管解剖特点而定。随着经验的积累,本团队发现将下腔静脉完全留给左半肝,对右半肝静脉回流会造成一定的影响;当右侧存在数支直径在3~5 mm的肝短静脉时,右半肝静脉回流的重建存在一定的困难,而将下腔静脉劈裂并不影响左半肝的回流,适当成型后反而可提高左半肝流出道重建的效率,故自第14例始肝脏劈裂时不离断肝短静脉,取肝后台下对肝后下腔静脉实施完全劈裂(特殊情况例外),并逐渐形成了标准化的流程。Ⅴ/Ⅷ段静脉回流的重建方法前期与多数中心一致,通常选用供者的"Y"型髂血管(静脉或动脉),与Ⅴ/Ⅷ段桥接,待门静脉开放后再独立与下腔静脉吻合,将这种重建术式命名为"独立式"。实践中发现该术式有以下若干问题:①增加手术时间;②增加出血量(约200~500 ml);③在肝右中或右下静脉与腔静脉吻合重建时,下腔静脉壁允许Ⅴ/Ⅷ段架桥血管吻合的空间将极其狭小,可造成吻合技术上的困难。故此本中心创新了Ⅴ/Ⅷ段静脉回流重建技术,在右半肝修整时,将Ⅴ/Ⅷ段静脉桥接后直接与下腔静脉襻联合成型,留待无肝期与受者腔静脉侧侧吻合一次完成,无需门静脉开放后再吻合,称之为联合式,经临床初步应用证明是有效和可行的。架桥选用髂动脉或静脉无本质差别,但髂静脉壁薄易成角,动脉支撑性较好,本中心多采用髂动脉重建,二者远期通畅率孰优孰劣尚有待更多的随访。因右肝流出道重建后期多采用联合式,故B组台下修整时间较A组平均延长30 min,但总的供肝冷缺血时间很少超过5 h。上述技术的改进和创新理论上有利于保持流出道通畅,缩短无肝期时间,减少手术出血量和回流静脉栓塞的可能,从而促进术后的恢复和预后的改善。本研究通过两组受者手术数据比较,B组手术和无肝期时间及术中出血量似呈下降趋势,但二组比较差异无统计学意义。后述血管并发症发生率比较亦类似。这可能与样本量少,随访时间短及B组静脉联合重建的术式占比不高(62.5%)等有关,致使上述优势难以体现。相信随着病例数的增加和技术的日益成熟,下腔静脉劈裂技术改进和Ⅴ/Ⅷ段静脉联合重建技术创新的优势将会得到证明。
文献报告fSLT术后严重并发症发生率、再移植率和手术死亡率均较高[10,12,14],Chan等[10]研究报告2003~2019年间施行的100例双成人受者fSLT,术后住院和1年死亡率高达21%和31%。近期一篇荟萃分析发现fSLT术后血管并发症为6.9%,胆道并发症25.6%,均高于全肝移植[16]。本研究49例受者中12例出现了26起Clavien-Dindo分级系统≥Ⅲ级并发症,其中2例死亡,术后严重并发症发生率为24.5%,术后住院死亡率为4.1%,近期疗效优于多数文献报告。将49例受者按相应供肝分为C组和D组进行比较,Ⅲ级及以上胆道并发症D组(0例)较C组(6例)降低(P=0.016),这与D组58.3%(13/23)的"T"管留置率有关。其他严重并发症发生率和术后死亡率比较,二组差异虽无统计学意义,但D组呈下降趋势,术后死亡1例亦与技术无关。上述结果表明经过一段时间的学习曲线,随着经验的积累,技术的改进和不断的创新,fSLT术后的严重并发症发生率和术后住院死亡率将有望进一步降低。
本研究为单中心研究,样本量小,随访时间短,需要进一步积累样本量以及对术后的受者/移植肝存活率和远期并发症做进一步随访。在体完全左、右半肝劈裂式肝移植部分解决了目前器官来源紧缺的困难,但该手术对供受者的要求高,技术复杂,术后并发症多,需要严格按照各项标准,积极稳妥开展,积累经验同时不断改进技术和创新,fSLT的疗效有望接近和达到全肝移植水平。
所有作者均声明不存在利益冲突



























