
本文报道1例60岁女性患者宫颈高级别鳞状上皮内病变累及子宫内膜及右侧卵巢表面病例,分析在子宫内膜形成浅表浸润性鳞状细胞癌的特征、鉴别诊断及相关治疗。本例免疫组织化学显示宫颈、子宫内膜、右侧卵巢表面p16均呈弥漫强阳性表达。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者女,60岁。绝经10年余,近5年自觉阴道排液,有臭味,未予重视。因近1周下腹隐痛于2021年7月5日来院就诊。阴道分泌物人乳头状瘤病毒(HPV)16阳性。宫颈活检提示高级别鳞状上皮内病变(HSIL)。遂行取出宫内节育器+宫颈锥切术。术中发现宫腔内有白色脓样分泌物流出伴异味,加做细菌培养及子宫内膜活检。宫颈锥切标本从中心呈放射状分成12块,全部取材制片并深切,2位高年资病理医师阅片显示:宫颈1周HSIL累及腺体,内、外切缘均见病变累及。子宫内膜活检提示:高级别鳞状上皮内病变,子宫内膜间质中见散在分布少量淋巴细胞和浆细胞。宫腔分泌物细菌培养无细菌生长。7周后在腹腔镜下行全子宫+双侧附件切除术。
病理检查:全子宫+双侧附件切除标本1件,全子宫大小7 cm×5 cm×4 cm,宫腔深6 cm,内膜厚0.1 cm,较平坦。肌层厚2 cm,肌壁间见肌瘤1枚,直径1.5 cm。子宫浆膜面光滑。宫颈长3 cm,外径2 cm,黏膜面灰红粗糙。双侧输卵管长7 cm,浆膜面光滑,见伞端,切面管腔无扩张;双侧卵巢大小均为3 cm×2 cm×1 cm,表面光滑,切面未见特殊。子宫颈、子宫内膜、双侧输卵管及双侧卵巢均全部取材,其中宫颈全层按照1°~12°取材12块,输卵管按照侧重伞端的输卵管全面切检法(sectioning and extensive examination of the fimbria,SEE-FIM)取材。2位高年资病理医师阅片,镜下观察:宫颈一周被覆上皮呈HSIL(图1),局部见累及腺体,HSIL向下累及宫颈外切缘,向上沿子宫内膜表面连续蔓延,播散至全部宫腔。宫腔HSIL底部可见正常子宫内膜腺体和间质(图2),其间见多灶浅表浸润性鳞状细胞癌,浸润最大深度1 mm,未见脉管内癌栓(图3)。右侧卵巢表面见小灶HSIL样病变(图4),双侧输卵管经深切后未见病变。免疫组织化学:宫颈HSIL、子宫内膜HSIL及浅表浸润性鳞状细胞癌、右侧卵巢表面HSIL样病变均显示p16弥漫强阳性表达(图5,6)。
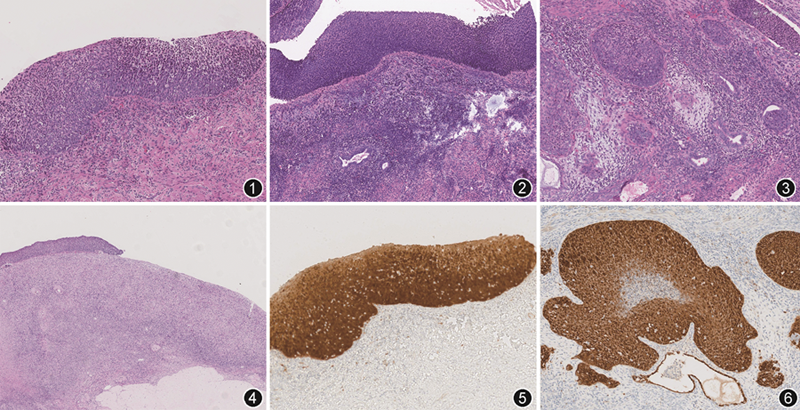

病理诊断:宫颈HSIL累及腺体,广泛浅表蔓延至子宫内膜,并累及右侧卵巢表面,子宫内膜多灶呈浅表浸润性鳞状细胞癌,浸润深度1 mm,未见脉管内癌栓,宫颈外切缘见HSIL累及。
随访:本例患者行全子宫+双侧附件切除术,术后加做放、化疗,随访9个月,患者无复发及转移。
讨论:宫颈鳞状细胞癌的主要生长方式为向宫颈纤维肌层浸润性生长至周围组织,常见的侵犯部位为宫旁组织、阴道、直肠、膀胱等,转移方式为直接侵犯或经淋巴脉管转移。宫颈HSIL或浸润性鳞状细胞癌在子宫内膜表面蔓延扩散的状况比较少见,而仅有HSIL时病变沿子宫内膜表面蔓延至远处部位更加少见。目前认为不同部位同时发生HPV相关的宫颈鳞状细胞病变的原因是HPV可以沿生殖道逆行性播散,出现下生殖道病变转移至上生殖道病变的特殊现象,即HPV感染的“场效应”[1],在此背景下病变在子宫腔内可出现多灶性、不连续生长的现象。同时宫颈的原发病变可以通过直接蔓延至子宫内膜并通过输卵管累及远处器官。本例所有部位免疫组织化学p16染色提示病变均由HPV感染造成。患者出现鳞状上皮病变从宫颈到宫腔连续播散的过程,输卵管管腔及黏膜中未见病变存在,但是在卵巢部位出现了相关原位病变,推测可能由于输卵管黏膜的种植性病变较小,虽经全面取材及深切后仍未能在切片中发现病变;或者是病变通过输卵管管腔并未种植,而直接种植于右侧卵巢表面。有研究表明放射治疗、宫颈管狭窄和宫腔积脓可能会引起这种浅表播散的生长方式[2]。宫腔积脓的本质是因为宫腔引流不畅而导致的非特异性感染的子宫内膜炎,其脓液为炎性渗出物和坏死的子宫内膜。本例宫腔分泌物行细菌培养未见细菌生长,且在子宫内膜表面未见炎性渗出物及坏死物,仅在子宫内膜间质中见少量散在分布的淋巴细胞和浆细胞,因本例有置入宫内节育器多年的病史,考虑这些炎症细胞与置入宫内节育器有关,疑似“宫腔积脓”的表现为鳞状上皮病变累及宫腔造成的假象。CD138可通过调节细胞间的相互作用参与浅表播散的过程,但是具体的分子机制尚未知晓。Kushima等[1]在宫颈鳞状细胞癌累及上生殖道的病例中进行了杂合子缺失的遗传分析,发现5例患者中4例出现了单克隆6p、6q、11p和11q频繁的杂合性缺失,这种缺失常发生于宫颈鳞状细胞癌而不出现于子宫内膜癌,提示肿瘤均起源于子宫颈;其中2例子宫内膜和其他病变的遗传分析显示出现了比宫颈病变更多的杂合性缺失,提示病变在子宫内膜处出现了遗传学进展。本例宫颈为原位病变,在子宫内膜处病变发生了浅表浸润,推测可能是有更多的分子事件参与此过程。
复习国内外相关文献,类似的宫颈鳞状上皮内病变的生长方式国外报道33例[3, 4, 5, 6],国内报道5例[7, 8, 9, 10, 11],发病年龄45~79岁,平均年龄61.6岁。国内外报道的病例均为病变从下生殖道连续性蔓延至子宫及双侧输卵管及卵巢,并未出现卵巢受累而输卵管未受累的报道。此类病变几乎都发生于绝经后女性;最常见的临床症状为绝经后阴道出血及排液、伴下腹部隐痛或不适或触及腹部包块,少见子宫积脓样改变、积水及宫颈狭窄;宫颈病变累及的范围包括子宫内膜,甚至可达输卵管及卵巢。大体检查中可见子宫内膜表面形成灰白或灰黄色条纹及斑块,病变范围广泛时可形成“糖霜”样外观。镜下子宫颈原发病灶可以是HSIL、微小浸润性鳞状细胞癌、浸润性鳞状细胞癌、腺鳞癌或湿疣性癌[11],累及子宫内膜或其他部位时可表现为原位癌或浸润性癌的不同形式,病变可以是延续的生长方式或在宫腔内跳跃式生长方式。本例病变在宫颈1周均为HSIL,在子宫内膜形成微小浸润,输卵管未见病变而在卵巢表面出现HSIL样病变,免疫组织化学p16弥漫强阳性表达提示各处病变均与HPV感染相关。
宫颈鳞状细胞癌或HSIL蔓延至子宫内膜,需要与原发性子宫内膜鳞状细胞癌进行鉴别。Fluhmann提出并由Kay[12]改进了子宫内膜原发鳞状细胞癌的诊断标准:(1)无子宫内膜腺癌并存;(2)子宫内膜肿瘤与宫颈鳞状上皮之间无连接;(3)无原发宫颈鳞状细胞癌。子宫内膜原发鳞状细胞癌罕见,发病原因尚不明确且发现时常处于晚期。国内仅有零星病例报道。当子宫内膜样癌伴大片鳞状分化,或内膜样癌低分化呈实性生长时,也需要与本病进行鉴别,广泛取材见到明确子宫内膜样癌成分是重要的鉴别要点,此外,p63结合p16等免疫组织化学指标有助于鉴别鳞状细胞癌。
宫颈HSIL浅表蔓延至子宫内膜及卵巢播散的临床病例少见,术前检查难以发现,均在全子宫切除后发现。目前国际妇产科联盟(FIGO)在宫颈癌的分期中还不包括此类病变,此类生长模式的病变应如何分期和处理尚无统一标准。在目前报道的病例中有10例有随访资料,随访时间3个月至4.5年,均无瘤生存。本例随访9个月,术后行同步放化疗,化疗方案为顺铂单药。患者一般状况良好。术后5个月细胞学检查提示非典型鳞状细胞意义不明确(ASCUS),术后7个月细胞学提示放疗后改变,HPV检测已转阴。病变浅表蔓延的患者多为绝经后女性,结合本例特征,对于宫颈HSIL或ⅠA1期的浸润性鳞状细胞癌,依据中国抗癌协会妇科肿瘤专业委员会[13]、中国优生科学协会阴道镜和宫颈病理学分会(CSCCP)[14]及2021年美国国立综合癌症网络(NCCN)[15]对宫颈癌及癌前病变的处理原则,此类病变可以首先行宫颈锥切术,若宫颈内口侧切缘为阳性时进一步行全子宫+双附件切除手术;ⅠA1期以上的浸润性鳞状细胞癌可直接进行广泛全子宫+双附件切除术+盆腔淋巴结清扫术,术后按照分期决定是否行化疗或放疗。对于绝经前女性是否在全子宫切除术同时行双附件切除术,或者在全子宫切除术后加做放疗或化疗,还需要大量病例长期随访以明确恰当的治疗方案。
赵晶晶, 后波, 朱慧庭. 宫颈高级别鳞状上皮内病变累及子宫内膜及卵巢表面1例[J]. 中华病理学杂志, 2023, 52(3): 302-304. DOI: 10.3760/cma.j.cn112151-20221018-00866.
所有作者声明无利益冲突



























