
评估经肺门入路胸腔镜肺叶切除术治疗儿童先天性肺畸形伴叶裂发育不全的安全性和有效性。
纳入2014年1月至2020年12月在四川大学华西医院小儿外科行经肺门入路胸腔镜肺叶切除术的先天性肺畸形患儿共550例,根据叶裂解剖分型将患儿分为叶裂发育不全组(IF组)和叶裂发育完全组(CF组),IF组共152例患儿,CF组共398例患儿。对两组患儿术中、术后的临床资料和手术结果进行比较与分析。连续参数数据采用t检验,连续非参数数据采用Wilcoxon检验,非连续数据采用χ2检验或Fisher确切概率法。
单因素分析显示两组患儿术中出血(P=0.02)、手术时间(P=0.01)、胸腔引流管放置时间(P<0.01)和术后住院时间(P=0.03)差异存在统计学意义。两组患儿均无术中中转开放手术;IF组有7例患儿术后出现漏气,均在安放或延长留置胸腔闭式引流管后自愈;两组均无支气管胸膜瘘、大出血、重症肺炎等严重术后并发症发生。
叶裂发育不全会增加儿童先天性肺畸形胸腔镜肺叶切除的手术难度,经肺门入路的方式可安全而有效地降低这类患儿的中转开放率和术后并发症发生率。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
先天性肺畸形(congenital lung malformations,CLM)是一系列疾病的统称,最常见的是先天性肺气道畸形(congenital pulmonary airway malformation,CPAM)与肺隔离症(pulmonary sequestration,PS)[1]。随着超声技术的发展以及产前筛查的比例的提高,近年来CLM的发病率逐年升高,据最新的流行病学统计显示,CPAM的发病率约为1/2 400[2,3]。CLM对出生后患儿的主要影响是病灶内感染以及远期发生恶变的可能[4]。因此,越来越多的研究建议CLM应在早期无症状阶段进行手术切除病灶[5]。随着小儿微创外科技术的发展,胸腔镜手术被越来越多地应用于治疗CLM患儿,取得了良好的效果并已经逐步取代传统开胸手术,常见的胸腔镜手术方式包括肺叶切除术、肺段切除术与楔形切除术等,其中全胸腔镜肺叶切除术仍然是国内外最经典且最常用的手术方式[6]。
目前在运用胸腔镜肺叶切除术治疗CLM的一些报道中,术中中转开放、术后漏气、气管胸膜瘘、术后肺炎的发生率仍然较高[7,8,9]。最新的一项多中心的临床研究显示,儿童胸腔镜肺叶切除术的中转开放率仍然高达17.6%,27.8%的患儿术后需要进入重症监护室监护[10]。出现上述问题的主要原因是叶裂发育不全[11]。叶裂发育不全并不罕见,有报道统计发现叶裂发育不全尤其是右肺水平裂不完全的发生率达17.4%~87.0%[12],在CLM患儿中,由于肺叶发育畸形,出现叶裂发育不全的现象更为常见[13]。因其毗邻结构解剖变异多,叶裂不完全增加了胸腔镜肺叶切除术的难度,少数无叶裂的肺叶融合病例的手术难度则进一步加大[14]。因此,该类患儿术中中转开放率、术后并发症率与其叶裂发育程度密切相关。
经肺门入路法可能是解决上述问题的有效手段,本研究分析采用肺门入路法胸腔镜肺叶切除的病例,评估该方法在治疗伴有叶裂发育不全的CLM患儿中的安全性和有效性。
回顾性分析2014年1月至2020年12月在四川大学华西医院小儿外科接受经肺门入路法胸腔镜肺叶切除术的550例CLM患儿的临床资料,其中男224例,女326例,平均年龄为9.3个月(5~153个月),平均体重为7.7 kg。根据叶裂的解剖学分型,1型定义为完全叶裂,2、3、4型定义为不完全叶裂[15]。1型患儿398例,2型86例,3型53例,4型13例。纳入标准为年龄<14岁,确诊为CLM的患儿。排除标准为数据缺失的患儿。根据叶裂发育情况将患儿分为不完全叶裂组(IF组)和完全叶裂组(CF组)。IF组共纳入152例患儿,CF组共纳入398例患儿。本研究经四川大学华西医院生物医学伦理审查委员会审核通过[2021年审(1306)号],患儿家长均签署了知情同意书。
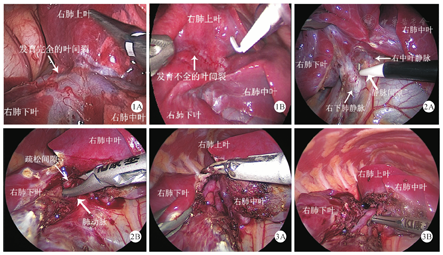
手术应用三孔胸腔镜技术,中、上叶切除术分别在腋前线第4肋间隙、腋中线第7肋间隙、腋后线第8肋间隙作操作孔;下叶切除术相对中、上叶切除术各下移1个肋间隙。在叶裂完全发育的病例中,血管支气管结构被很好地显露(图1A),而在叶裂发育不全的病例中,血管支气管结构被肺组织遮盖(图1B),手术难度较高。经肺门入路的手术方式首先在拟切除肺叶和其毗邻肺叶的两条肺静脉之间的无血管间隙中(图2A),切开发育不全的叶裂肺组织后进入肺门,在肺门的疏松间隙内显露出肺动脉主干。在肺动脉与叶裂肺组织之间游离出一个疏松间隙(图2B),并沿该间隙用LigaSure或超声刀等能量平台直接劈离叶裂肺组织(图3A)。完全劈离发育不全的叶裂肺组织后,肺动脉完全显露(图3B),即可按叶裂发育完全的病例进行肺叶切除。

Cheng等[16]的研究显示对于部分儿童胸腔镜肺叶切除术,常规安置胸腔引流管是不必要的,故本研究的病例不常规放置胸腔引流管。安置胸腔引流管的标准是发生术前肺部感染或因叶裂发育不全导致手术创面较大。拔除胸腔引流管的标准是术后水封瓶中无明显气泡溢出,复查胸部CT显示肺复张良好且无明显气液胸,否则将适当延长引流时间。
根据Clavien-Dindo手术并发症分级,Ⅰ级并发症为术后疼痛、发热、水电解质紊乱、非感染性腹泻等不需要药物、手术干预的情况;Ⅱ级并发症为需要抗生素等药物干预的情况;Ⅲa级并发症为需要胸腔穿刺术重新安置胸腔引流管的情况;Ⅲb级并发症为支气管胸膜瘘等需要二次手术的情况;Ⅳ级并发症为发生单个或多个器官功能衰竭威胁生命的情况;Ⅴ级并发症为发生死亡[17]。
应用SPSS 26.0进行数据分析。正态分布数据采用 ±s表示,偏态数据采用M(范围)表示。对连续参数数据采用t检验,连续非参数数据采用Wilcoxon检验,非连续数据采用χ2检验或Fisher确切概率法。P<0.05为差异有统计学意义。
±s表示,偏态数据采用M(范围)表示。对连续参数数据采用t检验,连续非参数数据采用Wilcoxon检验,非连续数据采用χ2检验或Fisher确切概率法。P<0.05为差异有统计学意义。
IF组和CF组患儿年龄(P=0.68)、体重(P=0.28)、性别(P=0.24)和基础疾病(P=0.11)的差异无统计学意义(表1)。两组患儿均无术中中转开放,没有支气管胸膜瘘、大出血、术后重症肺炎等严重术后并发症。IF组7例患儿出现术后漏气,适当延长引流时间后恢复良好。IF组共67例患儿放置胸腔引流管;CF组仅39例患儿放置胸腔引流管。IF组和CF组在术中出血量(P=0.02),手术时间(P=0.01),是否放置胸腔引流管(P<0.01)和术后住院时间(P=0.03)等因素的差异有统计学意义。术后并发症方面,两组无并发症和发生Ⅱ级并发症的差异有统计学意义(P<0.01),IF组2例患儿出现因术后漏气需重新留置胸腔引流管的Ⅲa级并发症。(表2)
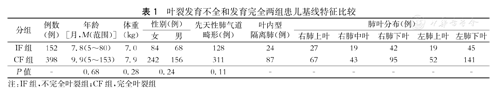
叶裂发育不全和发育完全两组患儿基线特征比较
叶裂发育不全和发育完全两组患儿基线特征比较
| 分组 | 例数(例) | 年龄[月,M(范围)] | 体重(kg) | 性别(例) | 先天性肺气道畸形(例) | 叶内型隔离肺(例) | 肺叶分布(例) | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 女 | 男 | 右肺上叶 | 右肺中叶 | 右肺下叶 | 左肺上叶 | 左肺下叶 | ||||||
| IF组 | 152 | 7.8(5~80) | 7.0 | 84 | 68 | 128 | 24 | 27 | 19 | 42 | 19 | 45 |
| CF组 | 398 | 9.9(5~153) | 7.9 | 242 | 156 | 311 | 87 | 67 | 43 | 95 | 52 | 141 |
| P值 | - | 0.68 | 0.28 | 0.24 | 0.11 | - | - | - | - | - | - | |
注:IF组,不完全叶裂组;CF组,完全叶裂组
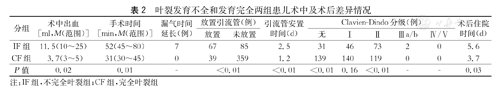
叶裂发育不全和发育完全两组患儿术中及术后差异情况
叶裂发育不全和发育完全两组患儿术中及术后差异情况
| 分组 | 术中出血[ml,M(范围)] | 手术时间[min,M(范围)] | 漏气时间延长(例) | 放置引流管(例) | 引流管安置时间(d) | Clavien-Dindo分级(例) | 术后住院时间(d) | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 放置 | 未放置 | 无 | Ⅰ | Ⅱ | Ⅲa/b | Ⅳ/Ⅴ | ||||||
| IF组 | 11.5(10~25) | 52(45~80) | 7 | 67 | 85 | 2.5 | 31 | 46 | 73 | 2 | 0 | 5.6 |
| CF组 | 3.7(3~5) | 31(30~45) | 0 | 39 | 359 | 1.2 | 139 | 140 | 119 | 0 | 0 | 3.7 |
| P值 | 0.02 | 0.01 | - | <0.01 | <0.01 | <0.01 | 0.16 | <0.01 | - | - | 0.03 | |
注:IF组,不完全叶裂组;CF组,完全叶裂组
本研究为大样本的回顾性临床研究,证明了经肺门入路法是一种治疗叶裂发育不全的安全有效方法。尽管叶裂发育不全在一定程度上会增加手术时间和术中出血,使手术难度增加,但在本研究中,没有病例中转开放或发生术中大出血、支气管胸膜瘘等并发症,也没有出现呼吸循环衰竭、死亡等术后并发症的病例,仅有7例IF组患儿出现了术后漏气,均通过重新安置或延长安放胸腔闭式引流管后自愈,说明通过肺门入路法可以有效降低叶裂发育不全患儿的手术风险。
当叶裂发育不全时,肺动脉和支气管被包埋于发育不全的叶裂肺组织内,但肺静脉起始部始终显露在外,因此以肺静脉作为标记,经相邻肺静脉起始部之间的无血管区,切开发育不全的叶裂肺组织,进入肺门间隙并找到肺动脉主干。同时,肺动脉与发育不全叶裂肺组织间也存在一个疏松间隙,可以沿该疏松间隙游离后直接劈开叶裂肺组织,达到对叶裂肺组织安全而快速处理的效果。正是这样的解剖特点,构成了肺门入路法的理论基础,也是该手术方法实际操作的核心要点。
一项对20 565例胸腔镜肺叶切除的回顾性研究显示,中转开放最主要的直接原因是术中大血管损伤(29.3%,60/205)[18]。叶裂发育不全时,由于叶裂肺组织对肺动脉的遮蔽,使血管损伤的概率大幅度增大。肺门入路法利用相邻肺静脉根部间无血管区切开叶裂肺组织,直接进入肺门并在肺门疏松间隙内找到肺动脉主干,极大增加了手术安全性,降低了大血管损伤的风险。本研究结果也显示,所有病例均无术中血管损伤导致大出血和中转开放的情况。
肺叶切除术后漏气的原因分两种,一种是肺泡性漏气,另一种是支气管胸膜瘘[19]。支气管胸膜瘘是一种严重的术后并发症,死亡率可达16%~72%[20]。叶裂发育不全时,由于叶裂肺组织对肺门处支气管的遮蔽,手术损伤发生支气管胸膜瘘的概率较大。肺门入路法可以安全地暴露并分离出肺门处支气管主干及其远端分支,达到对支气管确切处理的效果,本研究中两组患儿术后均无支气管胸膜瘘的发生。肺泡性漏气较为常见,当叶裂发育完全时,没有需要劈开的叶裂肺组织,手术创面较小,发生术后漏气的概率低;当叶裂发育不全时,手术需要沿发育不全的叶裂劈开叶裂肺组织,术后存在断面肺泡性漏气的可能性,术后漏气概率较高。Saleh等[21]的研究显示CLM患儿肺叶切除术后漏气的比例为13.24%(9/68),Style等[22]大样本的回顾性研究显示不同年龄CLM患者术后漏气的发生率约为8.2%(9/110)。而在本研究使用肺门入路法的550例肺叶切除术病例中,仅有7例出现了术后漏气,且均通过延长或重新安置胸腔引流管而自愈,提示肺门入路法能快速安全地对发育不全的叶裂肺组织进行劈离,有效降低术后漏气的发生率。
尽管叶裂发育不全会增加儿童先天性肺畸形胸腔镜肺叶切除术的手术难度,但经肺门入路法能降低该类患儿的中转开放率和术后并发症发生率。本研究评估了在叶裂发育不全的CLM患儿中经肺门入路法胸腔镜肺叶切除术的安全性与有效性,为儿童胸腔镜肺叶切除术的进一步开展与普及提供了有效的技术支撑。
所有作者均声明不存在利益冲突



























