
经导管主动脉瓣置换术(TAVR)作为国际上治疗主动脉瓣疾病的重要手段,在我国有着起步晚、发展迅速的特点。在临床普及的过程中,由于缺乏标准化的指南及培训,为该技术在我国的推广带来了挑战。为了规范TAVR技术的应用及提高医疗质量,国家心血管病中心及国家结构性心脏病介入质控中心联合中华医学会心血管病学分会及中华医学会胸心血管外科学分会共同成立TAVR临床实践指南联合专家组,结合国际指南推荐意见和中国临床实践现状,整合国内外最新的循证医学证据,在广泛征求意见的基础上制订了《经导管主动脉瓣置换术临床实践指南》。指南包括编写方法、流行病学特点、TAVR器械、心脏团队的要求、TAVR适应证推荐、围手术期多模态影像学评估、手术操作流程、TAVR术后抗栓策略、并发症的防治、术后康复及随访、局限性及展望十一个部分,旨在为各级临床医师提供合理的推荐和建议。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
经导管主动脉瓣置换术(transcatheter aortic valve replacement,TAVR),或称经导管主动脉瓣植入术(transcatheter aortic valve implantation,TAVI),是通过介入导管技术将人工主动脉瓣膜送至主动脉根部并释放固定,替代病变主动脉瓣功能的微创治疗技术。自2002年诞生以来,TAVR在国际上得到广泛应用,其安全性和有效性已被多项大型前瞻性随机对照研究所证实[1]。因其无需开胸、心脏停跳和体外循环等优点,TAVR成为无法实施外科手术或手术高危的重度主动脉瓣狭窄(aortic stenosis,AS)和(或)主动脉瓣关闭不全(aortic regurgitation,AR)患者的有效选择[2, 3]。近年来,随着外科中危和低危AS患者TAVR循证证据的积累,最新的欧美瓣膜性心脏病患者管理指南已经不再按外科危险分层来选择AS患者的手术方式,而将年龄和预期寿命作为是否选择TAVR的主要因素[4, 5]。
我国于2017年开始陆续有国产及进口TAVR器械上市,虽然TAVR技术的开展晚于国际水平,但是临床应用数量快速增长,并已开始在各级医院逐步开展。在临床普及的过程中,由于缺乏标准化的指南及培训,且我国患者存在一些不同于欧美患者的独有特点,为TAVR技术在中国的推广带来了挑战。为了规范TAVR技术的应用及提高医疗质量,国家心血管病中心及国家结构性心脏病介入质控中心联合中华医学会心血管病学分会及中华医学会胸心血管外科学分会共同成立TAVR临床实践指南联合专家组,结合国内外最新研究结果,在广泛征求意见的基础上制订了TAVR临床实践指南(以下简称“本指南”)。本指南适用于所有临床医师,尤其是内科(心内科、神经内科、呼吸与重症医学等)、外科(心外科等)、麻醉科、体外循环科、影像科、超声科及其他与主动脉瓣疾病诊疗和管理相关学科的专业人员。推荐意见的应用目标人群为常见主动脉瓣疾病患者。
联合专家组参考国内外 TAVR的相关研究、指南和临床实践标准,主要回顾2000年1月至2022年4月发表的文献资料,并检索国内外的主要电子数据库,包括 PubMed、中国知网和万方数据库,检索词包括“aortic stenosis”“aortic regurgitation”“transcatheter aortic valve replacement”“transcatheter aortic valve implantation”“主动脉瓣狭窄”“主动脉瓣关闭不全”“经导管/经皮”“介入”及与各主动脉瓣疾病相关的评估、检测和治疗等内容的关键词。
本指南设计与制订步骤依据2015 年《世界卫生组织指南制订手册》[6]、2016年《中华医学杂志》发表的《制订/修订<临床诊疗指南>的基本方法及程序》[7]及2022年《中华医学杂志》发表的《中国制订/修订临床诊疗指南的指导原则(2022版)》[8],推荐意见采用推荐强度和证据等级相结合的方法,推荐强度和证据等级采用推荐分级的评估、制订与评价(Grading of Recommendations Assessment,Development and Evaluation,GRADE)分级系统[9](表1、2)。推荐意见采用专家一致性原则,存在不同专家意见时,采用投票超过2/3的专家意见。同时,借鉴和参考了国内外现有TAVR介入治疗相关研究、临床指南和专家共识,指南相关的一些重要内容可能并不能在既往文献中找到理想依据,则需要联合专家组基于临床经验进行投票。

GRADE分级系统推荐强度的说明与表示方法
GRADE分级系统推荐强度的说明与表示方法
| 推荐强度 | 推荐强度说明 | 本指南表达方法 | 推荐强度表示方法 |
|---|---|---|---|
| 强推荐 | 干预措施明显利大于弊 | 推荐 | 1 |
| 弱推荐 | 干预措施可能利大于弊 | 建议 | 2 |
| 弱推荐反对 | 干预措施可能弊大于利或利弊关系不明确 | 不建议 | 2 |
| 强推荐反对 | 干预措施明显弊大于利 | 不推荐 | 1 |
注:GRADE为推荐分级的评估、制订与评价

GRADE分级系统证据质量分级与定义
GRADE分级系统证据质量分级与定义
| 质量等级 | 定义 |
|---|---|
| 高(A) | 非常确信真实值接近观察值 |
| 中(B) | 对观察值有中等程度信心:真实值有可能接近观察值,但仍存在两者不同的可能性 |
| 低(C) | 对观察值的确信程度有限:真实值可能与观察值不同 |
| 极低(D) | 对观察值几乎没有信心:真实值很可能与观察值不同 |
注:GRADE为推荐分级的评估、制订与评价
西方国家流行病学调查结果显示,主动脉瓣疾病的患病率高,常伴随心室重构及升主动脉增宽,临床预后较差。AS患病率在≥75岁的人群中达到2.5%,在>85岁的人群中可达8%,仅次于高血压和冠心病,是常见的心血管疾病之一,主要病因为退行性主动脉瓣钙化,其次为风湿性瓣膜病。研究显示,AS患者出现症状后不及时干预,中位生存期仅为2~3年[10]。导致欧美人群AR的主要病因依次是:瓣叶退行性变、二叶式主动脉瓣(bicuspid aortic valve,BAV)、感染性心内膜炎、风湿性瓣膜病、自发性主动脉根部扩张、马方综合征等[10]。
我国主动脉瓣疾病的发病呈以下特点:(1)风湿性瓣膜病及BAV是我国AS的主要病因,但AS患病率明显低于国外;(2)虽然AS患者中BAV的比例与国外接近,但BAV患者中Type 0型(无嵴型)的比例显著高于国外;(3)AS患者二叶瓣钙化程度较国外高,股动脉内径较细;(4)AR较AS患病率更高[11, 12, 13, 14]。
按植入途径可将TAVR器械分为经外周血管途径及经心尖途径两类,目前TAVR器械主要分为自膨胀式及球囊扩张式两类。
1. 自膨胀式TAVR瓣膜:目前上市器械包括 Venus-A系列、Vita-Flow系列、Taurus系列、J-Valve瓣膜、Corevalve、Evolut系列。部分瓣膜有可回收类型,可重复收放。自膨胀式瓣膜多为长支架设计,通过可回收解决定位不良问题。
2. 球囊扩张式瓣膜:目前Sapien 3瓣膜已批准上市,多款国产器械正在进行临床研究。球囊扩张式瓣膜具有可调节的输送系统,可调整与升主动脉同轴,球囊扩张式瓣膜具有较短的支架,方便后期进行冠状动脉介入治疗。
建议TAVR在改良的心导管室或杂交手术室进行,建立包含心内科、心外科、麻醉、体外循环、影像、超声、监护、护理、血管外科等的多学科团队(multidisciplinary team,MDT)[15]。
心内科要求能规范开展心血管内科临床诊疗工作,床位不少于40张,其技术水平达到心血管内科专业科室的技术标准。心血管外科要求能规范开展心血管外科临床诊疗工作,床位不少于20张,其技术水平达到心血管外科专业技术标准[16]。
改良的心导管室/杂交手术室建议:(1)符合放射防护及无菌操作条件。(2)配备符合心血管介入诊疗功能要求的心血管造影机,影像质量和放射防护条件良好;具备医学影像图像管理系统。(3)有主动脉内球囊反搏设备。(4)能够进行心、肺、脑抢救复苏,有氧气通道、麻醉机、除颤器、吸引器等必要的急救设备和药品。具备急诊体外循环手术能力。(5)有相应的器械耗材和药品的管理设施、管理人员、管理制度[16]。
重症监护室:(1)设置符合规范要求,病床不少于6张,每病床净使用面积不少于15 m2,能够满足心血管疾病介入诊疗技术临床应用专业需要。(2)符合心血管内科或心血管外科等相关科室危重患者救治要求。(3)有呼吸机和多功能监护仪等设备。(4)能够开展有创监测项目和有创呼吸机治疗。(5)有经过专业培训并考核合格的专职医护人员[16]。
其他辅助科室和设备:(1)能够利用多普勒超声心动诊断设备进行常规检查和无创性心血管成像与血流动力学检查。(2)有CT和医学影像图像管理系统。(3)有经过专业培训并考核合格的体外循环医护人员及相应的体外循环设备[16]。
独立开展TAVR介入诊疗的医师,应当同时具备以下条件:(1)执业范围为内科、外科或其他与开展心血管介入诊疗技术相适应的临床专业。(2)从事心血管疾病介入诊疗临床工作不少于5年。累计独立完成心血管疾病介入诊疗操作不少于200例。(3)经过符合要求的心血管疾病介入诊疗技术培训基地系统培训并考核合格[16]。
医疗机构应当制定本机构的手术分级管理目录。严格遵守心血管疾病介入诊疗技术操作规范和诊疗指南,严格掌握心血管疾病介入诊疗技术的适应证和禁忌证。实施TAVR介入诊疗技术应当由高年资主治医师(5年以上)及以上专业技术职务任职资格的本机构执业医师决定,术者由符合要求的医师担任。术前应当根据影像评估实验室的评估报告制订手术方案和患者管理方案,明确预防并发症的措施。医疗机构和医师应当按照规定接受TAVR介入诊疗技术的临床应用能力评估,包括病例选择、影像评估、手术成功率、严重并发症、死亡病例、医疗不良事件发生情况、术后患者管理、随访情况和病历质量等[16]。
参考2020年美国心脏病学会(American College of Cardiology,ACC)/美国心脏协会(American Heart Association,AHA)瓣膜病管理指南及2021年欧洲心脏病学会(European Society of Cardiology,ESC)/欧洲心胸外科学会(European Association for Cardio-Thoracic Surgery,EACTS)瓣膜疾病指南及中国TAVR临床证据[11, 12, 13, 14,17, 18],本指南对主动脉瓣膜病变治疗做出如下推荐(表3,图1)。

重度AS患者的治疗策略
重度AS患者的治疗策略
| 特征 | <65岁 | 65~80岁 | >80岁 |
|---|---|---|---|
| 有症状的重度AS | 或预期寿命>20年首选SAVR | 考虑预期寿命及耐久性的情况, 选择SAVR或TAVR | 或预期寿命<10年首选TAVR |
| 无症状的重度AS且LVEF<50% | 或预期寿命>20年首选SAVR | 考虑预期寿命及耐久性的情况, 选择SAVR或TAVR | 或预期寿命<10年首选TAVR |
| 根部结构、血管条件或其他情况不适合TAVR | 首选SAVR | 首选SAVR | 首选SAVR |
| 高危患者且预期寿命≥1年 | 首选TAVR | 首选TAVR | 首选TAVR |
| 高危患者且预期寿命<1年 | 对症支持治疗 | 对症支持治疗 | 对症支持治疗 |
注:AS为主动脉瓣狭窄;LVEF为左心室射血分数;TAVR为经导管主动脉瓣置换术;SAVR为外科主动脉瓣置换术;高危患者指美国胸外科医师协会(STS)评分≥8%或虚弱指数≥2或其他严重影响外科手术的情况[如气管造口术、严重钙(瓷)化升主动脉、胸部畸形、冠状动脉移植物黏附在后胸壁及辐射损伤]
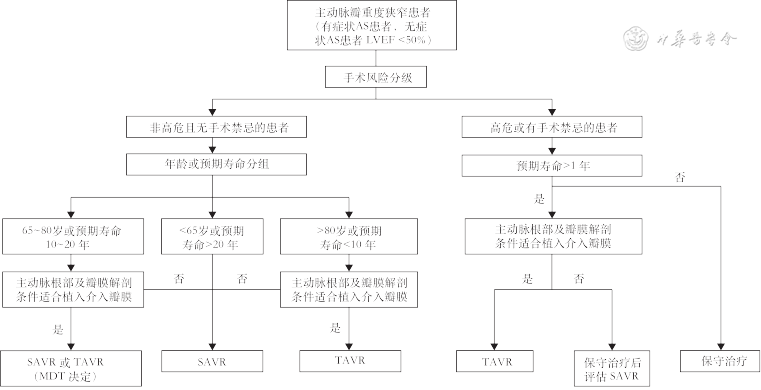

注:AS为主动脉瓣狭窄;LVEF为左心室射血分数;SAVR为外科主动脉瓣置换术;TAVR为经导管主动脉瓣置换术;MDT为多学科团队
1. 有临床干预指征,拟行TAVR的患者:需经影像评估实验室评估主动脉根部及瓣膜解剖条件适合植入介入瓣膜,否则推荐外科主动脉瓣置换术(surgical aortic valve replacement,SAVR)(推荐,证据级别A)。
2. 有TAVR指征但外周血管入路限制的患者:推荐SAVR(推荐,证据级别A)或建议经心尖等其他替代路径TAVR(建议,证据级别C)。
3. 有症状的重度AS患者:(1)年龄>80岁或≤80岁但预期寿命<10年,且无经股动脉入路实施TAVR的解剖学限制,推荐股动脉入路TAVR[4, 5,19, 20](推荐,证据级别A)。(2)年龄65~80岁,TAVR与SAVR均可选择,具体决策须由多学科讨论后由医患共同决定,需要综合考量瓣膜耐久性、患者预期寿命和手术风险等因素[21, 22, 23, 24, 25, 26, 27](推荐,证据级别A)。考虑到生物瓣膜耐久性、我国人均寿命和医保政策,年龄65~70岁者倾向于SAVR,70~80岁者倾向于TAVR。(3)如果患者年龄<65岁或预期寿命>20年,只要有瓣膜置换干预指征,推荐SAVR[28, 29, 30, 31](推荐,证据级别 A)。(4)对于美国胸外科医师协会(Society of Thoracic Surgeons,STS)评分≥8%或虚弱指数≥2或其他严重影响外科手术的情况,如果患者TAVR术后预期有≥1年的有质量生活,可不受年龄限制,推荐行TAVR[32, 33, 34, 35](推荐,证据级别A)。(5)对于TAVR或SAVR术后预期寿命<1年,或术后生活质量提高有限的患者,推荐行保守治疗(推荐,证据级别C)。
4. 无症状的重度AS患者:(1)左心室射血分数(left ventricular ejection fractions,LVEF)<50%且无经股动脉入路TAVR解剖学限制的患者,SAVR与TAVR之间的选择参考有症状的重度AS患者的推荐(推荐,证据级别B)。(2)患者运动试验异常,主动脉瓣压差快速进展,脑钠肽(brain natriuretic peptide,BNP)为正常值3倍以上者,鉴于目前TAVR证据不足,建议行SAVR治疗(建议,证据级别B)。(3)LVEF≥50%,如患者年龄<65岁或预期寿命>20年,只要有瓣膜置换指征,推荐SAVR(推荐,证据级别 A)。
5. 特殊情况:(1)对于BAV患者,干预指征参考三叶式主动脉瓣,需要在经验丰富的瓣膜中心进行患者个体化评估,并由两位以上独立术者共同决定是否行TAVR(推荐,证据级别B)。(2)对于单纯AR患者,我国是目前少数拥有上市TAVR瓣膜产品的国家,队列研究提示了较为满意的中期临床结果。对于有外科干预指征的主动脉瓣三叶瓣患者,如果外科高危,且患者TAVR术后预期有≥1年的有质量生活,建议TAVR(建议,证据级别C)。(3)对于外科高危或不能行外科手术的主动脉瓣生物瓣衰败患者,经MDT综合评估后,建议行瓣中瓣TAVR(建议,证据级别B)。(4)对于危重症AS患者,建议先行主动脉瓣球囊扩张术,作为SAVR或TAVR的过渡治疗(建议,证据级别C)。
术前影像学评估是判断TAVR手术解剖适应证和制定手术技术策略的关键,术前心电门控心血管增强多排螺旋CT(MDCT)检查及经胸超声心动图(transthoracic echocardiography,TTE)或经食管超声心动图(transesophageal echocardiography,TEE)检查能够提供重要的影像数据进行精准评估,尤其是MDCT已成为TAVR术前评估患者主动脉根部解剖结构和血管入路,制定手术方案的重要依据[36, 37, 38, 39, 40]。
MDCT目前作为术前评估的重要手段,可以明确:(1)主动脉瓣虚拟瓣环尺寸;(2)主动脉瓣膜形态、钙化情况;(3)主动脉窦部、窦管交界处、升主动脉内径、形态和钙化情况;(4)左心室流出道形态和钙化程度;(5)冠状动脉开口高度;(6)主动脉瓣环最佳造影投射角度;(7)外周血管解剖结构,以备不同入路选择[41]。
根据MDCT的结果进行解剖重建和TAVR的术前评估,目前认为心室新鲜血栓、左心室流出道严重梗阻、主动脉根部解剖形态不适合(如合并夹层、瓣环过大、冠状动脉堵塞风险高等)为TAVR的禁忌证。
对于不能耐受CT检查和急诊手术患者,超声心动图可作为术前主动脉根部解剖评估及入路评估的主要手段。TTE和TEE可评估心脏形态及功能、瓣膜功能及解剖、主动脉根部尺寸和解剖、有无合并血栓及心内膜炎[42]。
TAVR术中通过TEE结合主动脉根部造影来判断人工瓣膜位置、功能及瓣周漏情况,判断有无冠状动脉开口阻塞、人工瓣膜瓣周漏、升主动脉有无夹层,并评价二尖瓣反流、心包积液及左右心室舒缩功能状况等。
近年来随着3D打印技术的进步,术前基于MDCT或三维TEE获得影像数据,进行3D打印实物测量评估并进行体外模拟评估等手段成为更优的术前评估手段。3D 打印技术的引入,可以根据影像数据,完成计算机建模,采用不同硬度和弹性材料,打印出仿真主动脉根部结构模型,该模型不仅能立体多层面地展示升主动脉、冠状动脉开口、主动脉瓣环(虚拟瓣环/解剖瓣环)、主动脉瓣叶、主动脉窦部、左心室流出道的形态和病变情况,还可以进行动态体外模拟操作、临床培训及并发症预测[43, 44]。
TAVR手术建议在导管室或杂交手术室进行,根据患者及团队情况,选择全身麻醉或局部麻醉的方式。术前推荐常规备血。推荐具备进行急诊外科手术及急诊建立体外循环手术的条件。
1. 消毒铺巾:放置体表除颤电极于右肩背部和左肋弓前下方区域。碘伏消毒术野,铺无菌巾暴露手术入路,胸骨正中切口消毒备用。
2. 置入临时起搏导管:经颈静脉、锁骨下静脉或股静脉置入临时起搏导管至右心室心尖部,调试好起搏器备用。
3. 建立血管入路:选择主入路血管穿刺并以血管缝合器预留缝线,血管条件不理想可外科切开暴露血管穿刺。置入6 F(1 F=1/3 mm)股动脉鞘管,扩张皮肤及皮下组织。交换8~10 F股动脉鞘管,后沿主入路置入6 F猪尾巴导管至主动脉弓降部,交换置入加硬支撑导丝。撤出猪尾巴导管和股动脉鞘管,沿加硬导丝缓慢置入大鞘,鞘管型号由植入的瓣膜型号和患者外周血管直径共同决定。另一侧股动脉作为副入路,穿刺留置6 F股动脉鞘,术中造影使用,副入路股动脉条件不好时可以经桡动脉置入猪尾巴导管备用或使用单入路。
4. 跨瓣并测压:选择合适投照角度,一般选用5 F或6 F的冠状动脉造影导管(AL1、AL2、JR4等)跨瓣,配合直头导丝。跨瓣成功后,交换猪尾巴导管,连接压力传感器测左心室压力,计算跨瓣压差并记录,或者可以使用超声检测跨瓣压差。随后,置入预塑形的超硬导丝,确保其导入左心室后获得稳定的支撑形态。
5. 球囊预扩张:如果需要球囊扩张,应选定合适尺寸的球囊,经主入路沿超硬导丝将球囊置入主动脉瓣位置,经副入路置入猪尾巴造影导管于主动脉根部连接高压注射器,检查确认起搏器、除颤器、压力泵等均可正常工作。起搏180次/min,收缩压降至50 mmHg(1 mmHg=0.133 kPa)左右,快速充盈球囊,待球囊于主动脉瓣位置完全充盈,通过副入路猪尾巴导管行主动脉根部造影。造影完成后,迅速完全回抽球囊,停止起搏,将球囊撤至升主动脉,观察患者血压、心率,必要时可给予血管活性药物,如出现心室颤动应及时除颤。
6. 置入输送系统:确定瓣膜型号,经主入路沿超硬导丝置入装载好的瓣膜输送系统,瓣膜输送系统头端跨过主动脉瓣进入左心室后,根据术者习惯调整至右窦居中或左冠切线位等释放体位,确认猪尾巴造影导管位于无冠窦最底部,调整瓣膜支架底端预定位置平齐猪尾巴导管下缘,确保瓣膜预置初始位置良好。
7. 瓣膜释放:术者的主要任务是稳定瓣膜释放过程中输送系统位置,保证瓣膜不发生严重移位,助手配合术者进行释放。释放中,助手首先将输送系统外鞘回撤至露出瓣膜底端,至瓣膜底端开始膨胀前,再次造影确定瓣膜初始位置良好。可根据血压情况进行120~180次/min快速起搏,确保在较低血压时释放,使瓣膜释放过程尽量稳定。逐步释放至瓣膜底端完全贴壁后,人工瓣膜阻挡主动脉瓣口,此时血压明显下降,稳定瓣膜,快速释放至2/3位置,停止起搏。如果使用可回收瓣膜系统,可再次造影确认瓣膜位置,瓣膜位置不理想时可在快速起搏下回收瓣膜重新调整位置,按前述步骤再次释放;当位置理想时,释放瓣膜尾端,完成释放。瓣膜完全释放后,撤出输送系统,保留超硬导丝,交换猪尾巴导管至左心室进行测压,测量跨瓣压差并记录。其后猪尾巴导管置于主动脉瓣上造影,确认是否存在瓣周漏及冠状动脉显影情况,必要时可进行后扩或置入瓣中瓣。
8. 入路关闭:手术结束前常规血管造影排除入路血管并发症。对穿刺血管预留缝合线实施缝合或对切开血管实施外科缝合闭合。常规检测下肢动脉搏动情况。
1. 术前准备:建议放置体表除颤电极于右肩背部和左肋弓前下方区域,置入临时起搏导线至右心室心尖部调试备用。
2. 心尖切口操作:左侧锁骨中线至腋前线第5~6肋间隙,透视下确定心尖位置逐层切开,显露心包,剔除心包外的脂肪。横行切开心包并悬吊显露心尖。确定心尖部无冠状动脉裸区,两根2-0或3-0聚丙烯线带毛毡垫片做两圈直径8~10 mm四边形或六边形荷包,避免损伤冠状动脉。确认无明显出血后,静脉给予1 mg/kg肝素,股动脉穿刺置入6 F股动脉鞘,经股动脉鞘置入猪尾巴造影导管至主动脉根部造影。
3. 心尖穿刺和导丝置入:取合适投照角度,主动脉根部造影确认瓣膜形态及反流情况。荷包中点穿刺心尖置入5 F穿刺鞘于左心室,指引导管配合泥鳅导丝经穿刺鞘置入左心室,跨越主动脉瓣,将导管远端置于腹主动脉的肾动脉平面以下,交换超硬导丝,注意避免导丝头端进入腹腔分支血管。TEE确认导丝未缠绕二尖瓣腱索,随后撤出穿刺鞘,交换14~16 F鞘管进行心尖入路预扩张。
4. 球囊预扩张:对于AS患者,经心尖置入瓣膜系统前,需要选择适当球囊进行预扩张;对于AR患者则无需本操作步骤。
5. 置入瓣膜输送系统:确定瓣膜型号后,经心尖入路置入装载好的瓣膜输送系统。透视下,将输送系统头端送至升主动脉,确认瓣膜及定位键均位于主动脉瓣上。
6. 瓣膜释放:确认输送系统与主动脉瓣及升主动脉良好同轴后,释放定位键,微调定位键方向,使3个定位键正对左、右、无冠3个窦底,缓慢回撤系统,超声及透视下观察定位键入窦,下降瓣膜仓至定位键中心位置,主动脉根部造影确认后释放瓣膜,确认位置良好后松开释放键。
7. 输送系统撤出:调整输送系统同轴性,操作旋钮关闭瓣膜仓,经心尖撤出输送系统并收紧心尖荷包。
8. 造影确认:造影及TEE评估瓣膜位置、瓣周漏、瓣膜跨瓣压差,必要时快速起搏下行球囊后扩张。
9. 关闭心尖切口:控制血压,荷包线逐一打结,心尖荷包打结应适度,避免荷包缝线过紧切割心肌组织,腋后线放置胸腔引流管,肋间严密止血,逐层关闭切口。根据患者个体条件和术者团队经验选择是否进行鱼精蛋白中和。
球囊扩张式瓣膜采用短支架、球囊扩张式设计,常采用经股动脉入路,也可经心尖入路。不同入路准备及操作流程分别与自膨胀式瓣膜和心尖入路瓣膜大致相似,主要区别在于瓣膜的定位和释放。
球囊扩张式瓣膜释放过程一次成形,不可回收。输送系统头端跨瓣后,回撤外套管露出瓣膜支架,后缓慢回撤输送系统。调节输送系统的调弯装置使瓣膜支架在主动脉瓣环平面保持同轴。调整瓣膜支架至适当的初始位置。此过程以副入路猪尾标记导管及主动脉根部造影辅助确认,借助球囊与瓣膜支架中点标识协助定位(标识点与无冠窦或右冠窦底标记导管平齐)。于180次/min快速起搏下,使收缩压降至50 mmHg左右后,术者稳定输送系统,助手快速充盈球囊使瓣膜支架打开固定于主动脉瓣环后,回抽球囊,停止快速起搏,术后使用超声、术中造影确认瓣膜、冠状动脉及瓣周漏等情况,必要时可进行后扩。手术结束前常规血管造影排除入路血管并发症。对穿刺血管预留缝合器实施缝合或对切开血管实施外科缝合闭合。常规检测下肢动脉搏动情况。
抗栓治疗是人工瓣膜置入后预防瓣膜血栓形成及栓塞的重要手段,TAVR术后抗栓治疗必须考虑患者的个体情况,并平衡血栓与出血的风险。以生物材料及金属支架为主要构成的TAVR瓣膜,其抗栓治疗亦可参考SAVR的方式。本指南参考美国2020 ACC/AHA瓣膜疾病管理指南、2021 ESC/EACTS瓣膜疾病指南及我国专家共识与临床实际情况,综合考虑内、外科在常规临床工作中抗凝药物使用及管理经验上的差异,对目前TAVR术后抗栓策略做出如下推荐(图2、3)。
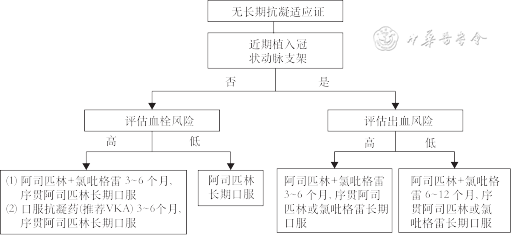

注:VKA为维生素K拮抗剂
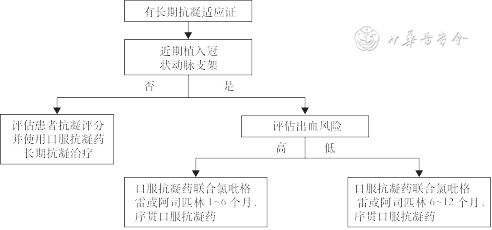

1. 无长期抗凝适应证的患者:(1)TAVR术后推荐长期口服阿司匹林75~100 mg/d抗血小板治疗(推荐,证据级别A)[45, 46, 47, 48, 49]。(2)血栓风险较高的患者建议采用阿司匹林75~100 mg+氯吡格雷75 mg/d双联抗血小板药物3~6个月(具体时间根据出血及血栓风险调整),此后改为单联抗血小板药物(推荐阿司匹林75~100 mg/d)长期抗血小板治疗(建议,证据级别B)[45, 46, 47, 48, 49]。(3)血栓风险高的患者,建议采用SAVR术后抗栓方案:维生素K拮抗剂(vitamin K antagonist,VKA)华法林抗凝3~6个月后,单联抗血小板药物(推荐阿司匹林75~100 mg/d)长期抗血小板治疗(建议,证据级别B)[50, 51, 52, 53, 54, 55]。(4)合并冠心病且近期行经皮冠状动脉介入治疗(percutaneous coronaryintervention,PCI)患者:建议采用口服阿司匹林75~100 mg/d+氯吡格雷75 mg/d双联抗血小板药物3~12个月(具体时间根据出血及血栓风险调整),后改为单联抗血小板药物,阿司匹林75~100 mg/d或氯吡格雷75 mg/d长期抗血小板治疗(建议,证据级别B)[46, 47, 48, 49]。(5)TAVR术后不推荐阿司匹林联合利伐沙班抗凝(不推荐,证据级别B)[56]。
2. 对于合并心房颤动(atrial fibrillation,AF)等长期抗凝适应证的患者:(1)推荐终身口服抗凝药,并可以依据患者CHA2DS2-VASc评分,使用VKA或新型口服抗凝药进行抗凝治疗(推荐,证据级别B)[57]。(2)合并急性冠状动脉综合征或近期行PCI且需要抗血小板治疗的患者,应充分评估其血栓及出血风险:如果患者出血风险低,推荐给予口服抗凝药(优先推荐VKA)联合抗血小板治疗(优先推荐氯吡格雷75 mg/d)6~12个月,出血风险较高的患者,建议缩短抗血小板治疗时间至1~6个月(建议,证据级别B)[58, 59, 60, 61, 62]。
对于口服VKA抗凝的患者,进行严格的国际标准化比值(international normalized ratio,INR)监测(包括便携式INR监测)及患者教育,在患者的抗凝管理中至关重要(推荐,证据级别A)[63]。
动态监测及观察患者的抗栓治疗效果及不良反应,尤其强调通过影像学技术及时诊断及发现TAVR术后抗栓治疗下的瓣叶血栓形成,其可导致跨瓣压差的增加甚至瓣膜衰败。如果患者出现瓣叶血栓形成,在评估下一步治疗方式前,建议将VKA作为抗凝方案的基础用药(建议,证据级别B)[50, 51,64, 65]。
包括外周血管病变、慢性肾脏病、获得
性血小板减少等情况,后者主要包
括高脂血症、易栓症、左心耳血栓、合
并AF等情况(推荐,证据级别A)。
瓣周漏是TAVR术后的主要并发症之一,与主动脉瓣疾病的病理解剖及TAVR手术原理、器械类型及植入方式等相关。术前根据影像资料进行充分有效的评估,并选择适合的TAVR瓣膜类型和型号,是减少瓣周漏发生的重要手段。释放后瓣膜不完全扩张是瓣周漏发生的重要原因,针对这种情况可结合术后跨瓣压差测量的结果,选用适当型号的球囊进行后扩张,改善瓣膜扩张形态、贴壁情况等[66]。对于瓣膜植入位置过深导致的瓣周漏,如果超声及主动脉根部造影提示瓣膜位置过深及瓣周散在多束反流,可考虑植入“瓣中瓣”减少瓣周漏。由于二叶瓣畸形、不规则钙化等解剖因素导致的位置固定且局限的瓣周漏,可在TAVR同期行介入封堵治疗[67]。对于释放瓣膜位置过高、移位等情况导致的难以纠正的中大量瓣周反流,可能影响患者血流动力学稳定,应考虑中转开胸手术行外科主动脉瓣置换。
TAVR术后心律失常主要包括房室传导阻滞(atrioventricular block,AVB)及术后新发AF等[68, 69]。
1. AVB:对于术后发生不同程度AVB患者应保留临时起搏电极48 h以上,同时给予药物治疗。如果是一过性AVB,并不要求植入永久起搏器,目前尚无证据显示TAVR术后高度AVB的患者是否应预先植入永久起搏器。一般而言,观察期限为术后1~2周,如果心律失常未见好转,建议植入永久起搏器。TAVR术后迟发性AVB也有报道,一般在术后1个月内多见,可视心律情况行永久起搏器植入。
2. 术后新发AF及处理策略:对于术后新发AF的治疗主要以药物控制心室率为主,同时给予规范抗凝治疗。如果超声心动图等检查排除心脏器质性问题,患者心悸、胸闷症状较明显,药物控制不佳者,可后期行AF射频消融治疗。对于术后持续性AF,有长期抗凝禁忌者,为预防血栓栓塞等并发症,可选择左心耳封堵治疗。
研究显示,接受TAVR的患者中有15%以上合并需要血运重建手段干预的冠心病[70]。多项研究显示在TAVR术前分期完成PCI或者与TAVR同期完成PCI均是可行的,且临床结果相似[71]。但对于LVEF<30%或STS评分>10%者,PCI风险明显增加,建议如果选择同期PCI,可考虑术中先给予主动脉瓣球囊扩张改善血流动力学后再行PCI。
对于术前影像学评估冠状动脉阻塞风险较高的患者,如无经心尖TAVR禁忌,可考虑经心尖TAVR,一定程度上减小了冠状动脉开口阻塞的风险。如采用长瓣架自膨胀式瓣膜,可在瓣膜植入前冠状动脉内预置导丝、球囊或支架进行冠状动脉保护,瓣膜释放后即刻行主动脉根部造影明确冠状动脉血流情况,必要时可行血管内超声检查,如出现冠状动脉开口阻塞表现,即刻行冠状动脉开口球囊扩张或支架植入(冠状动脉开口烟囱技术)[72, 73]。
如术前未预置冠状动脉保护措施,瓣膜释放后造影提示冠状动脉阻塞,应迅速尝试开通冠状动脉。特别是患者因急性冠状动脉缺血出现循环不稳定时,应尽快中转开胸行冠状动脉旁路移植术或在体外循环下取出TAVR瓣膜行SAVR。对于术前评估冠状动脉风险极高或术中经球囊预扩张评估冠状动脉阻塞高风险的患者,应行外科手术治疗。
瓣膜移位是相对常见的并发症。如果采用新一代可回收输送系统,在确认瓣膜植入位置不当或植入过程中发生移位时,可将瓣膜回收至输送系统重新定位释放。如采用不可回收输送系统,在瓣膜植入位置过深时,瓣膜释放后瓣周漏发生率较高,可考虑采用“瓣中瓣”方式进行补救。如瓣膜植入位置过高,超过主动脉瓣环平面,瓣膜释放后发生瓣周漏、冠状动脉开口梗阻风险较大,此时可将未完全释放的瓣膜拖至降主动脉胸段释放,后重新装载新的瓣膜完成定位释放。如瓣膜释放后确认瓣膜位置较高,甚至在主动脉瓣上,如患者无冠状动脉梗阻,血流动力学稳定,也可采用“瓣中瓣”技术,在该瓣膜下方重新定位释放“瓣中瓣”进行补救。如瓣膜明显移位至主动脉瓣环以上遮挡冠状动脉开口,或移位至左心室过深影响二尖瓣开闭,则需要中转外科手术处理。瓣膜植入术后也有可能发生晚期瓣膜移位。如术后出现血流动力学波动、舒张压降低、心电图变化等,应考虑瓣膜移位可能,此种情况下应行超声、CT、造影等检查明确瓣膜位置,必要时需再次介入手术或行外科手术处理。
经心尖入路短支架瓣膜术中如发生移位,除过深进入升主动脉,过浅进入左心室外,还有侧翻可能。轻度的瓣膜移位,瓣膜靠近主动脉瓣环平面(过浅),可考虑植入“瓣中瓣”进行补救。如瓣膜完全进入升主动脉内,有遮挡冠状动脉开口风险等情况,可选用适当球囊沿加硬导丝置入瓣膜内,将其送至降主动脉胸段安全位置后用球囊扩张固定支架,但应注意升主动脉、主动脉弓部均有足够瓣膜支架释放空间且无粥样硬化,避免操作过程中造成动脉夹层或斑块脱落等严重并发症。对于移位至左心室或升主动脉内难以纠正的瓣膜移位,应尽快中转外科手术治疗[74]。
术前除对瓣膜及主动脉根部解剖结构进行评估分析外,对患者血管条件的评估分析也非常重要,需重点了解主动脉,特别是升主动脉及主动脉弓部的粥样硬化及钙化斑块情况。如血管粥样硬化严重,斑块脱落风险较大,应在术中谨慎操作导管导丝,可采用脑保护装置来减少脑血管事件的发生,还需要在术中充分抗凝,减少微血栓形成,并在植入前做好输送器的排气工作。根据研究报道,使用经导管脑保护装置能够有效减少血管内微栓子脱落[75, 76]。经心尖入路瓣膜植入时,荷包缝合大小及植入操作也需提防心脏在收缩舒张时将气体带入左心室。术后如高度怀疑脑卒中,尽快在窗口期完善头颅增强CT/磁共振成像(MRI)检查或血管造影,并请神经科医生及时参与治疗。
术前根据影像资料评估选择适宜的手术入路及术中规范操作,是减少血管并发症的重要手段。术前入路评估应重点分析入路血管直径、粥样硬化、钙化斑块、狭窄、迂曲、夹层等可能影响入路选择的因素。术中穿刺位置应选择血管条件较好的区域并力求穿刺点位于血管横径中心位置,可使用对侧造影指导或超声引导等方法提高穿刺成功率,微穿刺针的应用也有助于预防反复穿刺造成的出血、血肿等问题。可选择预置缝合器建立主入路,术中置入缝合器时应充分游离皮肤及皮下组织,并避免在钙化斑块部位置入缝线,注意通过观察缝合器侧口出血情况确认缝线置入于血管内壁。术后预置缝合器关闭伤口时应保留导丝,必要时可以追加缝合器,关闭血管后应行血管造影,明确是否存在穿刺点狭窄、闭塞、严重夹层、出血等并发症,必要时可经对侧入路植入支架或球囊扩张修复,或中转外科直视切口缝合修复。置入多把缝合器后出现入路血管狭窄、闭塞等并发症的概率明显升高,应予以关注。如术后出现血红蛋白降低而未发现明确出血的情况,应考虑腹膜后出血的可能。外科血管切开缝合技术能够明显降低穿刺部位出血、狭窄、夹层、闭塞、动静脉瘘等并发症。
对术前有明显肾功能不全表现的患者,术中需尽可能减少对比剂使用,并且在围手术期慎用肾毒性药物,术中维持相对较高的血压保证肾脏灌注,术后密切关注尿量及肾功能。可以进行水化和利尿治疗。一旦发现少尿、无尿等,需尽早评估是否需要连续性肾脏替代治疗。
TAVR围手术期建议使用抗生素预防性治疗,对于感染高风险患者,需延长抗生素使用时间或根据临床经验及药敏结果提高抗生素使用等级。一旦发生感染性心内膜炎,需要积极抗感染治疗,效果不佳或介入瓣膜形成赘生物者,需要视情况尽快转外科手术移除介入瓣膜,行人工瓣膜置换术。
胸腔积液少见于部分经心尖TAVR术后患者,与伤口止血处理不严格、术后给予抗凝治疗后慢性渗血有关,也见于年老体弱并且合并心力衰竭、低蛋白血症、贫血的患者。胸腔积液不积极处理,会引起患者出现气短症状,导致肺不张、低氧血症等严重情况。如发现中到大量胸腔积液,需要积极穿刺置管引流,并积极治疗原发病。对于可疑伤口渗血引起的反复血性胸腔积液,必要时需探查止血。极少数患者可因颈静脉穿刺操作不当导致胸腔积液或气胸,且术中往往不易发现,术中及围手术期应注意观察患者循环呼吸等生命体征,及时通过胸部X线平片(胸片)、超声、造影等检查明确诊断,及时处理。
主动脉根部的主动脉窦、瓣环破裂较少见,TAVR术中对于扩张球囊直径的把握至关重要;严重瓣环钙化的患者应适当降低球囊直径;并且需要尽量避免植入器械反复在根窦部暴力试探操作;避免选择过大型号瓣膜,减少球囊扩张次数;横位心的患者可使用圈套器技术辅助输送系统跨瓣;对于主动脉严重钙化的患者需选择其他安全入路。一旦发生此类并发症,需紧急体外循环下转外科开胸手术抢救,尽管如此,病死率仍然很高。
心室穿孔/破裂主要与手术操作技术有关。术前评估发现左心室壁变薄(<10 mm)是高危因素。经股动脉完成TAVR应注意导丝、导管深度,减少刺激心室,注意避免选用的导管和导丝有尖锐拐角,如发现加硬导丝起支撑作用的头部有折角的现象,需要及时更换。术中第二助手需严密观察X线影像情况,及时调整导丝深度。术中、术后可能出现起搏导线损伤右心室导致右心室穿孔的情况。起搏导线的植入应在射线辅助下完成,并调整投照角度,确定起搏导线位置合适,放置完成后使用锁鞘固定。对于经心尖手术,术前、术后对心尖穿刺口荷包的处理需特别注意,缝合时进针要足够深,术后荷包打结力度适中,避免心肌撕裂造成严重后果。一旦出现心室穿孔/破裂,需要紧急心包穿刺置管以确保循环稳定,及时中转实施外科手术。
部分TAVR术中送入导丝或导管可能挂住二尖瓣乳头肌、腱索,甚至出现左心室假性室壁瘤。可用TEE确认导丝导管与二尖瓣装置的相对关系。如果出现二尖瓣装置损伤导致二尖瓣反流,少量反流可临床观察随访,中-大量及以上反流推荐积极处理,可考虑采取介入瓣膜成形术(如钳夹术)或急诊转外科开胸手术处理。
目前TAVR目标人群主要为高龄、多合并症及体质差的患者,对这类患者围手术期及术后进行康复治疗尤为重要,可影响TAVR患者手术的疗效和预后[30]。TAVR术后运动康复治疗可有效改善患者的运动能力、肌肉力量、呼吸功能和生活质量等。积极开展术前健康宣教和院内早期康复治疗,可降低肺部感染和下肢深静脉血栓等各类并发症的发生率,有利于减少住院时间和快速恢复独立的社会生活[30,77]。
目前国内多数中心建议患者出院后1、3、6、12个月进行门诊随访,服用口服抗凝药患者还需在出院后定期检测凝血指标,主要检查内容包括:心电图、超声心动图、胸片、血液化验(心肌损伤指标、肝肾功能、血常规、凝血值)、6 min步行试验等。建议出院前及术后第1年内至少完成1次心脏MDCT综合评估。根据门诊复查结果,调整康复指导。术后1年后,如无明显不适,可每年随访复查1次。
本指南是根据既往文献和专家意见而制订,指南中参考的既往文献主要来源于国内外发表的临床研究结果,仅供临床参考,主动脉瓣病变的介入治疗需要临床医师根据患者实际情况进行个性化处理。
TAVR目前已有超过20年的历史,有大量的循证医学证据支持,在国际上有着极为广泛的应用。我国的TAVR技术正处于高速发展阶段,十余年来取得了令人瞩目的成绩,中国的经验及数据正逐步走向国际舞台。本指南也会根据国内外的循证医学证据进行定期更新。希望本指南的制订能够为各级临床医师提供合理的推荐建议,促进我国TAVR技术的高质量发展,为我国广大主动脉瓣疾病患者提供优良的医疗服务。
本指南制订专家委员会名单
名誉主任委员:胡盛寿(中国医学科学院阜外医院心外科);韩雅玲(解放军北部战区总医院心内科);高润霖(中国医学科学院阜外医院心内科);葛均波(复旦大学附属中山医院心内科)
编委会执行主任:潘湘斌(中国医学科学院阜外医院深圳医院 中国医学科学院阜外医院结构性心脏病中心)
编委会主任委员(按姓氏汉语拼音排序):陈茂(四川大学华西医院心内科);董念国(华中科技大学同济医学院附属协和医院心外科);郭应强(四川大学华西医院心外科);林逸贤(香港亚洲心脏中心);王建安(浙江大学医学院附属第二医院心内科);魏来(复旦大学附属中山医院心外科);殷伟贤(台北市振兴医院心内科);周达新(复旦大学附属中山医院心内科);周玉杰(首都医科大学附属北京安贞医院心内科)
编委会副主任委员(按姓氏汉语拼音排序):陈良万(福建医科大学附属协和医院心外科);陈绍良(南京市第一医院心内科);陈韵岱(解放军总医院心内科);方臻飞(中南大学湘雅二医院心内科);郭惠明(广东省人民医院心外科);何奔(上海市胸科医院心内科);孔祥清(江苏省人民医院心内科);来永强(首都医科大学附属北京安贞医院心外科);李伟栋(浙江大学医学院附属第一医院心外科);刘先宝(浙江大学医学院附属第二医院心内科);罗建方(广东省人民医院心内科);尚小珂(华中科技大学同济医学院附属协和医院心外科);苏晞(武汉亚洲心脏病医院心内科);陶凌(空军军医大学西京医院心内科);王巍(中国医学科学院阜外医院结构性心脏病中心);王焱(厦门大学附属心血管病医院心内科);徐凯(解放军北部战区总医院心内科);薛松(上海交通大学医学院附属仁济医院心外科);杨剑(空军军医大学西京医院心外科);杨杰孚(北京医院心内科);杨毅宁(新疆维吾尔自治区人民医院心脏中心);张戈军(中国医学科学院阜外医院结构性心脏病中心);张海波(首都医科大学附属北京安贞医院心外科);赵强(上海交通大学医学院附属瑞金医院心外科)
编委会成员(按姓氏汉语拼音排序):安贵鹏(山东大学齐鲁医院心内科);安健(山西省心血管病医院心内科);陈海生(广州市第一人民医院心外科);陈建英(广东医科大学附属医院心内科);陈良龙(福建医科大学附属协和医院心内科);陈秋雄(广东省中医院心内科);陈铁男(天津医科大学第二医院心外科);陈晓敏(宁波市第一医院心内科);程伟(陆军军医大学西南医院);崔鹏(成都市第三人民医院介入科);段福建(中国医学科学院阜外医院超声影像科);范小平(广东省中医院心外科);方军(福建医科大学附属协和医院心内科);房芳(中国医学科学院阜外医院结构性心脏病中心);冯沅(四川大学华西医院心内科);傅国胜(浙江大学医学院附属邵逸夫医院心内科);谷兴华(山东大学齐鲁医院心外科);郭亮(中国医科大学附属第一医院心内科);郭然(大连医科大学附属第一医院心内科);郭延松(福建省立医院心内科);韩克(西安交通大学第一附属医院心内科);韩宇(阜外华中心血管病医院心内科);何胜虎(江苏省苏北人民医院心内科);何学志(大连市中心医院心外科);洪浪(江西省人民医院心内科);胡晓鹏(中国医学科学院阜外医院结构性心脏病中心);华正东(武汉亚洲心脏病医院心外科);吉庆伟(广西壮族自治区人民医院心内科);江洪(武汉大学人民医院心内科);江磊(青岛大学附属医院心外科);姜楠(天津市胸科医院心外科);姜小飞(珠海市人民医院心内科);姜宇(南昌大学第一附属医院心内科);姜正明(郑州大学第一附属医院心内科);金晶(武汉亚洲心脏病医院心外科);晋军[陆军军医大学第二附属医院(新桥医院)心内科];赖应龙(川北医学院附属医院心外科);李刚(中山大学附属第五医院心外科);李吉林(汕头大学医学院附属第二医院心内科);李妍(空军军医大学唐都医院心内科);李怡(中山大学附属第一医院心内科);李自成(暨南大学附属第一医院心内科);廖永玲(赣南医学院第一附属医院心内科);林忠伟(广东药科大学附属第一医院心内科);刘继红(大连大学附属中山医院心外科);刘冀东(上海交通大学医学院附属仁济医院心外科);刘健(广东省人民医院心外科);刘杰(南宁市第一人民医院心内科);刘金平(武汉大学中南医院心外科);刘进军(蚌埠医学院第一附属医院心内科);刘鹏(邵阳市中心医院心内科);刘苏(河北医科大学第二医院心外科);刘巍(北京积水潭医院心内科);刘煜昊(阜外华中心血管病医院心内科);柳克祥(吉林大学第二医院心外科);陆方林[海军军医大学第一附属医院(上海长海医院)心外科];栾波(辽宁省人民医院心内科);罗彩东(绵阳市中心医院心内科);罗凡砚(中南大学湘雅医院心外科);马为(北京大学第一医院心内科);梅波(川北医学院附属医院心外科);梅举(上海交通大学医学院附属新华医院心外科);莫沛(广州医科大学附属第二医院心内科);聂如琼(中山大学孙逸仙纪念医院心内科);牛兆倬(青岛市市立医院心外科);欧阳文斌(中国医学科学院阜外医院结构性心脏病中心);潘家华(云南省阜外心血管病医院心内科);潘硕(陕西省人民医院心内科);潘文志(复旦大学附属中山医院心内科);彭小平(南昌大学第一附属医院心内科);任法新(烟台毓璜顶医院心内科);石凤梧(河北医科大学第二医院心外科);唐熠达(北京大学第三医院心内科);万俊义(中国医学科学院阜外医院深圳医院结构性心脏病中心);万力(南昌大学第一附属医院心外科);汪芳(北京医院心内科);王斌(厦门大学附属心血管病医院心内科);王霖(中南大学湘雅医院心外科);王首正(中国医学科学院阜外医院结构性心脏病中心);王宇彬(首都医科大学宣武医院心内科);魏翔(华中科技大学同济医学院附属同济医院心外科);吴连拼(温州医科大学附属第二医院心内科);吴延庆(南昌大学第二附属医院心内科);谢涌泉(中国医学科学院阜外医院结构性心脏病中心);徐东辉(中国医学科学院结构性心脏病中心);徐健[中国科学技术大学附属第一医院(安徽省立医院)心内科];许兆延(佛山市第一人民医院心内科);杨金宝(西安国际医学中心医院心外科);杨振文(天津医科大学总医院心内科);袁义强(河南省胸科医院心内科);张东会(哈尔滨医科大学附属第二医院心内科);张恒(蚌埠医学院第一附属医院心内科);张俊杰(南京市第一医院心内科);张明宇(哈尔滨医科大学附属第四医院心内科);张申伟(郑州市第七人民医院心内科);张文琪(吉林大学中日联谊医院心内科);曾广伟(西安国际医学中心医院心内科);曾杰(四川省人民医院心内科);赵元(中南大学湘雅二医院心外科);朱达(云南省阜外心血管病医院结构性心脏病中心)
执笔者:徐东辉(中国医学科学院阜外医院结构性心脏病中心);胡晓鹏(中国医学科学院阜外医院结构性心脏病中心);徐凯(解放军北部战区总医院心内科);朱达(云南省阜外心血管病医院结构性心脏病中心);刘先宝(浙江大学医学院附属第二医院心内科);谢涌泉(中国医学科学院阜外医院结构性心脏病中心)
国家心血管病中心, 国家结构性心脏病介入质控中心, 中华医学会心血管病学分会, 等. 经导管主动脉瓣置换术临床实践指南[J]. 中华医学杂志, 2023, 103(12): 886-900. DOI: 10.3760/cma.j.cn112137-20221106-02332.
所有作者均声明不存在利益冲突



























