
探讨25-羟基维生素D3[25-(OH)D3]、脂联素(APN)及趋化素与妊娠期糖尿病(GDM)患者胰岛素抵抗的相关性。
选取2020年5月至2021年12月天津市中心妇产科医院就诊的GDM患者28例为GDM组,同期糖耐量正常的孕妇45例为对照组。比较2组患者的25-(OH)D3、APN、趋化素、空腹血糖(FPG)、空腹胰岛素(FINS)、糖化血红蛋白(HbA1c)和稳态型胰岛素抵抗指数(HOMA-IR),并分析25-(OH)D3、APN、趋化素与GDM患者胰岛素抵抗的相关性。
GDM组FPG、FINS、HOMA-IR及趋化素高于对照组(均P<0.05),25-(OH)D3和APN低于对照组(均P<0.05)。Logistic分析显示血清25-(OH)D3、APN、趋化素均为GDM的相关影响因素(均P<0.05)。Spearman相关性分析显示血清25-(OH)D3与FPG、HOMA-IR存在负相关(均P<0.05),趋化素与FINS、HOMA-IR存在正相关(均P<0.05)。ROC曲线分析结果显示25-(OH)D3、APN和趋化素的AUC分别为0.841(95%CI:0.746~0.967)、0.678(95%CI:0.545~0.812)、0.360(95%CI:0.233~0.487)。
25-(OH)D3、APN和趋化素与GDM患者胰岛素抵抗有一定的相关性,对GDM的预测具有参考价值。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
妊娠期糖尿病(gestational diabetes mellitus,GDM)是指妊娠前糖代谢正常而妊娠期出现的糖尿病,其与不良围产期结局及母亲和儿童的长期健康后果相关。GDM的发病率不断攀升,目前全球GDM的发病率为2%~20%,而患有GDM的患者在未来10~20年进展为糖尿病的风险增加35%~60%[1]。一项纳入79 064例中国受试者的荟萃分析结果显示我国GDM的发病率为14.8%(95%CI:12.8%~16.7%)[2],饮食结构及生活方式的改变对于GDM的发病增加也有一定影响。因而对于GDM的预防和治疗逐渐受到重视。GDM发病机制复杂,至今仍未完全阐明,目前认为胰岛素抵抗(insulin resistance,IR)是GDM的主要发病机制。目前二胎、三胎政策的放开使得高龄孕妇增多,GDM的发病率也逐年上升,如何更有效预测和预防来改善GDM孕产妇及新生儿的预后,已成为全球研究的热点问题。
维生素D为类固醇衍生物,与钙、磷及骨代谢密切相关。目前其在癌症、糖尿病、自身免疫性疾病和炎症反应中的作用也不断受到关注。维生素D代谢产物25-(OH)D3是维生素D在血液循环中的主要形式,半衰期为3周,临床常通过测定25-(OH)D3浓度评价体内维生素D水平。维生素D缺乏常见,而妊娠妇女体内维生素D的缺乏会损害胰岛β细胞分泌功能,降低外周组织胰岛素的敏感性,从而参与GDM的发生与发展[3]。
脂肪组织除了是储能器官,还是人体内的内分泌器官,其可以释放出大量的脂肪因子,在GDM的发病中发挥重要作用[4]。脂联素(adiponectin,APN)是脂肪组织分泌的一种活性脂肪因子,可促进肝脏脂肪酸氧化和降低葡萄糖合成来刺激葡萄糖的摄取,提高组织对内源性胰岛素的敏感度[5]。趋化素是G蛋白耦联受体趋化因子样受体1的配体,可维持机体的代谢性平衡,具有负性调节血糖的作用,促进胰岛素敏感和改善胰岛素细胞分泌的功能[6]。有研究发现维生素D可作用于脂肪因子从而抑制前脂肪细胞分化为成熟的脂肪细胞,进而减少外周组织的胰岛素抵抗[7]。本研究主要观察孕产妇体内血清中25-(OH)D3、ADP和趋化素的变化,并探讨其与GDM发病的相关性,为GDM的预测以及预防提供参考。
选取2020年5月至2021年12月天津市中心妇产科医院就诊的28例GDM患者为研究组(GDM组),同时期糖耐量正常的孕妇45例为对照组。纳入标准:(1)年龄≥18周岁的妊娠患者;(2)妊娠24~28周;(3)研究组符合妊娠期糖尿病诊断标准[8];(4)无孕前糖尿病、高血压疾病;(5)签署知情同意书。排除标准:具备以下任一项者,不可参与本试验:(1)心脏功能不全者;(2)肝、肾功能障碍者;(3)纳入研究前,连续3个月服用维生素D;(4)代谢性骨病、甲状腺功能不全及恶性肿瘤患者;(5)其他研究者认为不宜参与本研究的患者。本方案经过天津市中心妇产科医院伦理委员会批准。
收集患者的一般资料包括年龄、孕周、身高及孕前体质量,计算孕前体质量指数(body mass index,BMI)=体质量/身高2(kg/m2)。
抽取孕妇空腹外周静脉血,葡萄糖氧化酶法测定空腹血糖(fasting lasma glucose,FPG);电化学发光法测定空腹胰岛素(fasting insulin,FINS)、化学发光法定糖化血红蛋白(glycated hemoglobin,HbA1c),计算稳态型胰岛素抵抗指数(homeostasis model assessment insulin resistance,HOMA-IR)=FINS×FPG/22.5。比较2组孕妇的FPG、FINS、HbA1c及HOMA-IR。
质谱法检测血清25-(OH)D3水平,酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)法检测血清APN及趋化素浓度(试剂盒购自上海通蔚生物科技有限公司)。
以"是否"GDM为因变量(0=是,1=否),以血清25-(OH)D3、APN、趋化素为自变量(赋值为定量参数),纳入Logstic回归分析。并采用Spearman对25-(OH)D3、APN及趋化素与GDM患者发病及FPG、FINS、HbA1c及HOMA-IR的相关性进行分析。
采用受试者工作曲线(receiver operating characteristic curve,ROC)下面积(AUC)评价对于GDM发生的预测价值,AUC<0.5无预测价值,0.5~0.7预测准确性低,0.7~0.9预测准确性较好,当AUC>0.9准确性最高。
采用SPSS 24.0进行数据分析。计量资料用均数±标准差( ±s)表示,组间比较采用t检验。多因素采用二元Logistic回归分析。采用Spearman进行相关性分析,以P<0.05为差异有统计学意义。
±s)表示,组间比较采用t检验。多因素采用二元Logistic回归分析。采用Spearman进行相关性分析,以P<0.05为差异有统计学意义。
GDM组患者的年龄及孕前BMI均明显高于对照组(均P<0.05),两组之间孕周比较差异无统计学意义(P>0.05),见表1。
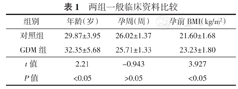
两组一般临床资料比较
两组一般临床资料比较
| 组别 | 年龄(岁) | 孕周(周) | 孕前BMI(kg/m2) |
|---|---|---|---|
| 对照组 | 29.87±3.95 | 26.02±1.37 | 21.60±1.68 |
| GDM组 | 32.35±5.68 | 25.71±1.33 | 23.23±1.80 |
| t值 | 2.21 | -0.943 | 3.927 |
| P值 | <0.05 | >0.05 | <0.05 |
与对照组比较,GDM组患者的FPG、FINS及HOMA-IR水平均明显升高(均P<0.05),两组HbA1c比较差异无统计学意义(P>0.05),见表2。
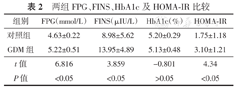
两组FPG、FINS、HbA1c及HOMA-IR比较
两组FPG、FINS、HbA1c及HOMA-IR比较
| 组别 | FPG(mmol/L) | FINS(μIU/L) | HbA1c(%) | HOMA-IR |
|---|---|---|---|---|
| 对照组 | 4.63±0.22 | 8.98±5.62 | 5.20±0.29 | 1.75±1.18 |
| GDM组 | 5.22±0.51 | 13.95±4.89 | 5.13±0.48 | 3.10±1.21 |
| t值 | 6.816 | 3.859 | -0.801 | 4.34 |
| P值 | <0.05 | <0.05 | >0.05 | <0.05 |
与对照组比较,GDM组25-(OH)D3、APN水平均明显降低(均P<0.05),趋化素水平明显升高(P<0.05),见表3。
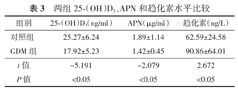
两组25-(OH)D3、APN和趋化素水平比较
两组25-(OH)D3、APN和趋化素水平比较
| 组别 | 25-(OH)D3(ng/ml) | APN(μg/ml) | 趋化素(ng/L) |
|---|---|---|---|
| 对照组 | 25.27±6.24 | 1.89±1.14 | 62.59±24.58 |
| GDM组 | 17.92±5.23 | 1.42±0.45 | 90.86±64.01 |
| t值 | -5.191 | -2.079 | 2.672 |
| P值 | <0.05 | <0.05 | <0.05 |
如表4所示,血清25-(OH)D3、APN和趋化素均为GDM的相关影响因素(均P<0.05)。
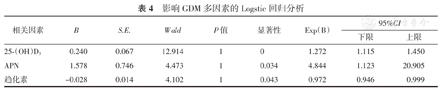
影响GDM多因素的Logstic回归分析
影响GDM多因素的Logstic回归分析
| 相关因素 | B | S.E. | Wald | P值 | 显著性 | Exp(B) | 95%CI | |
|---|---|---|---|---|---|---|---|---|
| 下限 | 上限 | |||||||
| 25-(OH)D3 | 0.240 | 0.067 | 12.914 | 1 | 0 | 1.272 | 1.115 | 1.450 |
| APN | 1.578 | 0.746 | 4.473 | 1 | 0.034 | 4.844 | 1.123 | 20.905 |
| 趋化素 | -0.028 | 0.014 | 4.102 | 1 | 0.043 | 0.972 | 0.946 | 0.999 |
Spearman相关性分析结果显示血清25-(OH)D3与FPG和HOMA-IR存在负相关(均P<0.05);趋化素与FINS、HOMA-IR存在正相关(均P<0.05),见表5。
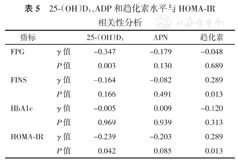
25-(OH)D3、ADP和趋化素水平与HOMA-IR相关性分析
25-(OH)D3、ADP和趋化素水平与HOMA-IR相关性分析
| 指标 | 25-(OH)D3 | APN | 趋化素 | |
|---|---|---|---|---|
| FPG | γ值 | -0.347 | -0.179 | -0.048 |
| P值 | 0.003 | 0.130 | 0.689 | |
| FINS | γ值 | -0.164 | -0.082 | 0.289 |
| P值 | 0.166 | 0.491 | 0.013 | |
| HbA1c | γ值 | -0.005 | 0.009 | -0.120 |
| P值 | 0.969 | 0.939 | 0.313 | |
| HOMA-IR | γ值 | -0.239 | -0.203 | 0.289 |
| P值 | 0.042 | 0.085 | 0.013 |
ROC曲线分析表明25-(OH)D3、APN及趋化素对GDM均有一定的预测价值,25-(OH)D3的AUC为0.841(95%CI:0.746~0.937);APN的AUC为0.678(95%CI:0.545~0.812);趋化素的AUC为0.360(95%CI:0.233~0.487)。
GDM是产科最常见的代谢疾病之一,可严重危害母婴健康,临床常见的并发症有大于胎龄儿和巨大儿、子痫前期、羊水过多、死产及新生儿并发症等[9]。高龄、肥胖、不良的生活方式、妊娠期体质量增加过多、2型糖尿病家族史、既往妊娠期糖尿病、多胎妊娠、多囊卵巢综合征、维生素D缺乏及环境污染等都与GDM的发病密切相关[10]。社交距离、体育活动的减少以及生活方式和饮食习惯的改变都导致了体质量增加,这也提高了GDM的发病率[11]。目前GDM的确切发病机制尚不明确,研究发现其病理生理机制类似于2型糖尿病,包括胰岛素抵抗、氧化应激和全身炎症[12]。也有人认为,患有GDM的孕妇可能存在预先存在的β细胞缺陷,无法适应怀孕期间不断增加的胰岛素需求[13],另有研究认为全身炎症与糖尿病患者的β细胞功能障碍和随后的胰岛素抵抗有关[14]。本研究中GDM组患者HOMA-IR显著高于健康受试者(P<0.05),提示在GDM患者存在一定的IR。
人体内的维生素D有维生素D2和维生素D3 2种形式。天然含有维生素D的食物很少,皮肤合成是维生素D的主要来源。维生素D本身没有生物活性,与维生素D结合蛋白结合后,在肝脏中在酶的催化下生成25-(OH)D3,然后在肾脏中转化为维生素D的活性形式1,2-25-(OH)2D3,与维生素D受体结合后发挥作用[14,15]。维生素D缺乏在人群中普遍存在,而孕妇更容易出现,而维生素D的缺乏与GDM的发生风险密切相关。荟萃分析结果显示血清维生素D缺乏的孕妇发生GDM的风险维生素D水平较正常的孕妇高达26%(OR:1.26;95%CI:1.13~1.41)[16]。周晔等[17]研究发现孕中期GDM患者血清25-(OH)D3显著低于对照组(P<0.05),25-(OH)D3是GDM发病的保护因素。本研究中GDM组的25-(OH)D3显著低于对照组(P<0.05),25-(OH)D3为GDM的相关影响因素,且与FPG和HOMA-IR呈负相关,这表明25-(OH)D3与GDM的发病密切相关。研究发现维生素D与维生素D受体结合后,可通过激活过氧化物酶体增殖激活受体[18],抑制肾素-血管紧张素-醛固酮系统[19],下调肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1和白细胞介素-6等炎症因子的基因表达来改善胰岛素抵抗,增加胰岛素的敏感性[20]。
脂肪因子是由脂肪组织产生的可溶性蛋白家族,可调节脂质代谢、饱腹感、饥饿感以及包括胰岛素分泌在内的许多内分泌过程。研究发现脂肪因子信号的失调与肥胖、糖尿病、血脂异常及慢性炎症有关[21]。APN是一种几乎完全由脂肪细胞合成的含有244个氨基酸的蛋白质,其在血液循环中主要有3种形式,包括三聚体APN(低相对分子质量复合物)、六聚体APN(中相对分子质量复合物)及多聚体APN(高相对分子质量复合物),而高相对分子质量复合物在调节葡萄糖稳态方面,可能是最具生物活性的形式[22]。研究发现血浆APN与BMI、腹内脂肪和胰岛素抵抗指数呈负相关[23],性别、年龄、生活方式和氧化应激可能也可抑制APN的表达。章琳等[24]发现GDM患者的APN水平显著低于对照组,GDM组患者的APN水平与空腹血糖、空腹胰岛素和HOMA-IR指标呈负相关,为GDM患者发生不良妊娠结局的独立危险因素。本研究结果中GDM组孕妇的血清APN水平显著低于正常孕妇组,血清APN为GDM的相关影响因素。但在本研究中APN与HOMA-IR的相关性不显著,考虑可能与纳入的病例少有关。
趋化素为一种新的脂肪分子,可以调节脂肪生成及脂肪细胞代谢[25]。Francis等[26]通过前瞻性和纵向的研究方法,测定妊娠10~14、15~26、23~31、33~39周的107例GDM患者及214非GDM受试者的脂肪因子,研究发现妊娠早期和中期高浓度的趋化素与GDM风险的增加显著相关,与对照组相比,在整个妊娠期发生GDM患者的趋化素水平始终较高。一项纳入742例GDM患者和840例正常孕妇的Meta分析显示,与正常孕妇相比,GDM患者的循环Chemerin水平显著升高(SMD:1.16;95%CI:0.29~2.04;P=0.009)。亚组分析显示,这种差异在妊娠中期(SMD:1.47;95%CI:0.28~2.67)和平均年龄<30岁(SMD:2.30;95%CI:0.69~3.91)的GDM患者组中尤为明显[13]。李茂香等[27]同通过研究发现GDM组患者的趋化素水平显著高于对照组,且与HOMA-IR呈显著正相关。在本研究中GDM患者血清趋化素水平显著高于正常孕妇组,Logstic回归分析显示趋化素为GDM的相关影响因素,且趋化素与FINS、HOMA-IR呈正相关,表明趋化素与GDM的发病密切相关。趋化素可能通过增加胰岛素抵抗和促进亚临床炎症而参与GDM的病理生理机制[28,29]。
综上所述,血清25-(OH)D3、APN、趋化素与GDM患者胰岛素抵抗密切相关,在GDM的发生,发展中起重要作用,为GDM的预测及预防提供了一定依据,具有一定的临床意义。
所有作者均声明不存在利益冲突



























