
探讨索磷布韦/维帕他韦(SOF/VEL)单用或联合利巴韦林(RBV)治疗新疆地区丙型肝炎肝硬化患者的疗效和安全性。
回顾性分析2019年1月至2021年12月在新疆维吾尔自治区人民医院收治并经SOF/VEL单用或联合RBV完成治疗的106例丙型肝炎肝硬化患者临床资料,评估治疗结束12周的疗效[包括持续病毒学应答(SVR)、肝功能、肝性脑病及腹水情况等]及安全性。采用SPSS 25.0对数据进行分析。
106例丙型肝炎肝硬化患者中,代偿期肝硬化62例,失代偿期肝硬化44例。所有患者的SVR12率为93.4%(99/106),其中代偿期和失代偿期肝硬化患者的SVR12率分别为98.4%(61/62)和86.4%(38/44)。1b型患者SVR12率为97.7%(42/43),16例2a型患者均获得SVR12,3a型患者SVR12率为90.9%(20/22),3b型患者SVR12率为82.6%(19/23),2例6a型患者均获得SVR12。治疗结束12周后代偿期和失代偿期肝硬化患者的总胆红素和丙氨酸转氨酶水平、凝血酶原时间、Child-Pugh分数均较治疗前下降,白蛋白水平较治疗前升高(P<0.05或<0.01),失代偿期肝硬化患者腹水、肝性脑病、消化道出血发生均较治疗前减少。所有患者在治疗过程及治疗结束后均未出现严重药物不良事件,常见的不良反应为贫血(10.4%)、乏力(4.7%)和腹泻(1.9%)等。失代偿期肝硬化患者常见的不良反应为贫血(11.4%)、乏力(4.5%)和腹泻(4.5%)等,无因上述不良反应调整治疗方案或停药的患者。
SOF/VEL单用或联合RBV治疗丙型肝炎肝硬化,包括基因3型肝硬化患者可获得高SVR12,抗病毒治疗效果及安全性良好,可有效改善患者肝功能,减少肝硬化并发症的发生。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
丙型肝炎是由丙型肝炎病毒(Hepatitis C virus, HCV)通过输血、母婴垂直传播、性接触、破损皮肤和黏膜及血液透析等途径感染引起的疾病[1]。根据2022年世界卫生组织报告,全球估计有5 800万慢性HCV感染者,每年约有150万新发感染病例,病死率约为29万人/年,主要来自肝硬化和肝细胞癌[2]。55%~85% HCV感染者会进展为慢性丙型肝炎(Chronic hepatitis C, CHC),若未经过正规治疗,20年内出现肝硬化的概率为15%~30%[2],一旦发生肝硬化,10年生存率约为80%,出现失代偿10年生存率仅为25%[3],严重威胁人类健康。随着直接抗病毒药物(Direct-acting antiviral agents,DAAs)的问世,慢性HCV感染者的抗病毒治疗已经进入DAAs的泛基因型时代,在HCV感染者中均能达到90%以上的持续病毒学应答(Sustained virologic response,SVR)[1]。HCV分为6个主要基因型和80个基因亚型,不同基因型的致病性、治疗方案不同,基因3型CHC与肝纤维化、肝硬化和癌症相关,并且DAAs疗效欠佳[4]。索磷布韦/维帕他韦(Sofosbuvir/Velpatasvir,SOF/VEL)对成人6种基因型CHC、伴或不伴肝硬化患者均有治疗作用[5]。目前在新疆地区SOF/VEL治疗丙型肝炎肝硬化的真实世界研究较少,本研究回顾性分析SOF/VEL单用或联合利巴韦林(Ribavirin, RBV)治疗新疆地区丙型肝炎肝硬化患者的疗效和安全性,以及对患者肝功能的影响,为临床提供参考。
回顾性收集2019年1月至2021年12月在新疆维吾尔自治区人民医院收治并经SOF/VEL单用或联合RBV完成治疗的106例丙型肝炎肝硬化患者作为研究对象。纳入标准:(1)所有研究对象均符合《丙型肝炎防治指南(2019年版)》中CHC的诊断标准[1];(2)诊断为肝硬化;(3)年龄>18岁。排除标准:(1)合并甲型肝炎、乙型肝炎和戊型肝炎等其他病毒性肝炎患者;(2)合并脂肪肝、酒精性肝病、自身免疫性肝病、遗传性肝病和肝内胆管结石等其他肝胆疾病患者;(3)妊娠期和哺乳期患者;(4)人类免疫缺陷病毒抗体阳性者。代偿期肝硬化的诊断依据(符合下列4条之一)[6]:(1)组织学符合肝硬化诊断;(2)内镜显示食管胃底静脉曲张或消化道异位静脉曲张,除外非肝硬化性门静脉高压;(3)肝脏硬度值>14.6 kPa,B超、电子计算机断层扫描成像(CT)或磁共振成像(MR)等影像学检查提示肝硬化或门静脉高压特征;(4)无组织学、内镜或影像学检查者,以下检查指标异常提示存在肝硬化(需符合4条中2条):1)血小板(PLT)<100×106/L,且无其他原因可以解释;2)血清白蛋白<35 g/L,排除营养不良或肾脏疾病等其他原因;3)国际标准化比值(INR)>1.3或凝血酶原时间(PT)延长(停用溶栓或抗凝药物7 d以上);4)天冬氨酸转氨酶(AST)/PLT比率指数(APRI):成人APRI评分>2。失代偿期肝硬化的诊断依据[6]:在肝硬化基础上,出现门静脉高压并发症和(或)肝功能减退:(1)具备肝硬化的诊断依据;(2)出现腹水、食管胃底静脉曲张破裂出血、肝性脑病及肝肾综合征等。本研究已获得新疆维吾尔自治区人民医院医学伦理委员会审核通过(KY2022062101)。
收集患者性别、年龄及HCV基因型等基本资料,治疗前后HCV RNA、血常规、肝功能、肾功能及凝血功能等生化指标,以及腹部彩超、CT和MR、瞬时弹性成像和胃镜等资料。
基因3型代偿期和失代偿期肝硬化根据病情经患者同意后给予SOF/VEL联合RBV治疗12周,若有RBV使用禁忌证则给予SOF/VEL治疗24周。其他基因型代偿期肝硬化患者给予SOF/VEL治疗12周,失代偿期肝硬化患者给予SOF/VEL联合RBV治疗12周,若有RBV使用禁忌证则给予SOF/VEL治疗24周。SOF/VEL (Gilead Sciences Ireland UC,注册证号H20180024,规格:每片含400 mg SOF和100 mg VEL)口服,1片/次,1次/d。RBV口服,体质量<75 kg的患者给予1 000 mg/次,1次/d;体质量≥75 kg患者给予1 200 mg/次,1次/d。
采用SPSS 25.0进行统计学分析。服从正态分布的计量资料以 ±s表示,偏态分布的计量资料以中位数(M)和上下四分位数(Q1,Q3)表示,组间比较采用t检验或秩和检验。计数资料采用例(百分数)表示,采用χ2检验。以P<0.05为差异有统计学意义。
±s表示,偏态分布的计量资料以中位数(M)和上下四分位数(Q1,Q3)表示,组间比较采用t检验或秩和检验。计数资料采用例(百分数)表示,采用χ2检验。以P<0.05为差异有统计学意义。
106例患者,年龄(50.13±9.59)岁,其中男性占61.3%,汉族占33.0%,维吾尔族占45.3%,回族占11.3%,哈萨克族占7.5%,蒙古族2.8%。代偿期肝硬化患者62例(58.5%),失代偿期肝硬化患者44例(41.5%)。基因型分别为:1b型43例(40.6%),2a型16例(15.1%),3a型22例(20.8%),3b型23例(21.7%),6a型2例(1.9%)。单用SOF/VEL治疗者60例(56.6%),SOF/VEL+RBV治疗者46例(43.4%)。
经SOF/VEL单用或联合RBV治疗丙型肝炎肝硬化患者SVR12率为93.4%(99/106),其中代偿期与失代偿期肝硬化患者SVR12率分别为98.4%(61/62)和86.4%(38/44)。1b型患者SVR12率为97.7%(42/43),16例2a型患者均获得SVR12,3a型患者SVR12率为90.9%(20/22),3b型患者SVR12率为82.6%(19/23),2例6a型患者均获得SVR12。8例3a型代偿期肝硬化患者均获得SVR12;14例3a型失代偿期肝硬化患者中,12例获得SVR12。14例3b型代偿期肝硬化患者中,13例获得SVR12;9例3b型失代偿期肝硬化患者中,6例获得SVR12。完成治疗后12周,肝硬化代偿期和失代偿期患者的总胆红素和丙氨酸转氨酶(ALT)水平、凝血酶原时间、Child-Pugh分数均较治疗前下降,血清白蛋白(Alb)水平与治疗前相比升高,差异具有统计学意义(P<0.05或<0.01),其他指标未见明显变化(P>0.05)(表1)。失代偿期肝硬化患者治疗前合并腹水26例(59.1%),肝性脑病5例(11.4%),肝硬化伴食管胃底静脉曲张破裂出血16例(36.4%)。完成治疗后12周合并腹水8例(18.2%),肝硬化伴食管胃底静脉曲张破裂出血2例(4.6%)。
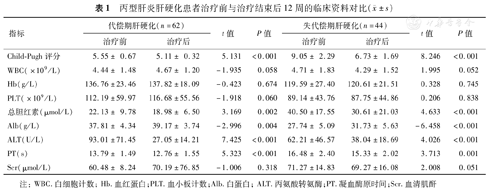
丙型肝炎肝硬化患者治疗前与治疗结束后12周的临床资料对比( ±s)
±s)
丙型肝炎肝硬化患者治疗前与治疗结束后12周的临床资料对比( ±s)
±s)
| 指标 | 代偿期肝硬化(n=62) | t值 | P值 | 失代偿期肝硬化(n=44) | t值 | P值 | ||
|---|---|---|---|---|---|---|---|---|
| 治疗前 | 治疗后 | 治疗前 | 治疗后 | |||||
| Child-Pugh评分 | 5.55± 0.67 | 5.11± 0.32 | 5.131 | <0.001 | 9.05± 2.29 | 6.73± 1.69 | 8.246 | <0.001 |
| WBC(×109/L) | 4.44± 1.48 | 4.67± 1.20 | -1.935 | 0.058 | 4.71± 1.83 | 4.29± 1.52 | 1.995 | 0.052 |
| Hb(g/L) | 136.76±23.46 | 137.82±18.09 | -0.423 | 0.674 | 119.59±27.40 | 120.61±21.51 | 0.328 | 0.745 |
| PLT(×109/L) | 112.19±59.97 | 116.68±55.56 | -1.918 | 0.060 | 89.14±43.76 | 87.75±44.86 | 0.206 | 0.838 |
| 总胆红素(μmol/L) | 22.13± 9.78 | 18.98± 6.50 | 3.169 | 0.002 | 40.50±17.55 | 30.61±21.03 | 4.633 | <0.001 |
| Alb(g/L) | 37.81± 4.34 | 39.17± 3.74 | -2.996 | 0.004 | 27.74± 5.09 | 31.73± 5.63 | -6.458 | <0.001 |
| ALT(U/L) | 93.01±71.45 | 27.05±14.21 | 7.425 | <0.001 | 62.21±46.57 | 38.04±18.69 | 4.026 | <0.001 |
| PT(s) | 13.79± 1.49 | 12.76± 1.55 | 5.323 | <0.001 | 16.48± 2.40 | 15.33± 2.02 | 3.713 | 0.001 |
| Scr(μmol/L) | 60.48± 8.24 | 70.19±76.85 | -1.006 | 0.318 | 71.27±14.83 | 69.27±16.08 | 2.008 | 0.051 |
注:WBC.白细胞计数;Hb.血红蛋白;PLT.血小板计数;Alb.白蛋白;ALT.丙氨酸转氨酶;PT.凝血酶原时间;Scr.血清肌酐
在治疗过程中未出现严重药物不良事件。106例患者中主要出现不良反应为贫血11例(10.4%),乏力5例(4.7%),腹泻2例(1.9%)等。代偿期肝硬化患者出现贫血6例(9.7%),乏力3例(4.8%),粒细胞减少1例(1.6%),头痛1例(1.6%)。失代偿期肝硬化患者主要出现不良反应为贫血5例(11.4%),乏力2例(4.5%),腹泻2例(4.5%)等(表2)。无因上述不良事件调整治疗方案或停药患者。
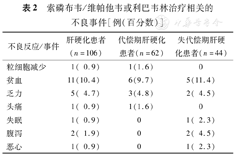
索磷布韦/维帕他韦或利巴韦林治疗相关的不良事件[例(百分数)]
索磷布韦/维帕他韦或利巴韦林治疗相关的不良事件[例(百分数)]
| 不良反应/事件 | 肝硬化患者(n=106) | 代偿期肝硬化患者(n=62) | 失代偿期肝硬化患者(n=44) |
|---|---|---|---|
| 粒细胞减少 | 1( 0.9) | 1(1.6) | 0 |
| 贫血 | 11(10.4) | 6(9.7) | 5(11.4) |
| 乏力 | 5( 4.7) | 3(4.8) | 2( 4.5) |
| 头痛 | 1( 0.9) | 1(1.6) | 0 |
| 失眠 | 1( 0.9) | 0 | 1( 2.3) |
| 腹泻 | 2( 1.9) | 0 | 2( 4.5) |
| 恶心 | 1( 0.9) | 0 | 1( 2.3) |
丙型肝炎相对于乙型肝炎更易慢性化,并且多为隐匿发展,出现肝硬化的风险为15%~30%[10],严重威胁着人类的生命安全。HCV基因型及亚型在世界各地存在差异,我国较常见的是1b、2a、3a、3b、6a型,主要以1b和2a型为主[11,12]。本研究106例丙型肝炎肝硬化患者中,基因1b型占40.6%,2a型占15.1%,3a型占20.8%,3b型占21.7%,主要以1b型及3型居多。依据现行的DAAs,不同基因型所选择的治疗方案不同,同种基因型不同疾病阶段的治疗方案也不尽相同。NS3/4A蛋白酶抑制剂禁止用于失代偿期肝硬化患者,代偿期肝硬化患者若不能进行密切监测,不推荐使用含NS3/4A蛋白酶抑制剂的DAAs,抗病毒治疗方案可以选择来迪派韦/SOF(基因1、2、4、5、6型)或SOF/VEL(泛基因型)联合RBV治疗[1]。SOF/VEL对成人6种基因型丙型肝炎肝硬化患者均有治疗作用,目前评估SOF/VEL单用或联合RBV治疗丙型肝炎肝硬化患者有效性和安全性的真实世界研究数据有限[13]。国外一项Ⅲ期ASTRAL-4试验结果显示,Child-Pugh B级丙型肝炎肝硬化患者经SOF/VEL联合RBV治疗SVR12率为94%,单用SOF/VEL的患者SVR12率为83%[14],另一项国外研究显示Child-Pugh C级丙型肝炎肝硬化患者SOF/VEL联合RBV治疗SVR12率为70%[15],本研究中丙型肝炎肝硬化患者经SOF/VEL单用或联合RBV治疗SVR12率为93.4%,其中代偿期和失代偿期肝硬化患者SVR12率为98.4%、86.4%,较上述2项研究获得了较高的SVR12率。既往研究发现,与其他HCV基因型相比,基因3型HCV感染与肝脏纤维化、肝硬化和肝癌发生风险有更高的相关性[16],通过DAAs治疗大多数丙型肝炎患者获得了超过95%的SVR率,但基因3型肝硬化患者SVR率仍较低[17,18],最近一项国内研究发现,基因3a和3b型代偿期肝硬化患者SVR12率分别为90%和50%[5],既往研究发现新疆地区基因3a和3b型肝硬化患者经SOF/VEL单用或联合RBV治疗的SVR12率为94.4%、80%[9]。本研究中基因3a和3b型肝硬化患者经SOF/VEL单用或联合RBV治疗SVR12率为90.9%和82.6%,均能获得较高的SVR12率。
既往研究表明,DAAs治疗可改善丙型肝炎肝硬化患者的肝功能,显著降低全因死亡率和HCC发生风险[19]。本研究中代偿期和失代偿期肝硬化患者经SOF/VEL单用或联合RBV治疗结束12周后Child-Pugh评分较治疗前下降,肝功能改善,与既往研究结果一致[7]。失代偿期肝硬化患者治疗后合并腹水、肝性脑病及肝硬化伴食管胃底静脉曲张破裂出血的比例均较治疗前减少。
在安全性方面,SOF经肾脏代谢,并且失代偿期肝硬化患者可能出现继发性肾功能损害[20],因此经SOF/VEL治疗过程中可能会出现肾功能损害[1]。RBV可能引起红细胞、白细胞和血红蛋白下降等不良反应。本研究中所有患者治疗结束12周后白细胞、血红蛋白和血小板未见明显下降,肾功能未见恶化,在治疗过程及治疗结束后未出现严重药物不良事件,常见的不良反应为贫血、乏力和腹泻等。失代偿期肝硬化患者常见的不良反应为贫血、乏力和腹泻。未见因上述不良反应调整治疗方案或停药的患者。在既往临床试验中,头痛、乏力和恶心在接受12周SOF/VEL治疗的患者中最常见(发生率≥10%),上述及其他不良事件在接受安慰剂治疗的患者中报告频率相似[5]。这表明丙型肝炎肝硬化患者对SOF/VEL单用或联合RBV治疗的耐受性良好。
本研究为回顾性研究,不能完全排除偏倚,且样本量有限,因此有必要通过前瞻性队列研究进一步验证。此外,本研究发现经SOF/VEL单用或联合RBV治疗的丙型肝炎肝硬化患者早期肝功能改善、肝硬化并发症减少,但实现SVR12的肝硬化患者的中长期临床获益尚不清楚,需要进一步研究探讨。
综上所述,新疆地区丙型肝炎肝硬化,包括基因3型代偿期和失代偿期肝硬化患者经SOF/VEL单用或联合RBV治疗可获得较高的SVR12率,可改善患者肝功能,无严重不良反应,安全性高。针对上述患者在病情允许的情况下积极抗病毒治疗可改善患者肝功能,减少肝硬化并发症的发生,延长肝移植等待时间。
依力哈木·阿不力提甫,连江山,热米拉·巴力,等.索磷布韦/维帕他韦单用或联合利巴韦林治疗新疆地区丙型肝炎肝硬化患者的疗效及安全性分析[J].中华临床感染病杂志,2022,15(6):459-463.DOI:10.3760/cma.j.issn.1674-2397.2022.06.005.
所有作者均声明不存在利益冲突



























