
构建基于血清神经营养因子等生物标记物的精神分裂症(SCZ)诊断模型。
前瞻性选取2017年1月至2019年12月在郑州大学第一附属医院就诊的首发未服药SCZ患者(SCZ组)和同期的健康对照者(HC组),SCZ组分别采用阳性和阴性症状量表(PANSS)和认知功能成套测验(MCCB)评估精神症状和认知功能,并检测外周脑源性神经营养因子(BDNF)、胶质细胞源性神经营养因子(GDNF)、空腹血糖(FGB)和空腹胰岛素(FINS)水平,评估受试者胰岛素抵抗情况(HOMA-IR),HC组采用同样方法评估认知功能和测定BDNF、GDNF、FGB、FINS水平及评估HOMA-IR,选择两组间差异有统计学意义的指标纳入模型。通过机器学习构建诊断模型,用交叉验证方法进行验证,并绘制受试者工作特征(ROC)曲线,计算平均ROC曲线下面积(AUC)、灵敏度、特异度。
(1)最终纳入SCZ患者142例,男70例,女72例,年龄(25±4)岁;HC 140名,男72名,女68名,年龄(26±4)岁。SCZ组认知功能各领域评分均低于HC组(均P<0.001),血清BDNF、GDNF水平[(6.7±1.8)ng/ml、(405±93)pg/ml]低于HC组[(12.3±3.2)ng/ml、(574±139)pg/ml](均P<0.001),而FINS水平、HOMA-IR[(8.4±0.8)μU/ml、1.7±0.3]则高于HC组[(6.7±0.9)μU/ml、1.4±0.3](均P<0.001)。(2)相关分析结果显示,SCZ患者的BDNF水平与PANSS中阴性症状分、总分呈负相关(r=-0.31、P<0.001,r=-0.17、P=0.040),与认知功能领域中的注意及警觉性(CPT-IP)T分、工作记忆(WSM-Ⅲ)T分、视觉学习(BVMT)T分呈正相关(r=0.39、0.37、0.29,均P<0.001);GDNF水平与认知功能领域中的CPT-IP T分、WSM-Ⅲ T分、BVMT T分呈正相关(r=0.32、P<0.001,r=0.23、P=0.007,r=0.40、P<0.001);HOMA-IR与认知功能领域中的社会认知(MSCEIT)T分呈正相关(r=0.18,P=0.033)。(3)将BDNF、GDNF和HOMA-IR组合构建的早期诊断模型的AUC为0.890(95%CI:0.832~0.940),准确度为0.89,灵敏度为0.94,特异度为0.82。
以血清神经营养因子为主的生物标记物建立的最终诊断模型对SCZ有较好的诊断效能,但仍需大规模独立样本验证。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
精神分裂症(schizophrenia,SCZ)是一组病因不明的重型精神疾病,具有高发病率、高复发率、高致残率等特点,给家庭及社会带来了沉重的负担。目前公认早发现、早诊断和早治疗是影响预后的重要因素。但过去数十年间,SCZ的诊断仍主要依靠临床医生的主观经验,缺乏有效、可靠、便捷的定量生物标记物来早期辅助诊断[1]。近年来,神经发育假说已成为SCZ病因的主流学说之一[2],而神经营养因子在神经发育过程中起着重要作用。如脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)在皮质神经元和突触的发育及维持过程中起关键作用,而胶质细胞源性神经营养因子(glial cell line-derived neurotrophic factor,GDNF)对中枢神经系统多巴胺能神经元和运动神经元的生存起到支撑作用,二者可能通过影响神经发育过程参与了SCZ的发病[3, 4]。胰岛素可以上调与突触可塑性相关受体的表达、内吞、翻译后修饰等过程[5],提示胰岛素抵抗(insulin resistance,IR)可能与神经发育异常有关。既往三者与SCZ的相关性研究较多,但联合作为临床预测模型的研究国内尚罕见报道。因此,本研究收集了142例首发未服药SCZ患者和140名健康对照者,通过检测三者及其相关指标建立SCZ诊断模型,以客观的数据预测SCZ的发病,旨在为早期辅助诊断提供简便、可靠的方法。
纳入2017年1月至2019年12月期间在郑州大学第一附属医院就诊的首发SCZ患者(SCZ组),纳入标准:(1)符合美国精神障碍诊断与统计手册第五版(DSM-5)中SCZ的诊断标准;(2)年龄18~50岁;(3)阳性与阴性症状量表(positive and negative symptom scale,PANSS)总分≥60分;(4)首次发病,既往未使用任何精神神经系统药物;(5)患者父母或法定监护人知情同意。排除标准:(1)脑器质性疾病、躯体疾病及精神发育迟滞等所致的精神障碍;(2)既往有乙醇或其他精神活性物质滥用史;(3)有神经系统、心血管系统或糖尿病等重大疾病者;(4)妊娠期/哺乳期女性。健康对照者(HC组)来自于同时期来医院体检的健康志愿者、本院医护和在校学生。排除标准同SCZ组。本研究通过郑州大学第一附属医院伦理委员会审批(批准号:2016-LW-17),所有受试者本人或监护人均签署知情同意书。
1.临床资料收集:所有SCZ患者均在入组当天完成一般资料收集、病史询问、体格检查和精神检查,同时采用PANSS量表、认知功能成套测验(MATRICS consensus cognitive battery,MCCB)中文版评估精神病性症状和认知功能。MCCB中文版共包括9项内容对应于7大认知功能领域:(1)信息处理速度(speed of processing,SOP),包括连线测验、符号编码和流畅测验;(2)词语学习:霍普金斯词语学习测验(Hopkin′s verbal learning test,HVLT);(3)工作记忆:韦氏记忆量表-第三版(Wechsler memory scale 3rd,WMS-Ⅲ);(4)推理和问题解决:神经心理评估成套测验(neuropsychological assessment battery,NAB);(5)视觉学习:简易视觉记忆测验(brief visuospatial memory test,BVMT);(6)社会认知:迈耶-萨洛维-卡鲁索情绪智力测试(Mayer-Salovey-Caruso emotional intelligence test,MSCEIT);(7)注意及警觉:持续操作-相同配对(continuous performance test-identical pairs,CPT-IP)。最终结果经认知统计软件转化为认知功能七大领域T分后再进行统计分析。HC组于入组时进行一般资料收集和认知功能评估,评估方法同SCZ患者。所有量表由两名经过一致性培训的精神科主治医师进行评估。
2.血液标本的采集和指标检测:所有受试者均于入组次日清晨06∶30-07∶30采集空腹肘静脉血,采集前要求禁食12 h,每人采集10 ml。其中5 ml血样在采集后立即送至实验室检测空腹血糖(fasting blood-glucose,FBG)和空腹胰岛素(fasting insulin,FINS)水平,其中FBG水平采用葡萄糖氧化酶法测定,FINS水平采用电化学发光法测定,采用稳态模式评估法(homeostasis model assessment,HOMA)评估受试者胰岛素抵抗情况,用HOMA-IR表示,HOMA-IR=FBG(mmol/L)× FINS(mU/L)/22.5。剩余5 ml血样采集后至于EDTA抗凝管中,3 000 r/min离心10 min,取上清液并编号,置于-80 ℃冰箱冻存,之后用于BDNF和GDNF水平测定。本研究采用酶联免疫吸附法(ELISA)检测血清中BDNF和GDNF水平,实验由一位研究人员严格按照说明书进行操作,并一次性检测完毕,试剂盒由美国Bosterbio公司提供。
采用IBM SPSS Statistics 26.0 中文版进行数据统计分析。符合正态分布的计量资料以表示,两组间比较采用独立样本t检验;计数资料结果以[例(%)]表示,两组间比较采用χ2检验。变量间的相关分析采用 Pearson 相关分析。采用Origin软件做变量相关性热图。采用Python中的Scikit-learn(SKlearn)工具(https://scikit-learn.org/stable/),将BDNF、GDNF和HOMA-IR作为自变量,是否患病作为因变量建立二元logistic回归模型,并用5折交叉验证进行验证,计算平均诊断模型和受试者工作特征(receiver operating characteristic,ROC)曲线。双侧检验,检验水准α=0.05。
研究共纳入了142例SCZ(男70例,女72例)和140名HC(男72名,女68名)。两组间比较结果显示:在性别、年龄、体质指数(body mass index,BMI)、受教育年限、吸烟史等方面,两组比较差异无统计学意义(均P>0.05);在认知功能七大领域评分方面,SCZ组均低于HC组,差异有统计学意义(均P<0.001);SCZ组血清BDNF和GDNF水平明显低于HC组,差异有统计学意义(均P<0.001);SCZ组FINS和HOMA-IR水平高于HC组,差异有统计学意义(均P<0.001);两组FBG水平比较差异无统计学意义(P>0.05)(表1)。
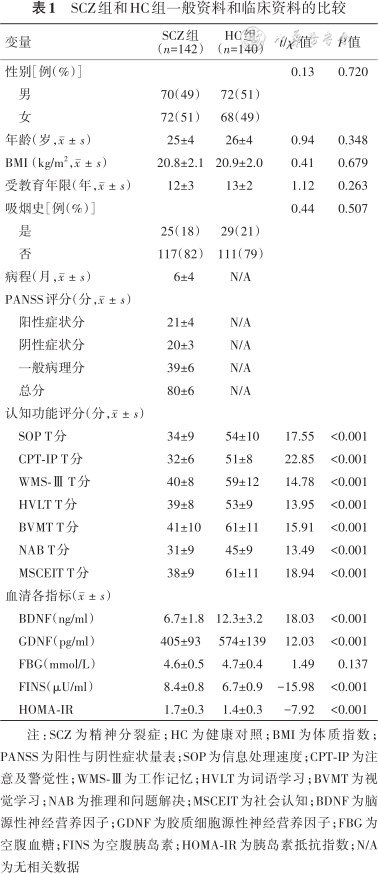
SCZ组和HC组一般资料和临床资料的比较
SCZ组和HC组一般资料和临床资料的比较
| 变量 | SCZ组 (n=142) | HC组 (n=140) | t/χ2值 | P值 |
|---|---|---|---|---|
| 性别[例(%)] | 0.13 | 0.720 | ||
| 男 | 70(49) | 72(51) | ||
| 女 | 72(51) | 68(49) | ||
| 年龄(岁,) | 25±4 | 26±4 | 0.94 | 0.348 |
| BMI(kg/m2,) | 20.8±2.1 | 20.9±2.0 | 0.41 | 0.679 |
| 受教育年限(年,) | 12±3 | 13±2 | 1.12 | 0.263 |
| 吸烟史[例(%)] | 0.44 | 0.507 | ||
| 是 | 25(18) | 29(21) | ||
| 否 | 117(82) | 111(79) | ||
| 病程(月,) | 6±4 | N/A | ||
| PANSS评分(分,) | ||||
| 阳性症状分 | 21±4 | N/A | ||
| 阴性症状分 | 20±3 | N/A | ||
| 一般病理分 | 39±6 | N/A | ||
| 总分 | 80±6 | N/A | ||
| 认知功能评分(分,) | ||||
| SOP T分 | 34±9 | 54±10 | 17.55 | <0.001 |
| CPT-IP T分 | 32±6 | 51±8 | 22.85 | <0.001 |
| WMS-Ⅲ T分 | 40±8 | 59±12 | 14.78 | <0.001 |
| HVLT T分 | 39±8 | 53±9 | 13.95 | <0.001 |
| BVMT T分 | 41±10 | 61±11 | 15.91 | <0.001 |
| NAB T分 | 31±9 | 45±9 | 13.49 | <0.001 |
| MSCEIT T分 | 38±9 | 61±11 | 18.94 | <0.001 |
| 血清各指标() | ||||
| BDNF(ng/ml) | 6.7±1.8 | 12.3±3.2 | 18.03 | <0.001 |
| GDNF(pg/ml) | 405±93 | 574±139 | 12.03 | <0.001 |
| FBG(mmol/L) | 4.6±0.5 | 4.7±0.4 | 1.49 | 0.137 |
| FINS(μU/ml) | 8.4±0.8 | 6.7±0.9 | -15.98 | <0.001 |
| HOMA-IR | 1.7±0.3 | 1.4±0.3 | -7.92 | <0.001 |
注:SCZ为精神分裂症;HC为健康对照;BMI为体质指数;PANSS为阳性与阴性症状量表;SOP为信息处理速度;CPT-IP为注意及警觉性;WMS-Ⅲ为工作记忆;HVLT为词语学习;BVMT为视觉学习;NAB为推理和问题解决;MSCEIT为社会认知;BDNF为脑源性神经营养因子;GDNF为胶质细胞源性神经营养因子;FBG为空腹血糖;FINS为空腹胰岛素;HOMA-IR为胰岛素抵抗指数;N/A为无相关数据
BDNF水平与PANSS中的阴性症状评分、总分呈负相关(r=-0.31、P<0.001,r=-0.17、P=0.040),与认知功能领域中的CPT-IP T分、WSM-Ⅲ T分、BVMT T分呈正相关(r=0.39、0.37、0.29,均P<0.001),与PANSS其他各项评分及认知功能其他领域评分均无明显相关性(均P>0.05);GDNF水平与认知功能领域中的CPT-IP T分、WSM-Ⅲ T分、BVMT T分呈正相关(r=0.32、P<0.001,r=0.23、P=0.007,r=0.40、P<0.001),与PANSS各项评分及认知功能其他领域评分均无明显相关性(均P>0.05);FINS水平与PANSS各项评分及认知功能各领域评分均无明显相关性(均P>0.05);HOMA-IR水平与认知功能领域中的MSCEIT T分呈正相关(r=0.18,P=0.033),与认知功能其他领域评分及PANSS各项评分均无明显相关性(均P>0.05)(图1)。
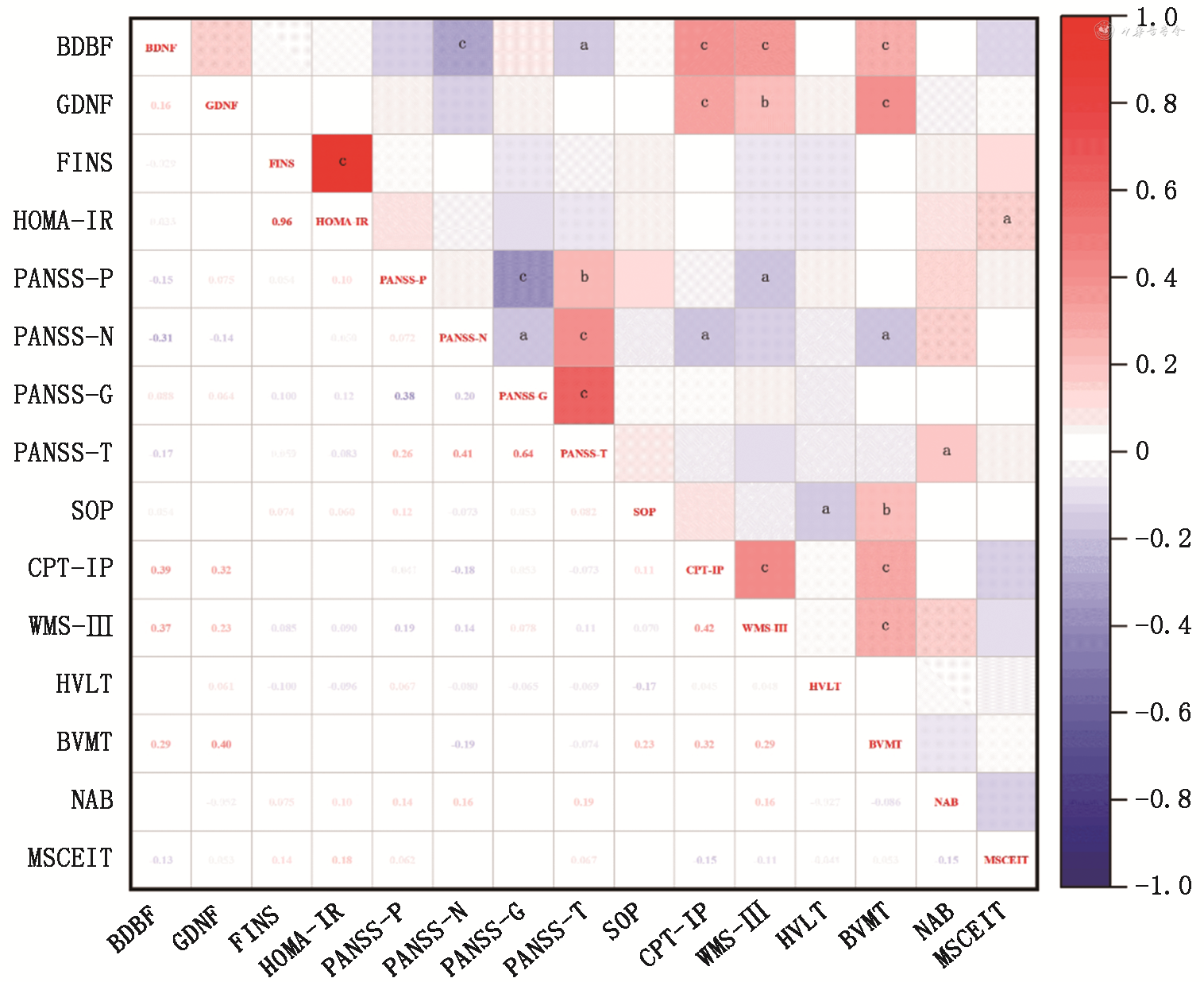

注:aP≤0.05;bP≤0.01;cP≤0.001;BDNF为脑源性神经营养因子;GDNF为胶质细胞源性神经营养因子;FINS为空腹胰岛素;HOMA-IR为胰岛素抵抗指数;PANSS-P为PANSS阳性症状分;PANSS-N为PANSS阴性症状分;PANSS-G为PANSS一般病理分;PANSS-T为PANSS总分;SOP为信息处理速度;CPT-IP为注意及警觉性;WMS-Ⅲ为工作记忆;HVLT为词语学习;BVMT为视觉学习;NAB为推理和问题解决;MSCEIT为社会认知
由上述结果可知,BDNF、GDNF及HOMA-IR与SCZ患者的精神症状或认知功能存在相关性,故将这三个指标作为自变量纳入模型,由表2可知这三个指标之间不存在多重共线性。采用Python中的sklearn机器学习库进行logistic回归分析,并用5折交叉验证将所有受试者(SCZ 142例,HC 140名)随机分成5份,其中4份为训练集,1份为验证集,共进行5次评估,最后得到平均ROC曲线,建立SCZ诊断模型。结果显示,通过BDNF、GDNF和HOMA-IR能够显著区分患者和健康对照[平均ROC曲线下面积(AUC)=0.89](95%CI:0.832~0.940),平均准确度为0.89,模型的灵敏度为0.94,特异度为0.82(图2)。
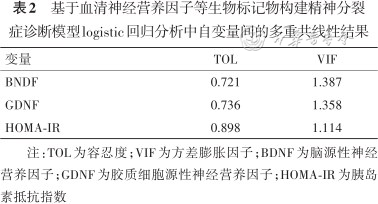
基于血清神经营养因子等生物标记物构建精神分裂症诊断模型logistic回归分析中自变量间的多重共线性结果
基于血清神经营养因子等生物标记物构建精神分裂症诊断模型logistic回归分析中自变量间的多重共线性结果
| 变量 | TOL | VIF |
|---|---|---|
| BNDF | 0.721 | 1.387 |
| GDNF | 0.736 | 1.358 |
| HOMA-IR | 0.898 | 1.114 |
注:TOL为容忍度;VIF为方差膨胀因子;BDNF为脑源性神经营养因子;GDNF为胶质细胞源性神经营养因子;HOMA-IR为胰岛素抵抗指数
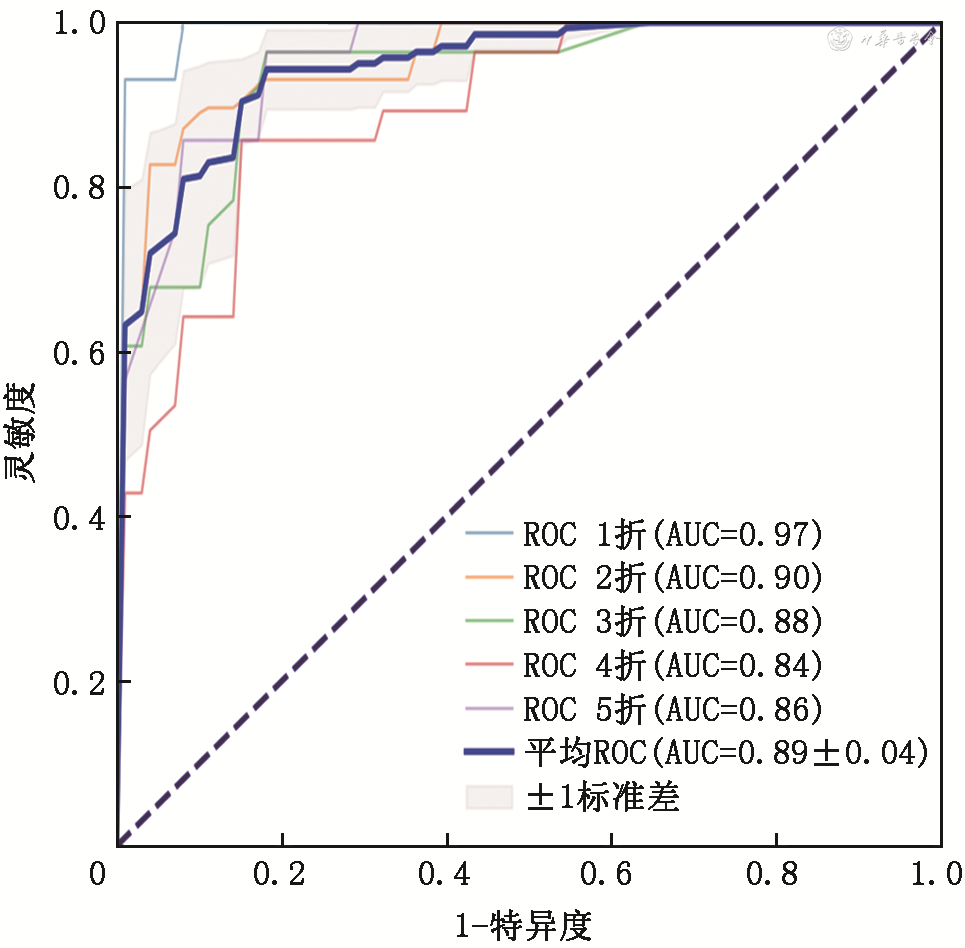

注:BDNF为脑源性神经营养因子;GDNF为胶质细胞源性神经营养因子;HOMA-IR为胰岛素抵抗指数;SCZ为精神分裂症;AUC为ROC曲线下面积
随着生物信息化发展,越来越多的生物标志物被用于SCZ的辅助诊断,比如血清蛋白因子[6]、氨基酸受体、微RNA、表观遗传学、磁共振影像,甚至是干细胞的神经元活性[7]等都曾被用于SCZ发病预测。这些在一定程度上可能为SCZ的早期诊断提供帮助,但因性价比和准确性低等局限性限制了在临床中的应用。因此,探寻简单易行、准确性高的SCZ早期诊断生物标记物很有必要。本研究通过纳入与神经发育异常相关的生物标记物构建了一个简便易行且具有较好诊断效能SCZ诊断模型。
目前已有大量研究提示,血清BNDF、GDNF水平不仅与SCZ患者的认知功能密切相关[8],同时与患者的精神症状也有一定关系[9]。血清BNDF、GDNF水平越低,患者精神症状越严重,认知功能越差。本研究也有类似发现,可能原因如下:BDNF与黑质多巴胺能神经元、5-羟色胺能神经元的可塑性关系密切[10],两种神经元的受损是目前公认的SCZ发病的重要原因;而GDNF及其受体在海马及前额皮质高表达,可以增强多巴胺、5-羟色胺和胆碱的传递[11],中枢GDNF水平升高时可以促进海马神经再生,进而增强学习和记忆进程[12]。虽然由于血脑屏障的存在,外周的BNDF、GDNF水平不能完全反映中枢情况,但仍有一定的借鉴意义。近年来的研究发现,SCZ表型可能与代谢表型共享重叠的遗传位点[13, 14],高FINS水平的遗传倾向与SCZ风险的增加有因果联系[15]。这提示代谢相关指标具有参与SCZ发生的可能性。目前,研究已发现SCZ患者在治疗前已经存在高水平的FINS和HOMA-IR,且二者水平与患者的临床症状和认知功能有关[16, 17, 18, 19]。本研究发现了HOMA-IR与认知具有一定的相关性,未发现与临床症状之间存在关系,这可能与研究的样本量及所选SCZ患者的临床分型、病程长短、发病次数等有关。以上研究结果显示了BNDF、GDNF和代谢指标在SCZ中的重要作用,为本研究基于此构建疾病的诊断模型提供了依据。
多数SCZ诊断模型的研究包含了大量的预测因子,部分模型甚至可以高达51种预测因子[20],如Chan等[21]通过纳入26种生物标记物作为自变量建立SCZ诊断模型,最终得到的模型AUC为0.96,这类模型虽然一般有较高的诊断效能,但因预测因子过多会导致检测繁琐且价格昂贵,进而降低应用于临床的可能性。当然,也有一些诊断模型使用了较少的指标将患者与正常人群区分开来,如Zaki等[22]将外周血单核细胞标记物作为预测因子构建的诊断模型,诊断SCZ的AUC值为0.84,但该研究中有些生物标记物的检测需要采血后立即进行,临床上实施存在难度。通过总结前人研究的经验与教训得知:SCZ疾病诊断模型预测因子的选择宜遵循取材容易、检测便捷、经济可行以及准确性高等原则。血清BDNF、GDNF和HOMA-IR等指标的检测方法简单、经济、快捷,本研究通过纳入这些指标作为预测因子构建了SCZ早期诊断模型,说明本研究具有很强的临床实用性。研究最终得到的诊断模型AUC为0.89,准确度为0.89,灵敏度为0.94,特异度为0.82,说明了该模型对SCZ的早期诊断有较好的预测能力。
本研究存在一些不足之处。首先,本研究样本量较小,后续需要扩大样本量进一步验证该模型的诊断效能;其次,研究中筛选的生物标记物较少,增加其他与SCZ关系密切的生物标记物(如风险基因、肠道菌群和代谢物等)作为自变量,可能会进一步提高模型的准确度。
总之,诊断模型的构建为临床早期快速辅助诊断SCZ提供了新的方法,方便临床医生在疾病早期,甚至是早早期识别患者,从而进行早期干预以改善预后。
庞礼娟, 李雪, 袁秀霞, 等. 基于血清神经营养因子等生物标记物的精神分裂症诊断模型的构建[J]. 中华医学杂志, 2023, 103(17): 1310-1315. DOI: 10.3760/cma.j.cn112137-20221212-02631.
所有作者均声明不存在利益冲突



























