
探究基于笛卡尔采集的K空间共享三维容积快速动态成像(DISCO)和复合灵敏度编码的高分辨率扩散成像(MUSE-DWI)联合前列腺特异性抗原密度(PSAD)在前列腺癌(PCa)的诊断及危险分层中的价值。
回顾性收集2020年7月至2021年8月宁夏医科大学总医院183例[年龄:48~86(68±8)岁]前列腺疾病患者的资料。根据疾病情况分为非PCa组115例,PCa组68例,其中PCa组又根据危险程度分为低危PCa组14例,中高危PCa组54例。分析组间容积转移常数(Ktrans)、速率常数(Kep)、血管外细胞外体积分数(Ve)、表观扩散系数(ADC)和PSAD的差异。采用受试者工作特征(ROC)曲线评估各定量参数值及PSAD鉴别非PCa和PCa、低危PCa和中高危PCa的诊断效能。采用多因素logistic回归模型对非PCa组和PCa组间差异有统计学意义的指标进行分析,筛选出PCa的预测因子。
PCa组的Ktrans、Kep、Ve值和PSAD均高于非PCa组,ADC值低于非PCa组,差异均有统计学意义(均P<0.001);中高危PCa组的Ktrans、Kep值和PSAD均高于低危PCa组,ADC值低于低危PCa组,差异均有统计学意义(均P<0.001)。鉴别非PCa和PCa时,联合模型(Ktrans+Kep+Ve+ADC+PSAD)的ROC曲线下面积(AUC)高于单一指标[0.958(95%CI:0.918~0.982)比0.881(95%CI:0.825~0.924)、0.836(95%CI:0.775~0.887)、0.672(95%CI:0.599~0.740)、0.940(95%CI:0.895~0.969)、0.816(95%CI:0.752~0.869),均P<0.05];鉴别低危PCa和中高危PCa时,联合模型(Ktrans+Kep+ADC+PSAD)的AUC高于Ktrans、Kep和PSAD[0.933(95%CI:0.845~0.979)比0.846(95%CI:0.738~0.922)、0.782(95%CI:0.665~0.873)、0.848(95%CI:0.740~0.923),均P<0.05]。多因素logistic回归分析显示Ktrans(OR=1.005,95%CI:1.001~1.010)和ADC值(OR=0.992,95%CI:0.989~0.995)是PCa的预测因子(P<0.05)。
DISCO和MUSE-DWI联合PSAD可以鉴别前列腺良恶性病变,Ktrans和ADC值是PCa的预测因子;Ktrans、Kep、ADC值和PSAD有助于预测PCa的生物学行为。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
动态增强(dynamic contrast-enhanced,DCE)磁共振和扩散加权成像(diffusion-weighted imaging,DWI)为前列腺癌(prostate cancer,PCa)的诊断和侵袭性评估提供了重要依据[1, 2, 3]。然而受制于传统的K空间逐期填充方式,DCE的时间分辨率和空间分辨率严重相互制约,低空间分辨率会导致小病灶显示不清,影响前列腺良恶性病变的鉴别。而基于笛卡尔采集的 K空间共享三维容积快速动态成像(differential subsampling with cartesian ordering,DISCO)[4]是一种新兴的DCE-MR技术,具有并行成像K空间视图共享重建等优势,能够在保持高空间分辨率的同时,改善时间分辨率。其次传统DWI基于单次激发平面回波成像,其图像易模糊、变形,影响ADC值测量的准确性;而基于复合灵敏度编码的高分辨率扩散成像(multiplexed sensitivity-encoding diffusion-weighted imaging,MUSE-DWI)[5]是一种多次激发扩散成像技术,具有高的空间分辨率,其图像变形小、图像质量更好。目前,DISCO和MUSE-DWI已经成功地应用于肝脏、乳腺、胰腺、小肠病变[6, 7, 8, 9, 10, 11]等,但在前列腺病变中的应用少有报道。此外,前列腺特异性抗原密度(prostate specific antigen density,PSAD)可以为前列腺活检提供参考信息,使部分患者免于活检和避免低危PCa的过度诊断,但是仍会漏诊部分高危PCa[12]。因此,本研究旨在通过比较定量参数值及PSAD的差异,评估各定量参数值及PSAD的诊断效能,以及筛选PCa的预测因子,探究DISCO和MUSE-DWI联合PSAD在PCa的诊断及危险分层中的价值。
本研究为基于横断面研究的诊断试验。回顾性收集2020年7月至2021年8月在宁夏医科大学总医院行多参数磁共振(multi-parameter magnetic resonance,mp-MRI)检查的前列腺疾病患者的影像、临床及病理资料。纳入标准:(1)MRI检查序列完整,包括T1加权像、T2加权像(轴位、冠状位、矢状位)、MUSE-DWI及DISCO序列;(2)所有患者行MRI检查后,1个月内行穿刺或根治术。排除标准:(1)MRI检查前接受过任何相关治疗;(2)MRI图像质量差,影响感兴趣区(region of interest,ROI)的勾画;(3)病灶最大径<5 mm。本研究最终纳入183例患者,年龄48~86(68±8)岁。根据病理结果分为PCa组和非PCa组[包括前列腺良性增生和(或)前列腺炎],其中非PCa组115例为前列腺良性病变,PCa组68例为PCa。本研究已通过宁夏医科大学总医院医学伦理委员会批准(2018-339),受试者知情同意豁免。
1.扫描方法:扫描所用设备为GE SIGNATM Architect 3.0 T MR扫描仪(美国GE公司)和32通道心脏相控线圈。具体扫描序列及参数见表1。MUSE-DWI的b值取0、1 000 s/mm2。DISCO共扫描64个时相(共5 min 12 s),于第2时相开始经肘静脉以3.0 ml/s的流速团注对比剂钆双胺0.1 mmol/kg及生理盐水20 ml。
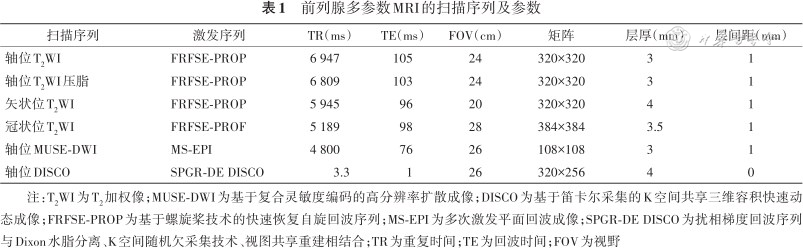
前列腺多参数MRI的扫描序列及参数
前列腺多参数MRI的扫描序列及参数
| 扫描序列 | 激发序列 | TR(ms) | TE(ms) | FOV(cm) | 矩阵 | 层厚(mm) | 层间距(mm) |
|---|---|---|---|---|---|---|---|
| 轴位T2WI | FRFSE-PROP | 6 947 | 105 | 24 | 320×320 | 3 | 1 |
| 轴位T2WI压脂 | FRFSE-PROP | 6 809 | 103 | 24 | 320×320 | 3 | 1 |
| 矢状位T2WI | FRFSE-PROP | 5 945 | 96 | 20 | 320×320 | 4 | 1 |
| 冠状位T2WI | FRFSE-PROF | 5 189 | 98 | 28 | 384×384 | 3.5 | 1 |
| 轴位MUSE-DWI | MS-EPI | 4 800 | 76 | 26 | 108×108 | 3 | 1 |
| 轴位DISCO | SPGR-DE DISCO | 3.3 | 1 | 26 | 320×256 | 4 | 0 |
注:T2WI为T2加权像;MUSE-DWI为基于复合灵敏度编码的高分辨率扩散成像;DISCO为基于笛卡尔采集的K空间共享三维容积快速动态成像;FRFSE-PROP为基于螺旋桨技术的快速恢复自旋回波序列;MS-EPI为多次激发平面回波成像;SPGR-DE DISCO为扰相梯度回波序列与Dixon水脂分离、K空间随机欠采集技术、视图共享重建相结合;TR为重复时间;TE为回波时间;FOV为视野
2.临床指标及病理:血清前列腺特异性抗原(prostate specific antigen,PSA)在mp-MRI检查前2周内检测(本研究的PSA指前列腺特异性总抗原),PSAD=PSA/前列腺体积(prostate volume,PV)。通过经直肠超声引导下穿刺活检或根治术获得病理结果。穿刺或根治术后,根据2005年国际泌尿外科病理学会共识的新Gleason系统[13],对所有PCa病变进行分级:低危PCa:Gleason评分≤6分;中高危PCa:Gleason评分≥7分。
3.图像后处理:将MRI图像导入GE ADW 4.7后处理工作站,由两名放射科医师(在前列腺诊断方面分别有3年和5年经验),参考PI-RADS v2.1对所有病灶的病理结果与之对应的MRI图像达成共识。对于多灶病例,选取Gleason评分最高的病灶。ROI的选取避开所有影响因素(尿道口、血管、精囊腺等)。在GenIQ软件包打开DISCO图像,参考T2加权成像(T2WI)和MUSE-DWI图像,选择病灶强化最显著时相,分别在病灶最大层面及其上下两层勾画ROI(10~30 mm2),同时在容积转移常数(volume transfer constant,Ktrans)、速率常数(rate constant,Kep)、血管外细胞外体积分数(extravascular extracellular volume fraction,Ve)伪彩图上自动生成相应的ROI及参数值,取平均值。然后在READYView软件包中打开MUSE-DWI图像,将ROI匹配到MUSE-DWI图像上,同时在表面扩散系数(ADC)图上自动生成相应的ROI及ADC值,取平均值。最终的结果取两名放射科医师测量结果的平均值;病例图像见图1, 2, 3, 4。
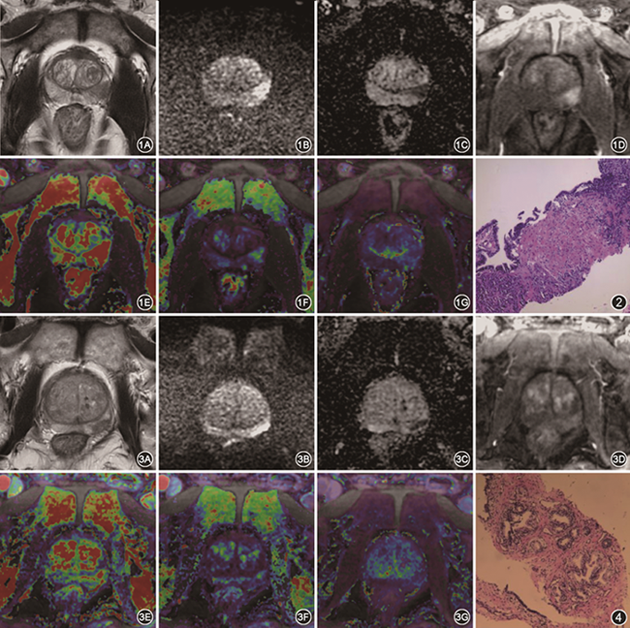

注:PSA为前列腺特异性抗原;T2WI为T2加权成像;MUSE-DWI为基于复合灵敏度编码的高分辨率扩散成像;ADC为表观扩散系数;DISCO为基于笛卡尔采集的K空间共享三维容积快速动态成像;Ktrans为容积转移常数;Kep为速率常数;Ve为血管外细胞外体积分数
使用SPSS 26.0和Medcalc19.0.4软件进行统计学分析。对计量资料行正态性及方差齐性检验;符合正态分布者以表示,采用独立样本t检验进行组间单因素分析;不符合正态分布者以M(Q1,Q3)表示,采用Mann-Whitney U检验进行组间单因素分析。采用受试者工作特征(receiver operating characteristic,ROC)曲线评估诊断效能,采用Z检验比较曲线下面积(area under curve,AUC)之间的差异。采用多因素logistic回归模型对非PCa组和PCa组间差异有统计学意义的指标进行分析,筛选出PCa的预测因子。双侧检验,检验水准α=0.05。
非PCa组和PCa组患者的年龄、PSA、PV、PSAD和病灶最大径差异均有统计学意义(均P<0.05,表2);低危PCa组和中高危PCa组患者的PSA、PV、PSAD和病灶最大径差异均有统计学意义(P<0.05,表3),年龄差异无统计学意义(P=0.417,表3)。
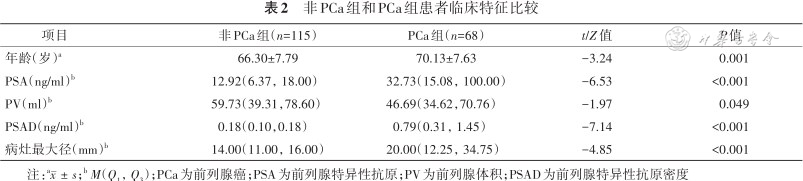
非PCa组和PCa组患者临床特征比较
非PCa组和PCa组患者临床特征比较
| 项目 | 非PCa组(n=115) | PCa组(n=68) | t/Z值 | P值 |
|---|---|---|---|---|
| 年龄(岁)a | 66.30±7.79 | 70.13±7.63 | -3.24 | 0.001 |
| PSA(ng/ml)b | 12.92(6.37,18.00) | 32.73(15.08,100.00) | -6.53 | <0.001 |
| PV(ml)b | 59.73(39.31,78.60) | 46.69(34.62,70.76) | -1.97 | 0.049 |
| PSAD(ng/ml)b | 0.18(0.10,0.18) | 0.79(0.31,1.45) | -7.14 | <0.001 |
| 病灶最大径(mm)b | 14.00(11.00,16.00) | 20.00(12.25,34.75) | -4.85 | <0.001 |
注:a;b M(Q1,Q3);PCa为前列腺癌;PSA为前列腺特异性抗原;PV为前列腺体积;PSAD为前列腺特异性抗原密度
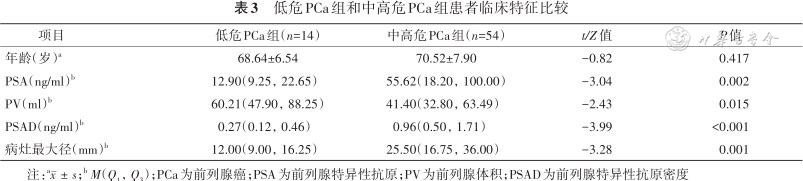
低危PCa组和中高危PCa组患者临床特征比较
低危PCa组和中高危PCa组患者临床特征比较
| 项目 | 低危PCa组(n=14) | 中高危PCa组(n=54) | t/Z值 | P值 |
|---|---|---|---|---|
| 年龄(岁)a | 68.64±6.54 | 70.52±7.90 | -0.82 | 0.417 |
| PSA(ng/ml)b | 12.90(9.25,22.65) | 55.62(18.20,100.00) | -3.04 | 0.002 |
| PV(ml)b | 60.21(47.90,88.25) | 41.40(32.80,63.49) | -2.43 | 0.015 |
| PSAD(ng/ml)b | 0.27(0.12,0.46) | 0.96(0.50,1.71) | -3.99 | <0.001 |
| 病灶最大径(mm)b | 12.00(9.00,16.25) | 25.50(16.75,36.00) | -3.28 | 0.001 |
注:a;b M(Q1,Q3);PCa为前列腺癌;PSA为前列腺特异性抗原;PV为前列腺体积;PSAD为前列腺特异性抗原密度
PCa组的Ktrans、Kep、Ve值均高于非PCa组[712.0(530.5,1 068.3)×10-3/min比(356.5±156.1)×10-3/min,3 018.0(1 770.3,3 918.0)×10-3/min比1 156.0(842.0,1 802.0)×10-3/min,(381.3±145.0)×10-3/min比(308.1±105.2)×10-3/min](Z/t=-8.61、-7.60、-3.94,均P<0.001),ADC值低于非PCa组[(630.9±229.4)mm2/s比(1 189.1±280.5)mm2/s](t=13.89,P<0.001)(表4)。
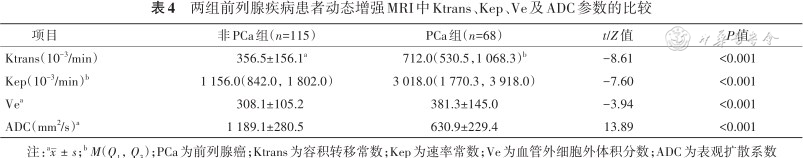
两组前列腺疾病患者动态增强MRI中Ktrans、Kep、Ve及ADC参数的比较
两组前列腺疾病患者动态增强MRI中Ktrans、Kep、Ve及ADC参数的比较
| 项目 | 非PCa组(n=115) | PCa组(n=68) | t/Z值 | P值 |
|---|---|---|---|---|
| Ktrans(10-3/min) | 356.5±156.1a | 712.0(530.5,1 068.3)b | -8.61 | <0.001 |
| Kep(10-3/min)b | 1 156.0(842.0,1 802.0) | 3 018.0(1 770.3,3 918.0) | -7.60 | <0.001 |
| Vea | 308.1±105.2 | 381.3±145.0 | -3.94 | <0.001 |
| ADC(mm2/s)a | 1 189.1±280.5 | 630.9±229.4 | 13.89 | <0.001 |
注:a;b M(Q1,Q3);PCa为前列腺癌;Ktrans为容积转移常数;Kep为速率常数;Ve为血管外细胞外体积分数;ADC为表观扩散系数
中高危PCa组的Ktrans、Kep值均高于低危PCa组[817.0(577.0,1 152.3)×10-3/min比(488.6±111.8)×10-3/min,3 171.5(2 006.5,4 733.5)×10-3/min比(1 892.3±769.4)×10-3/min](Z=-3.97、-3.23,均P<0.001),ADC值低于低危PCa组[(572.6±197.9)mm2/s比(855.6±207.6)mm2/s](t=4.72,P<0.001)(表5)。
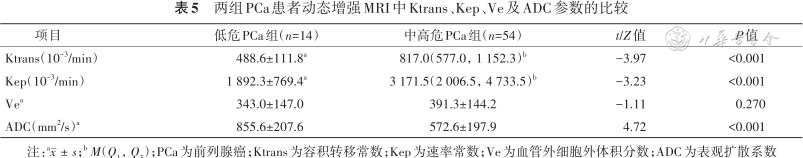
两组PCa患者动态增强MRI中Ktrans、Kep、Ve及ADC参数的比较
两组PCa患者动态增强MRI中Ktrans、Kep、Ve及ADC参数的比较
| 项目 | 低危PCa组(n=14) | 中高危PCa组(n=54) | t/Z值 | P值 |
|---|---|---|---|---|
| Ktrans(10-3/min) | 488.6±111.8a | 817.0(577.0,1 152.3)b | -3.97 | <0.001 |
| Kep(10-3/min) | 1 892.3±769.4a | 3 171.5(2 006.5,4 733.5)b | -3.23 | <0.001 |
| Vea | 343.0±147.0 | 391.3±144.2 | -1.11 | 0.270 |
| ADC(mm2/s)a | 855.6±207.6 | 572.6±197.9 | 4.72 | <0.001 |
注:a;b M(Q1,Q3);PCa为前列腺癌;Ktrans为容积转移常数;Kep为速率常数;Ve为血管外细胞外体积分数;ADC为表观扩散系数
鉴别非PCa和PCa时,联合模型(Ktrans+Kep+Ve+ADC+PSAD)的诊断效能(AUC)高于Ktrans、Kep、Ve、ADC值和PSAD(0.958比0.881、0.836、0.672、0.940、0.816;Z=3.22、4.18、6.71、2.47、4.48,均P<0.05)(表6和图5A)。
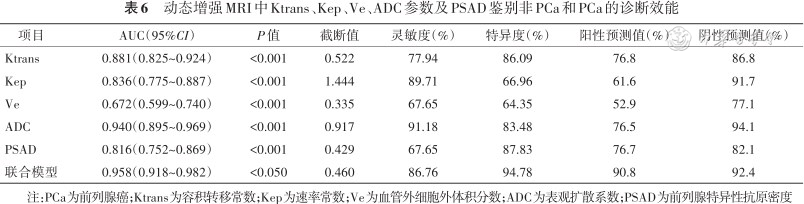
动态增强MRI中Ktrans、Kep、Ve、ADC参数及PSAD鉴别非PCa和PCa的诊断效能
动态增强MRI中Ktrans、Kep、Ve、ADC参数及PSAD鉴别非PCa和PCa的诊断效能
| 项目 | AUC(95%CI) | P值 | 截断值 | 灵敏度(%) | 特异度(%) | 阳性预测值(%) | 阴性预测值(%) |
|---|---|---|---|---|---|---|---|
| Ktrans | 0.881(0.825~0.924) | <0.001 | 0.522 | 77.94 | 86.09 | 76.8 | 86.8 |
| Kep | 0.836(0.775~0.887) | <0.001 | 1.444 | 89.71 | 66.96 | 61.6 | 91.7 |
| Ve | 0.672(0.599~0.740) | <0.001 | 0.335 | 67.65 | 64.35 | 52.9 | 77.1 |
| ADC | 0.940(0.895~0.969) | <0.001 | 0.917 | 91.18 | 83.48 | 76.5 | 94.1 |
| PSAD | 0.816(0.752~0.869) | <0.001 | 0.429 | 67.65 | 87.83 | 76.7 | 82.1 |
| 联合模型 | 0.958(0.918~0.982) | <0.050 | 0.460 | 86.76 | 94.78 | 90.8 | 92.4 |
注:PCa为前列腺癌;Ktrans为容积转移常数;Kep为速率常数;Ve为血管外细胞外体积分数;ADC为表观扩散系数;PSAD为前列腺特异性抗原密度
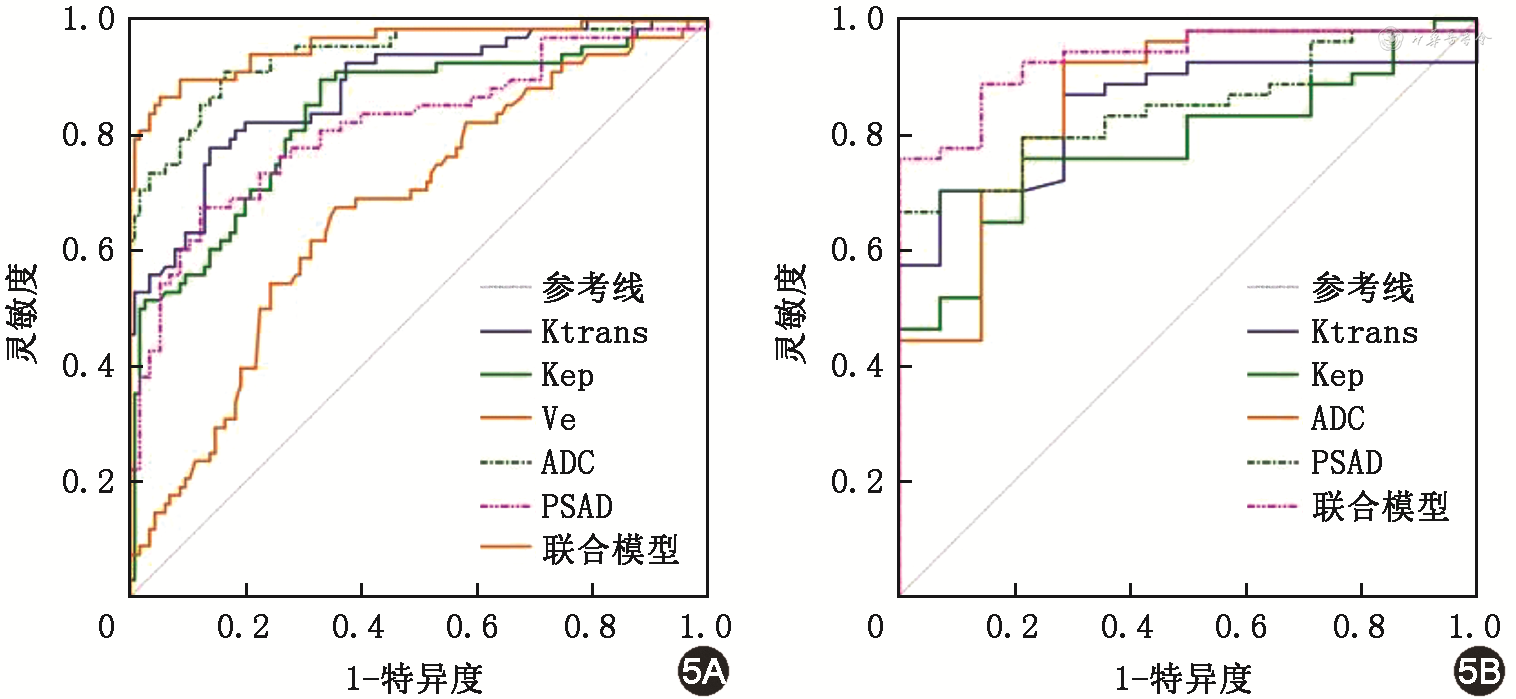

注:Ktrans为容积转移常数;Kep为速率常数;Ve为血管外细胞外体积分数;ADC为表观扩散系数;PSAD为前列腺特异性抗原密度;PCa为前列腺癌
鉴别低危PCa和中高危PCa时,联合模型(Ktrans+Kep+ADC+PSAD)的诊断效能(AUC)高于Ktrans、Kep和PSAD(0.933比0.846、0.782、0.848;Z=2.49、2.90、2.39,均P<0.05),略高于ADC值(Z=1.59,P=0.112)(表7和图5B)。
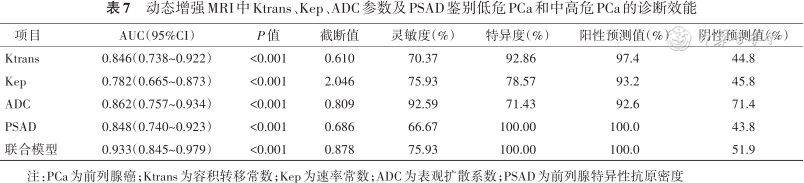
动态增强MRI中Ktrans、Kep、ADC参数及PSAD鉴别低危PCa和中高危PCa的诊断效能
动态增强MRI中Ktrans、Kep、ADC参数及PSAD鉴别低危PCa和中高危PCa的诊断效能
| 项目 | AUC(95%CI) | P值 | 截断值 | 灵敏度(%) | 特异度(%) | 阳性预测值(%) | 阴性预测值(%) |
|---|---|---|---|---|---|---|---|
| Ktrans | 0.846(0.738~0.922) | <0.001 | 0.610 | 70.37 | 92.86 | 97.4 | 44.8 |
| Kep | 0.782(0.665~0.873) | <0.001 | 2.046 | 75.93 | 78.57 | 93.2 | 45.8 |
| ADC | 0.862(0.757~0.934) | <0.001 | 0.809 | 92.59 | 71.43 | 92.6 | 71.4 |
| PSAD | 0.848(0.740~0.923) | <0.001 | 0.686 | 66.67 | 100.00 | 100.0 | 43.8 |
| 联合模型 | 0.933(0.845~0.979) | <0.001 | 0.878 | 75.93 | 100.00 | 100.0 | 51.9 |
注:PCa为前列腺癌;Ktrans为容积转移常数;Kep为速率常数;ADC为表观扩散系数;PSAD为前列腺特异性抗原密度
单因素分析结果显示非PCa组和PCa组的Ktrans、Kep、Ve、ADC值和PSAD的差异均有统计学意义(均P<0.001,表2和4),将以上指标纳入二元logistic回归模型,多因素分析结果显示Ktrans和ADC值是PCa的预测因子(OR=1.005,P=0.010;OR=0.992,P<0.001)(表8),二者联合预测PCa的AUC为0.956(Z=33.83,P<0.001),优于Ktrans和ADC值(Z=3.28、2.41,均P<0.05),与联合模型相当(Z=0.40,P=0.690);当截断值>0.414时,灵敏度为88.24%,特异度为91.30%。
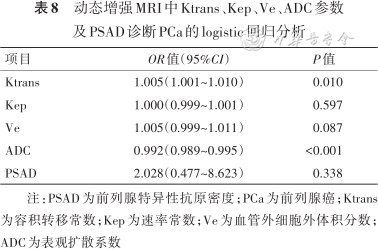
动态增强MRI中Ktrans、Kep、Ve、ADC参数及PSAD诊断PCa的logistic回归分析
动态增强MRI中Ktrans、Kep、Ve、ADC参数及PSAD诊断PCa的logistic回归分析
| 项目 | OR值(95%CI) | P值 |
|---|---|---|
| Ktrans | 1.005(1.001~1.010) | 0.010 |
| Kep | 1.000(0.999~1.001) | 0.597 |
| Ve | 1.005(0.999~1.011) | 0.087 |
| ADC | 0.992(0.989~0.995) | <0.001 |
| PSAD | 2.028(0.477~8.623) | 0.338 |
注:PSAD为前列腺特异性抗原密度;PCa为前列腺癌;Ktrans为容积转移常数;Kep为速率常数;Ve为血管外细胞外体积分数;ADC为表观扩散系数
既往研究中关于Ktrans、Kep、Ve和ADC值联合PSAD鉴别非PCa和PCa、低危PCa和中高危PCa的文献鲜有报道。本研究分析了5个指标单独及联合鉴别非PCa和PCa、4个指标单独及联合鉴别低危PCa和中高危PCa的效能;确定了PCa的预测因子,并评价了各预测因子的联合预测效能。结果显示鉴别非PCa和PCa时,联合模型的效能最大,Ktrans和ADC值是PCa的预测因子,二者联合预测PCa效能与联合模型相当;鉴别低危PCa和中高危PCa时,联合模型的诊断效能最大,且与ADC值相当。
Ktrans反映对比剂经血浆向血管外细胞外扩散的能力(摄取对比剂的能力),受组织血浆流量和血管通透性的影响;Kep反映对比剂从血管外细胞外间隙返回血浆的能力;Ve反映血管外细胞外间隙的比例。本研究结果显示PCa组的Ktrans、Kep、Ve值均显著高于非PCa组,这与Ma等[14]研究结果类似,提示Ktrans、Kep和Ve值有助于鉴别前列腺良恶性病变;这可能由于PCa组织内富有大量新生血管[15],血管迅速生长、血管通透性增加,血管生长导致血管内皮细胞间隙增加,从而Ktrans和Kep值增加。本研究结果显示中高危PCa组的Ktrans和Kep值均显著高于低危PCa组,提示Ktrans和Kep值在一定程度上可以反映肿瘤的恶性程度;但Ve值无显著差异。Park等[16]研究结果得出前列腺癌Gleason 6分组和Gleason≥7分组的Ve值具有显著差异,这与本研究的结果不一致,可能与肿瘤的血管分布不均匀,影响血流的时空分布平衡、血管外细胞外间隙容积、组织静水压和缺血分数等因素,导致了Ve值的可变性有关[17]。
ADC值可以反映肿瘤的微环境,如细胞膜完整性和细胞密度[18]。本研究结果表明PCa组的ADC值显著低于非PCa组、中高危PCa组的ADC值显著低于低危PCa组,这可能由于ADC值与细胞密度有关,肿瘤组织细胞排列紧密,水分子运动受限,ADC值减低;肿瘤恶性程度越高,细胞排列越紧密,水分子运动越受限,ADC值越低。此外有研究亦表明ADC值可用于PCa的危险分层[19, 20]。
Ma等[14]研究分析了DCE和DWI定量参数诊断PCa的效能,研究得出Ktrans+Kep+Ve+ADC联合诊断的效能(AUC=0.940)最高,Zhu等[17]研究结果得出诊断PCa时,Ktrans、Kep和ADC的AUC分别为0.665、0.658和0.782,而Ktrans+Kep+ADC的AUC为0.904;提示诊断PCa时,联合诊断的效能优于单一指标。此外,已有研究探讨双参数MRI联合PSAD诊断中高危PCa的诊断效能[21],并且PSAD能够消除前列腺体积变化对PSA的影响,更加真实地反映腺体的破坏情况。因此,本研究在Ktrans、Kep、Ve和ADC值的基础上,联合PSAD进行研究,结果显示鉴别非PCa和PCa病变时,联合模型的效能最高(AUC=0.958),ADC值和Ktrans次之;此外,logistic回归模型显示Ktrans和ADC值是PCa的预测因子,二者联合预测的效能与联合模型相当,提示ADC值和Ktrans可作为诊断PCa的主要指标;鉴别低危PCa和中高危PCa病变时,联合模型的诊断效能(AUC=0.933)与ADC值(AUC=0.862)相当,PSAD次之,提示ADC值是PCa危险分层最重要的指标,PSAD亦可以作为主要指标。此外,诊断PCa时,本研究中Ktrans、Kep和ADC值的AUC较Ma等[14]和Zhu等[17]研究有所提高,可能与纳入的病例数、不同Gleason评分的PCa比例存在差异有关,还可能与DISCO和MUSE-DWI具有更高的空间和时间分辨率有关,这有待进一步的临床研究验证。
本研究的不足:(1)病理结果大多数来自穿刺活检标本,较难与MRI病灶完全一一对应;(2)ROI仅勾画最大层面及其上下两个层面方便临床应用,但涉及一定程度的主观性;(3)低危PCa病例数偏少。
综上所述,DISCO和MUSE-DWI联合PSAD可以鉴别前列腺良恶性病变,Ktrans和ADC值是PCa的预测因子;Ktrans、Kep、ADC值和PSAD有助于预测PCa的生物学行为。
陈志强, 张丹, 王卓, 等. DISCO和MUSE-DWI联合前列腺特异性抗原密度在前列腺癌的诊断及危险分层中的价值[J]. 中华医学杂志, 2023, 103(19): 1461-1468. DOI: 10.3760/cma.j.cn112137-20221018-02176.
所有作者均声明不存在利益冲突































