
正确分型诊断是原发性醛固酮增多症(PA)治疗决策的基础,也是临床难点。肾上腺静脉取血(AVS)一直是PA分型诊断的金标准。基于液相色谱串联质谱法(LC-MS/MS)的类固醇激素谱检查近年在肾上腺疾病诊治中愈发多见。本文报道1例影像上表现为双侧肾上腺病变的PA行AVS联合类固醇激素谱检查完成诊治,并对病例特点、诊治过程进行总结讨论和文献复习,以期为PA的分型诊断和精准治疗提供更多证据及思路。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者女性,59岁。因发现血压高1年、双侧肾上腺占位6个月,于2021年10月入住解放军总医院第一医学中心内分泌科。入院前1年,患者因血压升高,最高达150/100 mmHg(1 mmHg=0.133 kPa),当地医院诊断高血压病,予以硝苯地平缓释片20 mg、2次/日治疗。入院前6个月出现双下肢乏力,夜尿增多,2~5次/晚,超声示双侧肾上腺占位。入院前5个月因血压波动(最高230/120 mmHg)当地住院治疗,药物调整为硝苯地平缓释片20 mg、2次/日,厄贝沙坦氢氯噻嗪片162.5 mg、1次/日;肾上腺CT示双侧肾上腺小腺瘤。本次入院前10天停用厄贝沙坦氢氯噻嗪片,为明确肾上腺占位性质,以高血压、肾上腺占位待查收住院。病程中不伴头痛、心悸、出汗及面色改变,体重无明显变化。
体格检查:体温36.3 ℃,脉搏86次/min,呼吸19次/min,卧位血压115/68 mmHg,立位血压102/67 mmHg。未见紫纹及瘀斑等异常体征。实验室检查:血钾正常3.93 mmol/L,血钠正常140.6 mmol/L,血二氧化碳正常29.7 mmol/L,血钙、磷正常;尿钾、钠、钙、磷正常。血、尿、便常规正常,肝功能、肾功能、凝血及肿瘤标志物正常。血糖、糖化血红蛋白、甲状腺功能、性腺激素、脱氢表雄酮正常。24 h尿醛固酮14.7 μg/24 h(1.19~28.10 μg/24 h)(括号内为正常参考值,下同),24 h尿游离皮质醇(UFC)332.3 nmol/24 h(98.0~500.1 nmol/24 h),促肾上腺皮质激素-皮质醇(ACTH-F)节律0点皮质醇356.09 nmol/L(0~165.7 nmol/L),午夜1 mg地塞米松抑制试验晨8点皮质醇55.69 nmol/L。血甲氧基酪胺<24 pmol/L(≤100 pmol/L),甲氧基肾上腺素98.8 pmo1/L(≤420.9 pmo1/L),甲氧基去甲肾上腺素138.5 pmol/L(≤709.7 pmo1/L)。肾素-血管紧张素-醛固酮系统评估,体位试验:卧位/坐位2 h/坐位4 h的直接肾素浓度(PRC)1.3/3.3/3.8 mU/L、血浆醛固酮浓度(PAC)27.2/28.0/24.7 ng/dl(1 ng/dl=27.7 pmol/L);坐位2 h的血浆醛固酮与肾素活性比值(ARR):8.5(阳性判断标准:ARR≥3.7[1]),提示该患者原发性醛固酮增多症(primary aldosteronism,PA)初筛阳性,醛固酮瘤可能(坐位4 hPAC较卧位PAC不升反降[2])。进一步行确诊试验:生理盐水试验前PAC为21.3 ng/dl,试验后PAC为13.8 ng/dl(阳性判断标准:试验后PAC>10 ng/dl[1]);卡托普利试验前PAC、PRC分别为17.5 ng/dl、3.1 mU/L,口服50 mg卡托普利片2 h后PAC、PRC分别为15.4 ng/dl、5.6 mU/L(阳性判断标准:试验后2 h PAC>11 ng/dl[3])。该患者确诊试验均支持PA。影像学检查:肾上腺增强CT(图1):双侧肾上腺小结节,考虑良性,皮质腺瘤可能性大。
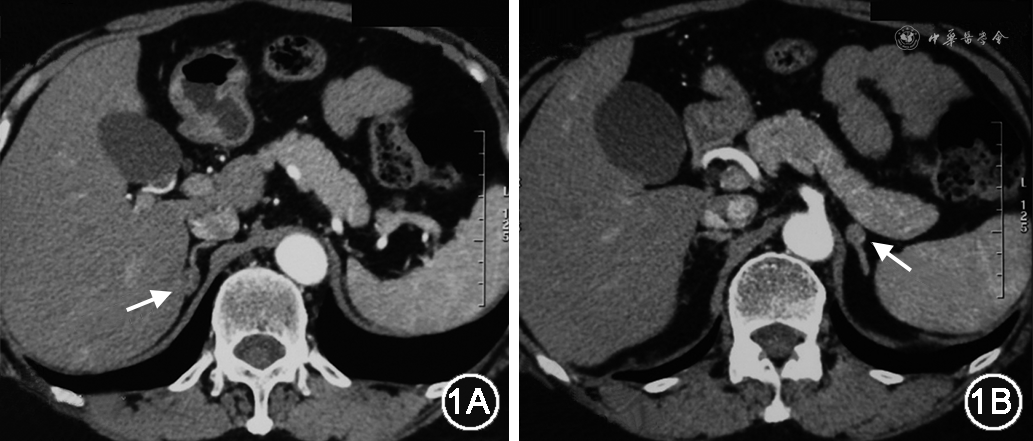

继续PA分型诊断,并明确责任病灶。行地塞米松抑制联合ACTH兴奋试验:0点口服1 mg地塞米松后,晨8点ACTH明显被抑制,静脉推注ACTH 50 U后,60 min PAC达最高值44.2 ng/dl(阳性判断标准:ACTH兴奋后120 min PAC≥77.9 ng/dl,诊断单侧PA[4]),提示双侧肾上腺病变,不除外特发性醛固酮增多症(idiopathic hyperaldosteronism,IHA)。患者有积极治疗意愿,进一步行ACTH兴奋下的非同步双侧肾上腺静脉取血(adrenal venous sampling,AVS)(表1),计算侧别指数(LI)=(校正后)高侧醛固酮均值/低侧醛固酮均值比值=0.430/0.025=17.20,LI≥4.0提示左侧肾上腺醛固酮优势分泌[5]。同时,将AVS下腔静脉、左肾上腺静脉、右肾上腺静脉血标本和患者盐水输注前晨8点卧位肾素-醛固酮的外周静脉血标本,送检类固醇激素谱,据结果(表2)分析,左侧肾上腺病变考虑为醛固酮瘤(aldosterone-producing adenoma,APA)[6],右侧肾上腺病变考虑为无功能瘤。推荐行左侧肾上腺APA切除术,患者选择择期手术,予出院,出院诊断:原发性醛固酮增多症:左侧肾上腺APA,右侧肾上腺无功能瘤。出院后3周随访:降压药物调整为硝苯地平缓释片20 mg、1次/日,螺内酯 20 mg、2次/日;自测血压130/90 mmHg左右,无低血钾发生。
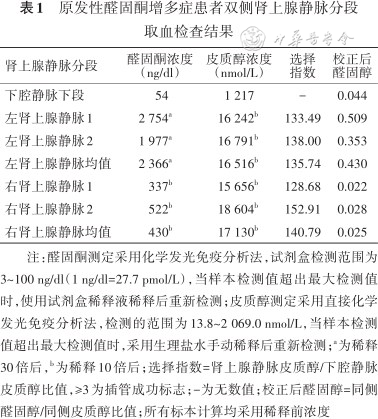
原发性醛固酮增多症患者双侧肾上腺静脉分段取血检查结果
原发性醛固酮增多症患者双侧肾上腺静脉分段取血检查结果
| 肾上腺静脉分段 | 醛固酮浓度 (ng/dl) | 皮质醇浓度 (nmol/L) | 选择 指数 | 校正后 醛固醇 |
|---|---|---|---|---|
| 下腔静脉下段 | 54 | 1 217 | - | 0.044 |
| 左肾上腺静脉1 | 2 754a | 16 242b | 133.49 | 0.509 |
| 左肾上腺静脉2 | 1 977a | 16 791b | 138.00 | 0.353 |
| 左肾上腺静脉均值 | 2 366a | 16 516b | 135.74 | 0.430 |
| 右肾上腺静脉1 | 337b | 15 656b | 128.68 | 0.022 |
| 右肾上腺静脉2 | 522b | 18 604b | 152.91 | 0.028 |
| 右肾上腺静脉均值 | 430b | 17 130b | 140.79 | 0.025 |
注:醛固酮测定采用化学发光免疫分析法,试剂盒检测范围为3~100 ng/dl(1 ng/dl=27.7 pmol/L),当样本检测值超出最大检测值时,使用试剂盒稀释液稀释后重新检测;皮质醇测定采用直接化学发光免疫分析法,检测的范围为13.8~2 069.0 nmol/L,当样本检测值超出最大检测值时,采用生理盐水手动稀释后重新检测;a为稀释30倍后,b为稀释10倍后;选择指数=肾上腺静脉皮质醇/下腔静脉皮质醇比值,≥3为插管成功标志;-为无数值;校正后醛固醇=同侧醛固醇/同侧皮质醇比值;所有标本计算均采用稀释前浓度
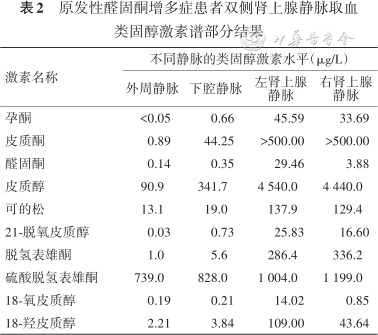
原发性醛固酮增多症患者双侧肾上腺静脉取血类固醇激素谱部分结果
原发性醛固酮增多症患者双侧肾上腺静脉取血类固醇激素谱部分结果
| 激素名称 | 不同静脉的类固醇激素水平(μg/L) | |||
|---|---|---|---|---|
| 外周静脉 | 下腔静脉 | 左肾上腺 静脉 | 右肾上腺 静脉 | |
| 孕酮 | <0.05 | 0.66 | 45.59 | 33.69 |
| 皮质酮 | 0.89 | 44.25 | >500.00 | >500.00 |
| 醛固酮 | 0.14 | 0.35 | 29.46 | 3.88 |
| 皮质醇 | 90.9 | 341.7 | 4 540.0 | 4 440.0 |
| 可的松 | 13.1 | 19.0 | 137.9 | 129.4 |
| 21-脱氧皮质醇 | 0.03 | 0.73 | 25.83 | 16.60 |
| 脱氢表雄酮 | 1.0 | 5.6 | 286.4 | 336.2 |
| 硫酸脱氢表雄酮 | 739.0 | 828.0 | 1 004.0 | 1 199.0 |
| 18-氧皮质醇 | 0.19 | 0.21 | 14.02 | 0.85 |
| 18-羟皮质醇 | 2.21 | 3.84 | 109.00 | 43.64 |
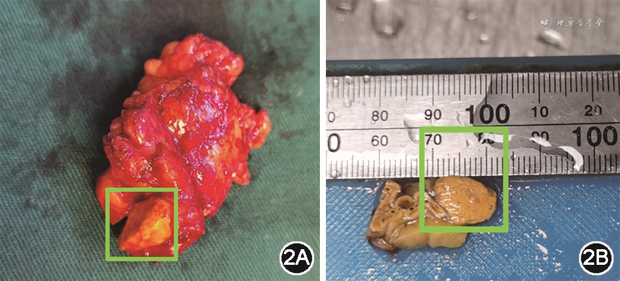
2022年6月患者于解放军总医院第一医学中心泌尿外科行后腹腔镜左侧肾上腺腺瘤切除术,术后大体标本:淡黄色组织1块,大小3.5 cm×2.7 cm×0.3 cm,切面淡黄色,于一侧见一金黄色结节(肾上腺腺瘤),大小1.2 cm×1.1 cm×1.0 cm,切面金黄色实性质中,与周围组织分界较清,局部临床已剖开(图2)。组织病理学示左侧肾上腺皮质腺瘤。免疫组织化学染色示黑色素A(melanA)(部分弱+),中枢神经特异性蛋白S-100(-),嗜铬粒蛋白A(CgA)(-),突触素(Syn)(+),增殖细胞相关核抗原Ki-67(+3%),抑制素-α(inhibin-α)(+),细胞角蛋白(CK)(-)。术后患者停用降压药、未补钾,监测血压:104~129/64~80 mmHg,血钾4.09、3.58、3.91 mmol/L;体位试验:(卧位/坐位2 h/坐位4 h)PAC 1.6/2.9/3.1 ng/dl,2 h ARR为0.8;ACTH-F节律、24 h UFC未见异常;外周血非卧位类固醇激素谱:PAC<0.02 μg/L(<0.220 μg/L)。复查肾上腺CT平扫:左侧肾上腺腺瘤切除术后,术区脂肪间隙模糊,见短条状高密度影;右侧肾上腺内侧肢见大小约15 mm×8 mm稍低密度结节。根据原发性醛固酮增多症手术结果(PASO)研究的评价标准[7],患者达到临床和生化完全缓解。

随访:术后1个月无乏力头晕不适,监测血压108~126/78~85 mmHg;术后6个月偶发头晕不适,同步测血压160/100 mmHg,自行硝苯地平缓释片10 mg、1次/日降压治疗,血压稳定于130/90 mmHg之内,无低血钾发生。
本例患者双侧肾上腺占位,诊断为PA,增高的醛固酮激素来自单侧肾上腺还是双侧,责任病灶是结节样变还是增生样变[8],均关系患者的治疗决策和预后。
2020版专家共识PA分型中提到7种分型诊断方法[1]:(1)肾上腺CT扫描,对PA分型诊断有很高价值,但因较高的漏诊及误诊率,较难单独作为PA分型诊断的主要依据。本例CT影像提示双侧占位,且大小形态接近(直径均为10 mm左右结节),单独影像不能区分责任病灶。(2)体位试验,相对简便、经济,但检测结果常受患者依从性的干扰,报道中其敏感性和特异性差异显著[9],目前仅作为分型诊断的辅助方法。本例体位试验中坐位4 h的PAC较基础值不升反降,提示APA可能。(3)质谱法检测,有研究用测得的外周静脉血18-氧皮质醇鉴别腺瘤与增生的敏感度、特异度分别为0.83、0.99,截断值为4.7 ng/dl[10]。本例外周血18-氧皮质醇18.9 ng/dl,提示APA可能。(4)Küpers评分体系及相关模型评分是目前国内外研究的用于PA分型诊断的另一个热点,包括改良Küpers评分、中国瑞金医院列线图、Nanba评分、Kamemura评分、Kobayashi评分等,这些评分系统及模型大多特异性高而敏感性低,且适用不同人群种族。本例患者改良后Küpers评分体系[11]为3分,不支持APA;而列线图模型[12]显示该患者双侧CT表现(23分),血钾3.93 mmol/L(75分),体重指数26.1 kg/m²(44分)评为142分,该分数提示>90%的IHA转化率。(5)地塞米松抑制联合ACTH兴奋试验无创、经济、有效,既增加了PA分型诊断的可及性,还提供了中国人群证据,被我国专家共识推荐为一种适合推广运用的PA分型诊断方法[1],但该试验主要用于区分是否有醛固酮分泌的优势侧,在双侧病变的PA中并不能精确地定位具体的侧向。本患者试验120 min内PAC最大值44.2 ng/dl,不除外双侧PA。(6)11C-美托咪酯-PET/CT及相关的功能显像技术,本中心暂无施行条件。综上,5种分型诊断方法不能给出统一的倾向和诊断,故考虑患者行AVS。
AVS被认为是PA分型诊断的金标准,是对那些手术治疗可获益的患者在术前明确是否为单侧病变的重要检查。但该检查目前尚缺乏标准化流程;常用的ACTH刺激下序贯采血,其高剂量ACTH可刺激正常肾上腺球状带细胞分泌醛固酮,可能掩盖APA的单侧高分泌结果[13];也有的APA可能出现对ACTH的异常反应[14];加之某些PA合并存在高皮质醇分泌(共分泌瘤)等情况,导致检查结果判读困难[15]。另有研究指出,LI截断值定为4,重点考虑了诊断特异性,但可出现43.2%的APA漏诊[16]。
类固醇激素谱是运用液相色谱串联质谱法(LC-MS/MS)进行多种激素的检测,优点是范围更广、准确性更优,近年在肾上腺疾病的研究中已体现出现较好的诊断价值和应用前景[17]。Eisenhofer等[6]的一项基于质谱法的肾上腺和外周静脉血类固醇分析用于分型PA的研究也得出结论:APA患者的肾上腺静脉中醛固酮、18-氧皮质醇和18-羟皮质醇浓度高于IHA患者,但IHA患者的皮质酮、皮质醇、孕酮、21-脱氧皮质醇、可的松、脱氢表雄酮和硫酸脱氢表雄酮的浓度更高。结合本例特点,影像学上表现为高度相似的双侧肾上腺结节,PA的病理类型主要包括APA、醛固酮生成结节(APN)、醛固酮生成微结节(APM)、多发性APN/APM及弥漫性增生[18]。故本例在AVS的基础上行类固醇激素谱分析,以协助分型诊断、明确双侧病变性质及提出精准治疗建议。最终观察到患者优势侧(左侧肾上腺)分泌的醛固酮、18-氧皮质醇和18-羟皮质醇浓度明显更高,符合左侧APA的表现。本例计算AVS中对侧抑制指数(CI)=(校正后)低侧醛固酮/下腔静脉醛固酮比值=0.022/0.044=0.5,据Strajina等[19]研究,推断右侧占位为无功能瘤,而非功能较弱的APA。
有研究报道10%~25%的PA患者肾上腺周围存在许多可能参与醛固酮分泌的微小结节,且术前影像学检查无法明确诊断,相比肾上腺全切术,单纯腺瘤切除容易残留有分泌功能的隐匿性腺瘤,并存在术后复发的风险[20]。专家共识中提到,确诊为APA或原发性肾上腺皮质增生(PAH)的患者,选择单侧肾上腺全切术或是行保留部分肾上腺组织的肾上腺切除术,尚存在争议,肾上腺切除术包括肾上腺肿瘤切除术、肾上腺肿瘤切除+肾上腺部分切除术[1]。本例患者通过AVS结合类固醇激素谱,对双侧结节病变给出定性诊断,并在术前给予患者左侧APA切除术的建议。最终,患者术中所见、采用术式及术后组织病理学结果验证了诊断,患者术后达到临床和生化完全缓解。不足之处是本例术后肾上腺标本未进行免疫组织化学CYP11B2染色及APA热点突变基因测序,而这些均有助于PA病因精准诊断,并进一步验证术前的判断。
通过对本例影像学上表现为双侧病变的PA患者的诊治回顾,进一步认识到PA的分型诊断极具挑战。作为金标准的AVS其作用仍无法取代,但仍存在操作复杂性、有创性、放射暴露、结果判读困难等弊端。正如本例患者AVS证实有明确的优势侧存在,但更精准的分型如APA、PAH甚或非对称性IHA依然困难,将LC-MS/MS的类固醇激素谱加入其中,可以给结果判读和治疗决策选择提供更多证据,也为同类疾病的精准诊治提供思路。
李昊, 裴育, 杨国庆, 等. 表现为双侧肾上腺病变的醛固酮瘤1例临床诊疗应对[J]. 中华内科杂志, 2023, 62(6): 714-717. DOI: 10.3760/cma.j.cn112138-20220826-00639.
所有作者声明无利益冲突



























