
探讨胎龄≤32周的极低出生体重儿生后28 d内影响支气管肺发育不良(bronchopulmonary dysplasia,BPD)发生的危险因素,建立及验证风险预测模型。
回顾性分析2016年1月至2020年4月入住北京大学第三医院新生儿重症监护病房的胎龄≤32周且存活至纠正胎龄36周的极低出生体重儿作为建模组。BPD诊断采用2018年修订标准。收集患儿的临床资料,采用χ2检验、Mann-Whitney U检验及多因素logistic回归分析胎龄≤32周极低出生体重儿发生BPD的危险因素,建立列线图模型。采用受试者工作特性曲线进行区分度评价,采用校准图和Hosmer-Lemeshow拟合优度检验进行校准度评价,采用临床决策曲线评价该模型的临床效能。利用Bootstrap重复取样法进行内部验证。外部验证研究对象来自2017年10月至2022年2月入住河北省承德市妇幼保健院的新生儿,纳入和排除标准同建模组。
建模组共纳入467例早产儿,其中BPD组104例,非BPD组363例;验证组共纳入101例早产儿,其中BPD组16例,非BPD组85例。多因素logistic回归分析显示,低出生体重(OR=0.03,95%CI:0.01~0.13)、合并院内感染性肺炎(OR=2.40,95%CI:1.41~4.09)、合并晚发败血症(OR=2.18,95%CI:1.18~4.02)、气管插管时间长(OR=1.61,95%CI:1.26~2.04)是胎龄≤32周极低出生体重儿发生BPD的危险因素(P值均<0.05)。根据多因素logistic回归分析结果建立预测BPD风险的列线图模型,建模组曲线下面积为0.827(95%CI:0.783~0.872),界值为0.206时,灵敏度为0.788(95%CI:0.697~0.862),特异度为0.744(95%CI:0.696~0.788);验证组曲线下面积为0.951(95%CI:0.904~0.999)。以预测概率0.206视为高风险,灵敏度为0.812(95%CI:0.537~0.950),特异度为0.882(95%CI:0.790~0.939),且拟合度较好(P>0.05)。临床决策曲线显示,在建模组的阈值概率为5%~80%时具有较高的净收益。
低出生体重、合并院内感染性肺炎、合并晚发败血症、气管插管时间长是胎龄≤32周极低出生体重儿发生BPD的危险因素。本研究建立的列线图模型对胎龄≤32周极低出生体重儿发生BPD的风险有一定的预测价值。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
支气管肺发育不良(bronchopulmonary dysplasia,BPD)是影响早产儿预后及生活质量的主要疾病。随着目前围产医学的进步,更小胎龄、更低出生体重的早产儿存活率上升,BPD的发生率也呈上升趋势。2019年美国国家儿童健康与人类发展研究所(National Institute of Child Health and Human Development,NICHD)数据库显示,BPD的发生率在极早产儿(<32周)中高达71.1%[1]。从2010年至2019年,国内68个三级新生儿重症监护病房的数据统计表明,胎龄<28周早产儿BPD的发生率由55.7%上升至79.9%[2]。
BPD于1967年由Northway等[3]首次报道。既往在临床中应用最广泛的BPD的诊断标准为NICHD于2001年制定,于生后28 d进行诊断,纠正胎龄(postmenstrual age,PMA)36周或生后56 d或出院时进行分度[4]。但是由于临床呼吸支持模式的不断进步及多样化,这一标准已不能充分满足临床的要求。2018年,Higgins等[5]提出了新的BPD诊断标准,将评估时间统一设定为PMA 36周,将通气方式与吸入氧浓度结合进行细分。这一标准逐步被临床接受并应用于诊断及流行病学研究[6]。目前认为BPD是在肺不成熟的基础上,由产前、产时及产后多种因素共同作用的结果。BPD目前尚无有效的治疗方案,重点应放在预防和早期综合管理,以及早期预测和早期干预等方面。目前国外已有较多关于BPD的预测模型[7, 8, 9, 10, 11, 12],但因为不同国家之间人种和医疗条件的差异,可能并不完全适用于中国人[13]。国内BPD预测模型报道较少[14, 15],多数研究纳入生后14 d内的危险因素,且多应用2001年NICHD诊断标准。随着新的BPD诊断标准的引入,BPD的评估时间由生后28 d延迟至PMA 36周,除了产前及生后早期的影响因素外,生后28 d内的疾病对BPD的发生及发展也起着非常重要的作用。
因此,本研究拟探讨胎龄≤32周的极低出生体重儿生后28 d内影响BPD发生的危险因素,建立预测新诊断标准下BPD发生风险的列线图模型,并对该模型进行外部验证。
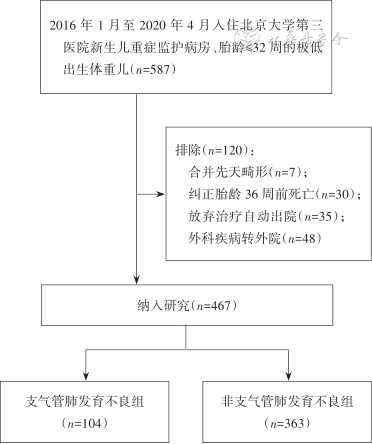
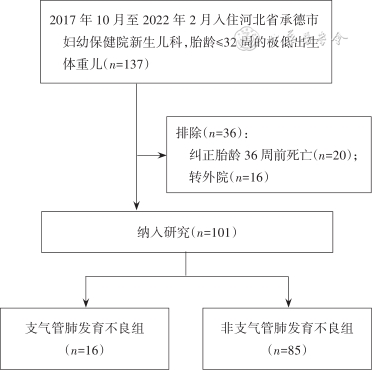
1. 资料来源:本研究为单中心回顾性队列研究。选取2016年1月至2020年4月入住北京大学第三医院新生儿重症监护病房的胎龄≤32周的极低出生体重儿467例作为建模组。选取2017年10月至2022年2月入住河北省承德市妇幼保健院(二级甲等医院)新生儿科的胎龄≤32周的极低出生体重儿101例作为验证组。本研究经北京大学第三医院伦理委员会[(2019)医伦审第(231-01)号]及承德市妇幼保健院伦理委员会批准(无批准号)。
2. 纳入标准:(1)出生体重<1 500 g,且胎龄≤32周;(2)存活至PMA 36周。
3. 排除标准:(1)合并严重的先天畸形,如先天性肺部疾病(先天性肺发育不全、肺隔离症、先天性支气管肺囊肿、透明肺及先天性肺动静脉瘘等),先天性心脏病(如房间隔缺损、室间隔缺损、肺动脉瓣狭窄、主动脉瓣狭窄、法洛四联症等)或其他系统畸形;(2)因各种情况导致PMA 36周前的病史资料不全者,如死亡、放弃治疗自动出院、因外科疾病转外院治疗等。
根据在PMA 36周时是否合并BPD,将入组研究对象分为BPD组和非BPD组。
BPD诊断标准依据2018年修订标准[5]:胎龄≤32周的早产儿,伴有影像学证实的持续性肺实质病变,PMA 36周时至少连续3 d需要一定的呼吸支持或吸入氧浓度才能维持动脉血氧饱和度90%~95%。
1.收集临床资料:通过回顾病历资料,收集以下信息:(1)研究对象的性别、胎龄、出生体重、是否为小于胎龄儿;(2)孕母情况:产前糖皮质激素应用、是否合并子痫前期或组织学绒毛膜羊膜炎、胎膜早破时间;(3)出生情况:1 min Apgar评分、是否应用除初步复苏以外的复苏措施、生后是否立即插管;(4)生后疾病及治疗情况:新生儿呼吸窘迫综合征、应用肺表面活性物质、应用咖啡因、合并有血流动力学意义的动脉导管未闭(hemodynamically significant patent ductus arteriosus,hsPDA)、颅内出血、肺出血、新生儿持续性肺动脉高压、宫内感染性肺炎、早发型败血症、晚发型败血症、院内感染性肺炎、坏死性小肠结肠炎、气管插管时长等。新生儿疾病的诊断标准均参考《实用新生儿学》第5版[16],产科疾病的诊断依据《实用妇产科学》第4版[17]。
2. 新生儿持续性肺动脉高压:指新生儿生后肺血管阻力持续升高,使胎儿型循环过渡到正常成人型循环发生障碍,引起心房和/或动脉导管水平的右向左分流,临床出现严重低氧血症的症状,多发生于生后1周内。BPD后期并发的肺动脉高压不属于本研究范畴。
3. hsPDA的诊断标准[18]:超声心动图检查结果中至少1项同时合并临床症状中的3项及以上。超声心动图标准包括:(1)动脉导管直径≥1.5 mm;(2)左心房与主动脉根部比值≥1.4;(3)左肺动脉舒张末期流速增加;(4)降主动脉反流。临床症状包括:(1)胸骨左缘可闻及收缩期或者连续性杂音;(2)心前区搏动增强;(3)水冲脉;(4)安静时心率>180次/min;(5)呼吸情况恶化;(6)X射线片显示肺血管影增多及心影增大,或存在肺水肿。
4. 院内感染性肺炎:诊断标准需同时满足下列4项:(1)发病时住院时间>48 h。(2)X射线片显示新发、持续存在和进展的肺炎表现(包括渗出、实变等)。(3)临床存在感染表现至少具有下列1项:①体温不稳定;②呼吸暂停和/或心率减慢、气促、鼻翼煽动伴吸入性凹陷;③白细胞计数减少(<5×109/L)或明显升高(>20×109/L);中性粒细胞计数减少(<7.5×109/L);④C-反应蛋白升高(>8 mg/L)。(4)同时出现下列2项呼吸系统症状:①氧合和气体交换功能恶化,如吸入氧浓度升高,呼吸机参数上调;②新发脓痰,痰性状改变,呼吸道分泌物增加或吸痰次数增加[19]。
5. 气管插管时长:指自出生至评估节点气管插管的总时间。若有2次及以上的气管插管,则将各次气管插管时间相加后纳入分析。
采用R软件(4.2.2)进行统计学分析。非正态分布的计量资料以M(P25~P75)表示,组间比较采用Mann-Whitney U检验;计数资料以例数和百分率表示,组间比较采用χ2检验。统计检验均为双侧概率检验,以P<0.05为差异有统计学意义。采用多因素logistic回归分析构建预测模型,并绘制模型的列线图。区分度评价采用受试者工作特性曲线进行分析;校准度评价采用校准图和Hosmer-Lemeshow拟合优度检验。利用Bootstrap重复取样(1 000次)的方法对模型进行内部验证,并采取与建模组不同医院的人群进行模型的外部验证。临床有效性评价采用决策曲线分析法计算决策的净收益。
建模组最终纳入467例早产儿,其中BPD组104例,非BPD组363例。验证组最终纳入101例早产儿,其中BPD组16例,非BPD组85例。2组研究对象的纳入及分组流程见图1及图2。各变量在建模组及验证组的分布情况见表1。


建模组及验证组早产儿的基线信息
建模组及验证组早产儿的基线信息
| 项目 | 建模组(n=467) | 验证组(n=101) |
|---|---|---|
| 男性[例(%)] | 253(54.2) | 53(52.5) |
| 出生胎龄[M(P25~P75),周] | 29.4(28.4~30.5) | 29.6(28.1~31.0) |
| 出生体重[M(P25~P75),kg] | 1.2(1.0~1.3) | 1.3(1.1~1.4) |
| 小于胎龄儿[例(%)] | 54(11.6) | 9(9.0) |
| 产前足量应用糖皮质激素[例(%)] | 342(73.2) | 71(70.3) |
| 母亲合并子痫前期[例(%)] | 145(31.0) | 19(18.8) |
| 母亲合并组织学绒毛膜羊膜炎[例(%)] | 159(34.1)a | 66(65.4) |
| 胎膜早破>18 h[例(%)] | 106(22.7) | 24(23.8) |
| 1 min Apgar评分≤7分[例(%)] | 108(23.1) | 15(14.9) |
| 生后应用除初步复苏以外的复苏措施[例(%)] | 349(74.7) | 45(44.6) |
| 生后需立即气管插管[例(%)] | 109(23.3) | 38(37.6) |
| 新生儿呼吸窘迫综合征[例(%)] | 210(45.0) | 78(77.2) |
| 应用肺表面活性物质[例(%)] | ||
| 1次 | 184(39.4) | 63(62.4) |
| ≥2次 | 25(5.4) | 2(2.0) |
| 动脉导管未闭[例(%)] | ||
| 药物治疗后关闭 | 181(38.8) | 10(9.9) |
| 药物治疗后未关闭 | 18(3.9) | 11(10.9) |
| 新生儿持续性肺动脉高压[例(%)] | 41(8.8) | 17(16.8) |
| 肺出血[例(%)] | 21(4.5) | 6(5.9) |
| 颅内出血[例(%)] | ||
| Ⅱ度及以下 | 240(51.4) | 75(74.3) |
| Ⅲ度及以上 | 31(6.6) | 24(23.8) |
| 早发型败血症[例(%)] | 8(1.7) | 11(10.9) |
| 宫内感染性肺炎[例(%)] | 86(18.4) | 37(36.6) |
| 生后应用咖啡因[例(%)] | ||
| 3 d内 | 299(64.0) | 77(76.2) |
| 3 d后 | 49(10.5) | 1(1.0) |
| 院内感染性肺炎[例(%)] | 197(42.2) | 22(21.8) |
| 晚发型败血症[例(%)] | 77(16.5) | 6(5.9) |
| 坏死性小肠结肠炎[例(%)] | 6(1.3) | 5(5.0) |
| 气管插管时长[M(P25~P75),h] | 0(0~70) | 36(0~99) |
| 支气管肺发育不良[例(%)] | 104(22.3) | 16(15.8) |
注:a有缺失,分母为435
建模组BPD组与非BPD组患儿在男性、出生胎龄、出生体重、小于胎龄儿、1 min Apgar评分≤7分、生后应用除初步复苏以外的复苏措施、生后需立即气管插管、新生儿呼吸窘迫综合征、肺表面活性物质应用、hsPDA、新生儿持续肺动脉高压、肺出血、颅内出血、咖啡因应用、院内感染性肺炎、晚发败血症、气管插管时长等方面的比较,差异均有统计学意义(P值均<0.05),见表2。
建模组早产儿生后发生BPD的单因素分析
建模组早产儿生后发生BPD的单因素分析
| 项目 | 非BPD组(n=363) | BPD组(n=104) | χ2或Z值 | P值 |
|---|---|---|---|---|
| 男性[例(%)] | 186(51.2) | 67(64.4) | 5.66 | 0.017 |
| 出生胎龄[M(P25~P75),周] | 29.6(28.6~31.0) | 28.6(27.3~30.0) | 5.56 | <0.001 |
| 出生体重[M(P25~P75),kg] | 1.2(1.07~1.34) | 1.0(0.85~1.16) | 7.82 | <0.001 |
| 小于胎龄儿[例(%)] | 34(9.4) | 20(19.2) | 7.69 | 0.006 |
| 产前足量应用糖皮质激素[例(%)] | 272(74.9) | 70(67.3) | 2.40 | 0.122 |
| 母亲合并子痫前期[例(%)] | 117(32.2) | 28(26.9) | 1.06 | 0.302 |
| 母亲合并组织学绒毛膜羊膜炎[例(%)] | 126(37.3)a | 33(34.0)b | 0.34 | 0.663 |
| 胎膜早破>18 h[例(%)] | 79(21.8) | 27(26.0) | 0.81 | 0.367 |
| 1 min Apgar评分≤7分[例(%)] | 71(19.6) | 37(35.6) | 11.67 | 0.001 |
| 生后需除初步复苏以外的复苏措施[例(%)] | 257(70.8) | 92(88.5) | 13.36 | <0.001 |
| 生后需立即气管插管[例(%)] | 64(17.6) | 45(43.3) | 29.70 | <0.001 |
| 新生儿呼吸窘迫综合征[例(%)] | 140(38.6) | 70(67.3) | 26.98 | <0.001 |
| 应用肺表面活性物质[例(%)] | 28.22 | <0.001 | ||
| 1次 | 124(34.2) | 60(57.7) | ||
| ≥2次 | 15(4.1) | 10(9.6) | ||
| hsPDA[例(%)] | 19.53 | <0.001 | ||
| 药物治疗后关闭 | 126(34.7) | 55(52.9) | ||
| 药物治疗后未关闭 | 10(2.8) | 8(7.7) | ||
| 新生儿持续性肺动脉高压[例(%)] | 25(6.9) | 16(15.4) | 7.29 | 0.007 |
| 肺出血[例(%)] | 8(2.2) | 13(12.5) | 17.63 | <0.001 |
| 颅内出血[例(%)] | 14.38 | 0.001 | ||
| Ⅱ度及以下 | 173(47.7) | 67(64.4) | ||
| Ⅲ度及以上 | 21(5.8) | 10(9.6) | ||
| 早发败血症[例(%)] | 6(1.7) | 2(1.9) | 0.00 | >0.999 |
| 宫内感染性肺炎[例(%)] | 65(17.9) | 21(20.2) | 0.28 | 0.596 |
| 生后应用咖啡因[例(%)] | 25.74 | <0.001 | ||
| 3 d内 | 213(58.7) | 86(82.7) | ||
| 3 d后 | 38(10.5) | 11(10.6) | ||
| 院内感染性肺炎[例(%)] | 126(34.7) | 71(68.3) | 37.33 | <0.001 |
| 晚发型败血症[例(%)] | 48(13.2) | 29(27.9) | 12.62 | <0.001 |
| 坏死性小肠结肠炎[例(%)] | 4(1.1) | 2(2.0) | 0.03 | 0.871 |
| 气管插管时长[M(P25~P75),h] | 0(0~12) | 96(0~174) | -9.60 | <0.001 |
注:a有缺失,分母为338;b有缺失,分母为97;BPD:支气管肺发育不良(bronchopulmonary dysplasia);hsPDA:有血流动力学意义的动脉导管未闭(hemodynamically significant patent ductus arteriosus)
以是否发生BPD作为因变量,将单因素分析中有统计学意义的指标作为自变量进行多因素logistic回归分析,结果显示低出生体重、合并院内感染性肺炎、合并晚发败血症、气管插管时间较长是胎龄≤32周极低出生体重儿发生BPD的独立危险因素,见表3。
建模组早产儿生后发生支气管肺发育不良的多因素分析
建模组早产儿生后发生支气管肺发育不良的多因素分析
| 变量 | Β值 | SE值 | Wald值 | P值 | OR值 | 95%CI |
|---|---|---|---|---|---|---|
| 低出生体重 | -3.422 | 0.694 | -4.933 | <0.001 | 0.03 | 0.01~0.13 |
| 院内感染性肺炎 | 0.876 | 0.272 | 3.215 | 0.001 | 2.40 | 1.41~4.09 |
| 晚发败血症 | 0.777 | 0.313 | 2.483 | 0.013 | 2.18 | 1.18~4.02 |
| 气管插管时长 | 0.473 | 0.123 | 3.842 | 0.000 | 1.61 | 1.26~2.04 |
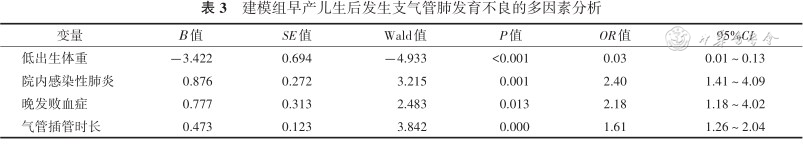
根据logistic多因素分析结果,建立预测胎龄≤32周极低出生体重儿BPD发生风险的列线图,见图3。

每个变量对应列线图中相应变量轴上相应点。以该点做变量轴的垂直线对应至上方评分标尺,得到该变量得分,通过对各变量得分求和,再以得到的总分对应BPD发生风险轴上的点,即为相对应的BPD的发生风险。例如,某早产儿出生体重1 400 g,得分为11分;有院内感染性肺炎,得27.5分;无晚发败血症,得0分;气管插管300 h,得45分。则该早产儿合计总分为83.5分,根据列线图(图3)总分83.5分对应的BPD发生风险为0.3,可预测该早产儿PMA 36周时发生BPD的风险为30%。
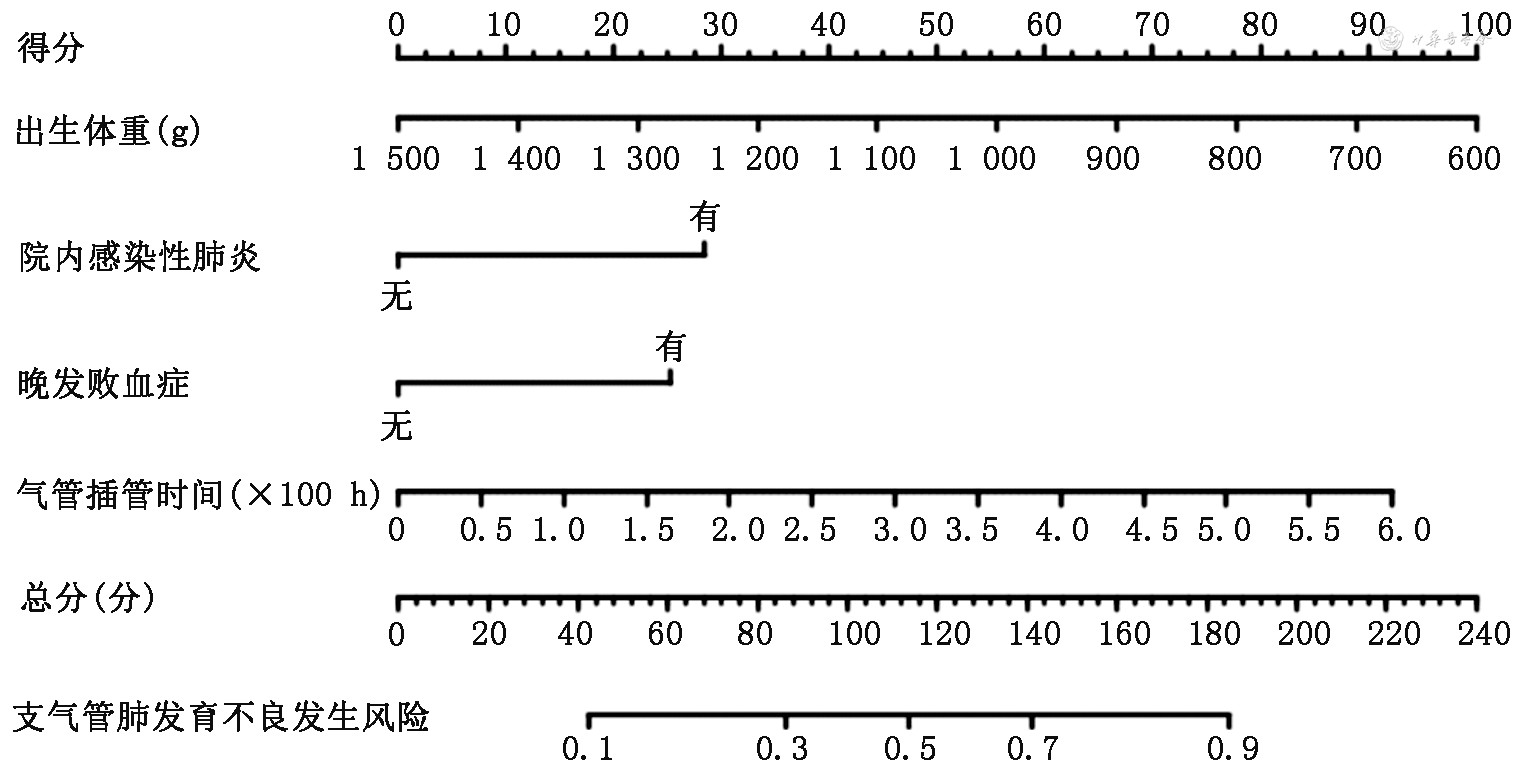
建模组受试者工作特性曲线分析显示,曲线下面积为0.827(95%CI:0.783~0.872),界值为0.206时,灵敏度为0.788(95%CI:0.697~0.862),特异度为0.744(95%CI:0.696~0.788),提示模型鉴别能力良好,见图4A。将验证组101例的临床资料纳入预测模型进行外部验证,受试者工作特性曲线下面积为0.951(95%CI:0.904~0.999)。以预测概率0.206视为高风险,灵敏度为0.812(95%CI:0.537~0.950),特异度为0.882(95%CI:0.790~0.939),见图4B。

注:BPD:支气管肺发育不良(bronchopulmonary dysplasia)
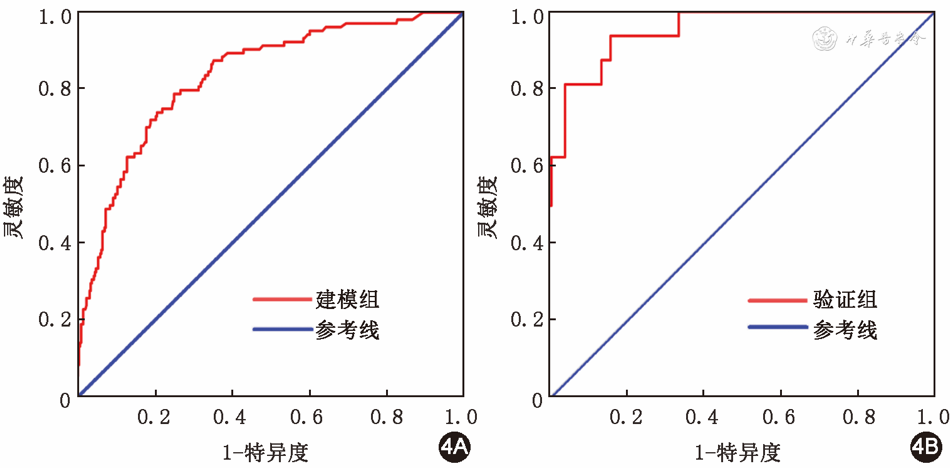
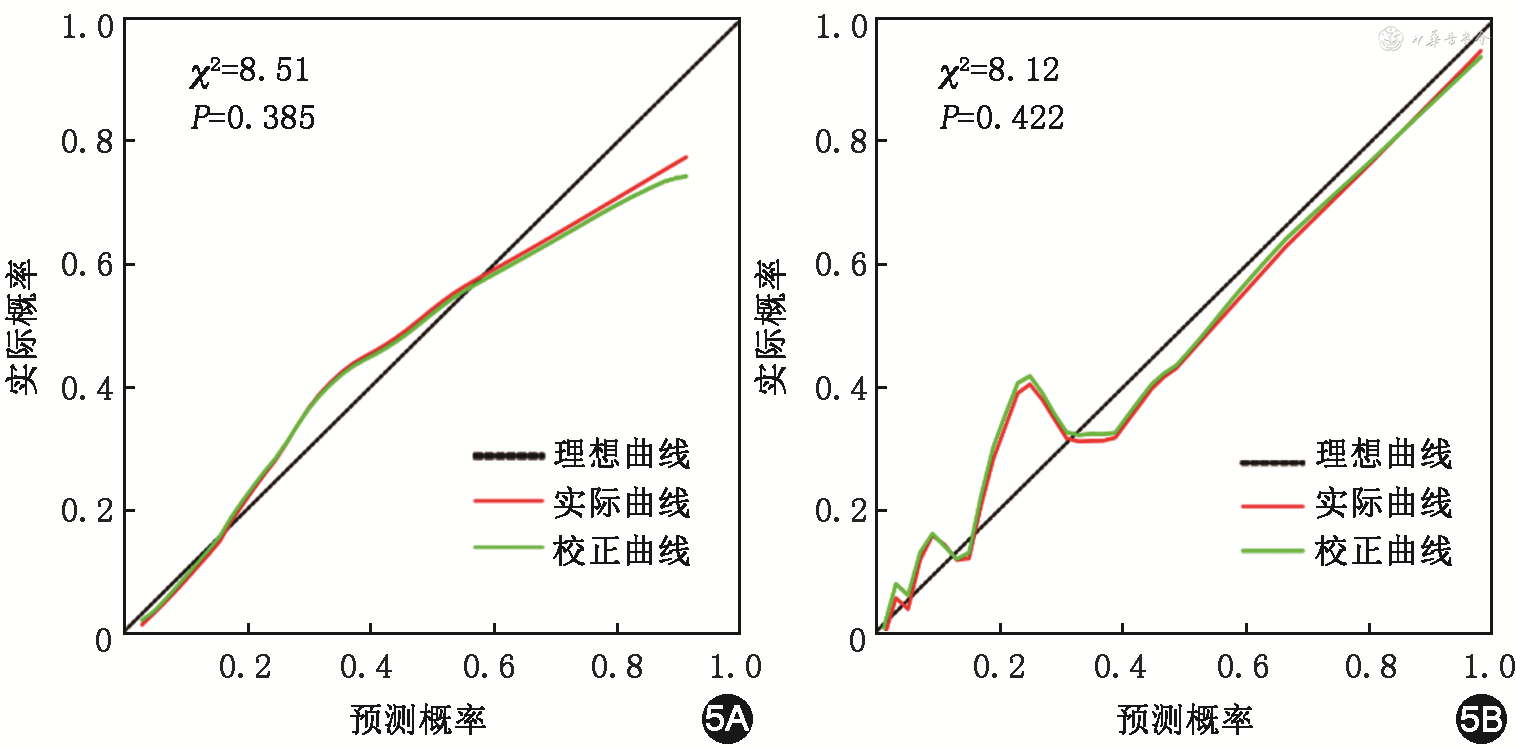
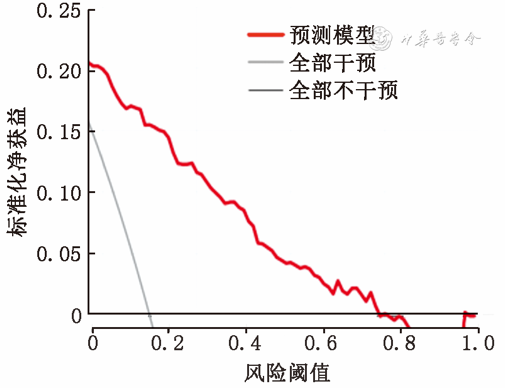
利用Bootstrap重复取样(1 000次)的方法对模型进行内部验证校准曲线见图5A,Hosmer- Lemeshow拟合优度检验显示拟合度较好(χ2=8.51,P=0.385)。外部验证组Hosmer-Lemeshow拟合优度检验显示出较好的拟合度(χ2=8.12,P=0.422),BPD发生风险较低(<0.4)时,预测准确性欠佳;BPD发生风险较高(≥0.4)时,该模型预测概率与实际概率基本一致,准确性较好,见图5B。利用决策曲线分析评估预测模型的临床有效性,显示当建模队列的阈值概率为5%~80%时,对胎龄≤32周的极低出生体重儿进行临床干预具有较高的净收益,见图6。

注:BPD:支气管肺发育不良(bronchopulmonary dysplasia)

BPD是影响早产儿生存及预后的主要疾病。通过产前应用糖皮质激素、先进的新生儿监护和治疗技术、有效的呼吸支持设备,以及表面活性物质治疗等技术的应用,大多数极低及超低出生体重儿得以存活,BPD的特征在过去50余年中也发生了巨大的变化。
新型BPD的发病机制表明,BPD的最大危险因素是早产和低出生体重[20]。BPD的发生率随着胎龄和出生体重的降低而增加。既往研究数据显示,在出生胎龄22~24周的婴儿中,约80%诊断为BPD[21]。在患有BPD的婴儿中,95%是极低出生体重儿。在本研究中,单因素分析显示,BPD组及非BPD组胎龄及出生体重比较,差异均有统计学意义;多因素分析结果显示,胎龄并不是胎龄≤32周极低出生体重儿BPD发生的危险因素。在建立预测模型过程中,强行纳入胎龄变量并未对最终模型的区分度及校准度产生明显影响。分析其原因,可能与本研究入组人群具有一定的同质性(均为胎龄≤32周的早产儿),且患儿肺部发育均处于囊泡期[22]有关。除此之外,回顾既往文献,Valenzuela-Stutman等[23]在针对极低出生体重儿在出生时和生后3、7、14 d建立中、重度BPD和/或死亡的危险预测模型,发现出生体重和胎龄在预测模型中的贡献率较高,在生后3、7及14 d出生体重仍持续作为BPD的预测指标存在,但胎龄已不再是主要预测因素。生后氧疗时间和使用呼吸机时间成为贡献率最高的预测指标。Ding等[15]研究收集了入组的早产儿在诊断BPD前的所有临床指标来构建预测模型,在统计分析中胎龄也未在BPD组及非BPD组中表现出明显差异。提示随着日龄的增加,胎龄对BPD发展的影响可能在逐步弱化。但这些结论不除外与本研究为单中心、样本量较小有关,尚需多中心、大样本量的研究进一步证实。
本研究发现,气管插管时间长是BPD的独立危险因素,且对后续BPD的发生有预测价值,这与既往研究结论一致。Berger等[24]的研究发现,在262例胎龄≤28周早产儿中,当拔管延迟到出生第1周后,发生BPD的风险增加。Jensen等[25]在一项对超低出生体重儿的大型回顾性队列研究中发现,发生BPD的风险随着机械通气时间的延长而增加,但发生BPD的风险与呼吸机通气疗程的数量无关。由于发生BPD的最高危人群为超早产儿,而这些人群早期往往需要气管插管,故努力使已经气管插管的患儿尽早拔管改为无创通气可降低BPD发生的风险[26]。
炎症是BPD的主要致病机制。炎性暴露,无论是产前的绒毛膜羊膜炎,还是生后的败血症、肺炎或坏死性小肠结肠炎,都会导致肺和呼吸道损伤。本研究中单因素及多因素分析均提示早产儿合并院内感染性肺炎、晚发败血症是BPD发生的危险因素,且对BPD的发生有预测价值。Kim等[27]的研究发现生后脓毒症和中-重度BPD发生发展之间的联系,炎症介质释放及炎症细胞经血液循环进入肺部[28]增加了BPD发生的风险。来自美国NICHD的数据[29]报告称,接近21%的极低出生体重儿被诊断为晚发败血症。Jung和Lee[30]的研究也发现晚发败血症是超低出生体重儿BPD发生的危险因素;同时他们的研究还发现,如在PMA 36周前反复出现晚发败血症,可能是更严重的BPD的危险因素。Sucasas等[31]的研究同样发现院内感染是BPD的独立危险因素,且与BPD风险增加以及BPD的严重程度有关。
本研究构建了预测胎龄≤32周的极低出生体重儿BPD(2018标准)发生风险的列线图模型,以直观用于个体疾病风险的预测。与以往模型不同的是,本模型应用2018年更新的BPD诊断标准,且纳入了生后28 d内的危险因素,在出生至28 d内随着预测模型内危险因素数量的增加,BPD发生的风险逐渐增加,实现了生后28 d内对BPD发生风险的动态预测的过程,为具有BPD高风险的极低出生体重儿,采取更积极的干预措施提供参考依据。例如对生后2周仍不能拔除气管插管同时合并院内感染的超低出生体重儿(按本研究预测模型推测发生BPD的风险为70%~90%),在积极控制感染的基础上考虑静脉应用糖皮质激素协助拔除气管插管,以期改善重症BPD患儿的预后。在纳入生后28 d内的危险因素后,统计分析发现除了出生体重及机械通气时间外,生后院内感染性肺炎及晚发败血症在BPD发生和发展中也起到非常重要的作用,更加提示控制院内感染在减少PMA 36周BPD发生风险中的作用。
本模型主要应用临床指标进行预测,并利用市级二甲医院的数据进行外部验证,验证组同样表现出较高的区分度,对高风险患儿的预测准确性较高。本研究采用的建模数据虽来源于三甲医院,但是纳入的预测指标在初级保健机构同样可以实现,对于初级保健机构中胎龄≤32周极低出生体重儿发生BPD的预测应当有一定的推广价值。
本研究的局限之处在于建模过程为单中心研究,是基于已有队列研究数据进行的二级分析,没有正式的样本量计算过程。建模人群BPD组(研究对象中数量较少组)共104例,最终预测模型共纳入4个自变量,样本量相对充足,但尚不满足构建预测模型的样本量要求(每个变量对应的事件发生数>10),需经多中心、更大样本量研究进一步论证。本研究虽进行了外部验证,但验证人群样本量小,尚需扩充样本量在多家单位进一步验证。本文有一部分患儿因死亡或转院被排除,可能导致选择偏倚。本研究纳入的预测变量均为临床指标,后续的研究计划纳入临床容易获得的实验室指标,以进一步增强模型的预测价值,并针对新诊断标准下BPD分级(即严重程度)进行风险预测。
武慧, 敖雪, 王凤东, 等. 胎龄≤32周极低出生体重儿支气管肺发育不良风险的预测模型建立及验证[J]. 中华围产医学杂志, 2023, 26(5): 366-374. DOI: 10.3760/cma.j.cn113903-20220714-00711.
所有作者声明不存在利益冲突



























