
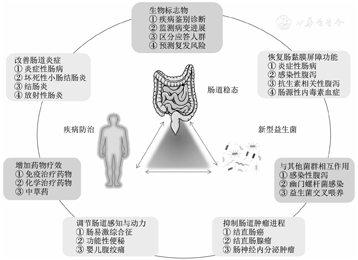
益生菌指在足量条件下能对宿主产生确切有益健康功效的微生物。在肠道疾病防治中,传统益生菌如乳杆菌属(Lactobacillus)、双歧杆菌属(Bifidobacteria)、链球菌属(Streptococcus)经过长期的研究已被证实安全、有效,但使用二代测序技术和生物信息学工具鉴定出的新型益生菌的具体作用和机制亟待阐明。本文重点回顾脆弱拟杆菌(Bacteroides fragilis)、嗜黏蛋白阿克曼菌(Akkermansia muciniphila)、普氏栖粪杆菌(Faecalibacterium prausnitzii)3种新型益生菌与肠道疾病防治的研究进展,其通过改善肠道炎症,维护肠黏膜屏障结构和功能完整,抑制肠道肿瘤的进程,辅助诊断,以及预测疗效等多种作用促进肠道疾病的防治。虽然现阶段仍面临安全性、准确性和可利用性的挑战,但相关研究与转化的不断改进将使新型益生菌更好地服务于肠道疾病防治。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
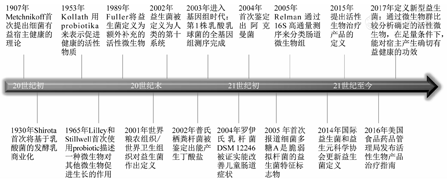
肠道是人体内最大的微生物储存库,共生微生物构成复杂的生态系统参与调节营养代谢,维持肠道结构、功能完整和内环境稳态,而微生态失调会导致肠道疾病的发生与发展。发酵食品中的某些活性微生物,因能对宿主产生有益健康功效而被称为"传统益生菌",自1907年被首次发现后,已在长期的研究中被证实安全、有效;但使用二代测序技术和生物信息学工具,通过在健康与患病人群之间进行微生物群比较而鉴定出的新型益生菌(next-generation probiotics,NGP)在肠道疾病防治中的作用尚未完全明确[1](图1)。当前研究通常只关注NGP与某种疾病的联系,而实际上临床效应与特定的作用机制相关,从具体机制方面阐明NGP在多种肠道疾病防治中的作用,将有利于更深入地理解当前的研究成果,启发科学研究思路、扩展临床转化的可能,并为鉴定出更新一代益生菌奠定基础。本文重点回顾了脆弱拟杆菌(Bacteroides fragilis)、嗜黏蛋白阿克曼菌(Akkermansia muciniphila)和普氏栖粪杆菌(Faecalibacterium prausnitzii)3种NGP在肠道疾病防治中的作用和具体机制,并对现阶段所面临的挑战进行阐述、对未来前景进行展望。


脆弱拟杆菌是厌氧的、不形成芽孢的革兰氏阴性杆状细菌,是一种在人群中广泛存在的条件致病菌。其中产肠毒素脆弱拟杆菌可促发肠道炎症和恶性肿瘤,而非产肠毒素脆弱拟杆菌则具有益生菌特性。
脆弱拟杆菌可通过合成生物大分子改善结肠炎,如两性离子荚膜多糖通过诱导CD4+ T细胞群成熟分化为调节性T细胞,促进CD39在人类白细胞抗原DR阳性调节性T细胞中的表达,从而增强其炎症抑制能力[2]。新型非产肠毒素脆弱拟杆菌ZY-312还可通过抑制含半胱氨酸的天冬氨酸水解酶1、降低白细胞介素-1β水平、减少炎症性程序性细胞死亡(细胞焦亡),从而降低阪崎克罗诺杆菌(Cronobacter sakazakii)诱导的坏死性小肠结肠炎中不良反应的发生率[3]。
嗜黏蛋白阿克曼菌是一种椭圆形、非运动型、不产芽孢的革兰氏阴性厌氧的肠道细菌,定植于人体肠道并在肠道黏液层生长,将宿主分泌的黏蛋白作为营养源。
小鼠口服巴氏灭活的嗜黏蛋白阿克曼菌可减少巨噬细胞和细胞毒性T淋巴细胞的结肠浸润[6]。嗜黏蛋白阿克曼菌菌株ATCC BAA-835还可通过代谢产生短链脂肪酸,从而激活G蛋白偶联受体43,增加结肠CD4+ T细胞向调节性T细胞分化,进而抑制结肠炎小鼠的肠道促炎反应[7]。
普氏栖粪杆菌,又名普拉梭菌,是一种对氧极度敏感的革兰氏阳性菌,其属于厚壁菌门、梭菌科、柔嫩梭菌类群,是该类群的最优势菌种。普氏栖粪杆菌占健康人粪便样本中检测到的细菌总数的5%~15%,是丁酸的重要生产者。
普氏栖粪杆菌可通过产生丁酸盐为肠上皮细胞提供能量来源,并逆转结肠细胞线粒体呼吸缺陷和阻止自噬。普氏栖粪杆菌还可通过促进紧密连接蛋白的合成、黏蛋白和抗菌肽的产生参与结肠屏障的强化[13],以及通过黏液途径和黏液O-聚糖的产生影响肠道生理功能,维持不同细胞类型分泌谱系的适当比例[14]。此外,丁酸可以增加三叶因子的表达,三叶因子是一种有助于维持和修复肠黏膜的黏蛋白相关肽,能够促进肠道创口愈合,已在胃溃疡、结肠炎和坏死性小肠结肠炎模型中得到验证。
NGP在肠道疾病防治的应用中面临着安全性挑战,产肠毒素脆弱拟杆菌有致病作用;红肉饮食显著提高了普氏栖粪杆菌的丰度[14],但增加了结直肠癌的发生风险,还可能引发感染和携带耐药基因,阻碍了其应用;嗜黏蛋白阿克曼菌产生的内毒素是否促进肠道炎症尚无定论,而且其可能参与2型糖尿病、代谢综合征、系统性红斑狼疮的发生与发展。
NGP相关研究的准确性和可重复性挑战也使其临床转化的难度提高。同一菌种的不同菌株具有特异性,例如在对普氏栖粪杆菌的研究中,菌株ATCC27768和A2-165分别调节宿主的不同代谢途径[15],且目前仅使用A2-165分析了其有益的抗炎作用;嗜黏蛋白阿克曼菌菌株ATCC BAA-835具有显著降低结肠炎症指数的能力,而菌株139则没有[7]。此外,某些菌株的益生特性可能与宿主的健康状态相关,同时许多动物实验的获益结果并不能在人体得以准确复制。因此,亟待开展研究以明确菌株的遗传背景和相关信息。
NGP的可利用性值得进一步探讨。细菌可能在特定的微生态环境下发挥功能,多种菌群相互作用,存在着竞争抑制或交叉喂养等复杂关系,因此,补充单一种类的菌株能否发挥预期的效应值得探究。此外,补充特定益生菌时,还需与益生元联用,氧敏感性益生菌需要合适的储存和利用条件。
NGP在肠道疾病防治中的安全性问题应放到首位,需确认NGP没有潜在的毒力因素或转移抗生素耐药性基因的风险,并具有高度的遗传稳定性。除了用无特定病原体动物,最好也在免疫缺陷的动物中进行感染性评估。对于可裂解黏液层的NGP,为提高其安全性,可以尝试使用灭活菌体或提取细菌培养上清液和关键蛋白[6];也可以使用抗黏附分子作为当前益生元方法的补充,以在一定程度上减弱微生物毒力。
为提高准确性,需要改进测序技术和实验方法,以及得到生物信息学支持。当下的高通量测序技术可进行微生物组学分析,揭示疾病之间微生物群的差异。单细胞微生物测序技术似乎更有希望用于宏基因组学分析,从而在菌株水平认识多样性并发现罕见型。此外,代谢组学、微生物群和宿主转录组学分析也有利于更全面地认识肠道功能生态学。在临床试验中,需要设计更完善的随机对照试验,综合考虑饮食和环境的影响,从特定的制剂、剂量、临床终点和目标人群提高干预的精确性。
在可利用性方面,应评价NGP对消化液的耐受性,可使用代谢模型预测提高其在肠道中存活率的配方[19]。对于存在交叉喂养和具有特殊培养环境的NGP,补充益生元尤为重要,例如补充菊粉可增加普氏栖粪杆菌的数量,维生素B2、半胱氨酸或谷胱甘肽可使厌氧的普氏栖粪杆菌在空气中保持活力。在明确NGP特定的作用机制后,可利用合成生物学技术改进现有的益生菌[20]或进行益生菌的复合应用,这既保留了传统益生菌的安全性,又利用了NGP的优势。此外,还可通过改变饮食习惯造福更广阔的人群,例如富含维生素B2的饮食会促进人体肠道中普氏栖粪杆菌增加,低动物脂肪、低糖和高纤维饮食会提高阿克曼菌的数量。尤其在发展中国家,大多数人无法获得在发达国家广泛使用的益生菌,有关NGP的饮食推广将使更多患者受益。
中文:宋林虹,房静远.新型益生菌与肠道疾病防治[J].中华消化杂志,2023,43(5):357-360. DOI:10.3760/cma.j.cn311367-20220413-00174.英文:Song LH, Fang JY. Next-generation probiotics in gastrointestinal disease[J]. Chin J Dig, 2023, 43(5): 357-360. DOI: 10.3760/cma.j.cn311367-20220413-00174.
所有作者声明不存在利益冲突
授予Ⅱ类学分说明和答题二维码见宣传插页(答案见本期第320页)
1.下列不属于NGP的是( )
A.脆弱拟杆菌;B.嗜黏蛋白阿克曼菌;C.普氏栖粪杆菌;D.青春双歧杆菌
2.细菌有利于宿主健康理论最早于哪一年提出( )
A. 1904年;B. 1905年;C. 1906年;D. 1907年
3.目前尚未发现脆弱拟杆菌与以下哪种细菌的相互作用( )
A.艰难梭菌;B.阪崎克罗诺杆菌;C.嗜黏蛋白阿克曼菌;D.罗伊氏乳杆菌
4.以下哪种益生菌可产生具有乙酰基转移酶活性的蛋白质( )
A.脆弱拟杆菌;B.普氏栖粪杆菌;C.罗伊氏乳杆菌;D.嗜黏蛋白阿克曼菌
5.下列是柔嫩梭菌类群中最优势菌种的是( )
A.普氏栖粪杆菌;B.脆弱拟杆菌;C.嗜黏蛋白阿克曼菌;D.青春双歧杆菌



























