
探索阿尔茨海默病(AD)发病年龄分布特征及其影响因素。
基于阿尔茨海默病神经影像学倡议2005-2022年的追踪数据,选取基线认知状态正常(CN)或轻度认知功能障碍(MCI),且随访期间进展成AD者为研究对象。采用单因素分析和多元线性回归探索性别、种族、ApoE ε4基因携带数、家族史、受教育年限和婚姻状况等因素对AD发病年龄的影响。
由CN或MCI进展成AD者共405名,基线年龄为(74.0±6.9)岁。AD发病年龄为(76.6±7.5)岁,男性较女性晚1.9岁。多元线性回归分析显示ApoE ε4基因携带数每增加1个,AD发病年龄早0.344岁。基线认知状态为MCI者,其AD发病年龄比CN者早4.007岁。受教育年限对AD发病年龄影响无统计学意义(P>0.05)。
携带ApoE ε4基因、基线认知状态为MCI者,AD发病年龄可能更早。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
在人口老龄化形势严峻的当下,阿尔茨海默病(AD)成为一项日益严重的全球健康问题。WHO 2022年痴呆实况报道显示,全球现有痴呆患者已超过5 500万,预计到2050年将升至1.39亿,其中60%~70%为AD患者[1]。AD属于年龄依赖性疾病,其发病率随着年龄的增长而上升,65岁以上的发病率为1%~5%,85岁以上则高达20%~40%[2]。有研究表明AD发病年龄越早,认知功能恶化越快[3, 4]。AD患者从症状出现到死亡的时间也受发病年龄影响,发病年龄越大,其生存时间越短[5, 6]。尽管AD不可逆,且目前尚无治愈的方法,但大量研究证实若能在AD发病前进行干预,可减缓认知功能下降的速度[7, 8, 9]。本研究旨在了解AD发病年龄特征及其影响因素,为AD的早发现、早诊断、早治疗提供科学依据。
1. 研究对象:数据来源于2005-2022年阿尔茨海默病神经影像学倡议(ADNI)的数据库(https://adni.loni.usc.edu/)。ADNI是一项纵向多中心研究,截至2022年已招募年龄55~90岁的研究对象1 800余名,主要来自于美国和加拿大的63个地区。根据诊断标准,研究对象认知状态被划分为认知功能正常(CN)、轻度认知功能障碍(MCI)和AD。ADNI包括ADNI-1、ADNI-GO、ADNI-2和ADNI-3四个阶段研究,除了ADNI-3中CN者在基线随访后每2年随访一次,其他研究对象均每隔6个月或12个月随访一次。诊断标准和随访实施办法见ADNI数据库操作手册(https://adni.loni.usc.edu/wp-content/uploads/2010/09/ADNI_GeneralProceduresManual.pdf)。本研究选取基线认知状态为CN或MCI,且随访期间发生AD者共405名为研究对象,随访间隔平均为6.6个月。
2. AD发病年龄:以首次确诊为AD的年龄与其前一次随访时年龄的平均值作为AD发病年龄(Y0),如某位患者随访期间首次确诊为AD的年龄为75.00岁,其前一次随访是在6个月前(即74.50岁),则认为该对象的AD发病年龄为74.75岁。
3. 敏感性分析:由于ADNI的随访间隔最短为6个月,无法获取精准的AD发病年龄。为检验结果的稳健性,分别以首次确诊为AD的年龄(Y1)和前一次随访时的年龄(Y2)作为AD发病年龄进行影响因素分析。此外,本研究进一步剔除基线状态为CN者35名,仅对基线认知状态为MCI者的AD发病年龄(Y0del)进行影响因素分析。
4. 统计学分析:采用SPSS 23.0软件进行统计学分析。连续性变量采用x±s描述,分类变量采用构成比描述。采用独立样本t检验或单因素方差分析,比较不同特征下的AD发病年龄差异。进一步建立3个多元线性回归模型探索AD发病年龄的影响因素,其中模型1纳入性别、种族、ApoE ε4基因携带数和家族史;模型2在模型1的基础上增加受教育年限和婚姻状况;模型3在模型2的基础上增加基线年龄和基线状态。双侧检验,检验水准α=0.05。
1. 一般情况:随访期间进展成AD的研究对象共405名,其中男性240名,基线认知状态为MCI者370名,基线年龄为(74.0±6.9)岁。AD发病年龄为(76.6±7.5)岁,且男性AD发病年龄较女性晚1.9岁,在婚者比其他婚姻状况者早2.9岁。近一半(49.1%)参与者携带了1个ApoE ε4基因,其AD发病年龄较未携带者早2.0岁,较携带2个ApoE ε4基因者晚2.8岁。基线MCI者的AD发病年龄较基线CN者早5.7岁。不同种族、有无家族史之间AD发病年龄差异无统计学意义(P>0.05)。见表1。
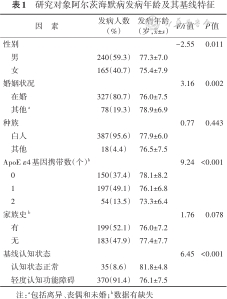
研究对象阿尔茨海默病发病年龄及其基线特征
研究对象阿尔茨海默病发病年龄及其基线特征
| 因 素 | 发病人数 (%) | 发病年龄 (岁,x±s) | F/t值 | P值 |
|---|---|---|---|---|
| 性别 | -2.55 | 0.011 | ||
| 男 | 240(59.3) | 77.3±7.0 | ||
| 女 | 165(40.7) | 75.4±7.9 | ||
| 婚姻状况 | 3.16 | 0.002 | ||
| 在婚 | 327(80.7) | 76.0±7.5 | ||
| 其他a | 78(19.3) | 78.9±6.9 | ||
| 种族 | 0.77 | 0.443 | ||
| 白人 | 387(95.6) | 77.9±6.0 | ||
| 其他 | 18(4.4) | 76.5±7.5 | ||
| ApoE ε4基因携带数(个)b | 9.24 | <0.001 | ||
| 0 | 150(37.4) | 78.1±8.2 | ||
| 1 | 197(49.1) | 76.1±6.8 | ||
| 2 | 54(13.5) | 73.3±6.4 | ||
| 家族史b | 1.76 | 0.078 | ||
| 有 | 199(52.1) | 76.0±7.2 | ||
| 无 | 183(47.9) | 77.4±7.7 | ||
| 基线认知状态 | 6.45 | <0.001 | ||
| 认知状态正常 | 35(8.6) | 81.8±4.8 | ||
| 轻度认知功能障碍 | 370(91.4) | 76.1±7.5 |
注:a包括离异、丧偶和未婚;b数据有缺失
2. AD发病年龄影响因素分析:多元线性回归结果显示ApoE ε4基因携带数与AD发病年龄呈一定线性趋势,携带ApoE ε4基因数每增加1个,AD发病年龄早0.344年;基线年龄每增加1岁,AD发病年龄晚1.008岁(P<0.001);基线认知状态为MCI者,其AD发病年龄比CN早4.007岁(P<0.001)。见表2。
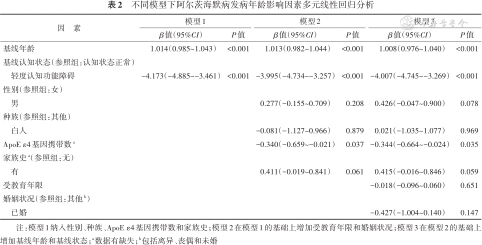
不同模型下阿尔茨海默病发病年龄影响因素多元线性回归分析
不同模型下阿尔茨海默病发病年龄影响因素多元线性回归分析
| 因 素 | 模型1 | 模型2 | 模型3 | |||
|---|---|---|---|---|---|---|
| β值(95%CI) | P值 | β值(95%CI) | P值 | β值(95%CI) | P值 | |
| 基线年龄 | 1.014(0.985~1.043) | <0.001 | 1.013(0.982~1.044) | <0.001 | 1.008(0.976~1.040) | <0.001 |
| 基线认知状态(参照组:认知状态正常) | ||||||
| 轻度认知功能障碍 | -4.173(-4.885~-3.461) | <0.001 | -3.995(-4.734~-3.257) | <0.001 | -4.007(-4.745~-3.269) | <0.001 |
| 性别(参照组:女) | ||||||
| 男 | 0.277(-0.155~0.709) | 0.208 | 0.426(-0.047~0.900) | 0.078 | ||
| 种族(参照组:其他) | ||||||
| 白人 | -0.081(-1.127~0.966) | 0.879 | 0.021(-1.035~1.077) | 0.969 | ||
| ApoE ε4基因携带数a | -0.340(-0.659~-0.021) | 0.037 | -0.344(-0.664~-0.024) | 0.035 | ||
| 家族史a(参照组:无) | ||||||
| 有 | 0.411(-0.019~0.841) | 0.061 | 0.415(-0.016~0.846) | 0.059 | ||
| 受教育年限 | -0.018(-0.096~0.060) | 0.651 | ||||
| 婚姻状况(参照组:其他b) | ||||||
| 已婚 | -0.427(-1.004~0.140) | 0.147 | ||||
注:模型1纳入性别、种族、ApoE ε4基因携带数和家族史;模型2在模型1的基础上增加受教育年限和婚姻状况;模型3在模型2的基础上增加基线年龄和基线状态;a数据有缺失;b包括离异、丧偶和未婚
3. 敏感性分析:结果显示ApoE ε4基因携带数、基线年龄和基线认知状态对Y1和Y2的影响差异均有统计学意义(P<0.05)。家族史对Y2的影响差异有统计学意义(P<0.05),有家族史的研究对象AD发病年龄(Y2)更大。在除去35名基线认知状态CN者后,ApoE ε4基因携带数和基线年龄对发病年龄(Y0del)的影响差异有统计学意义(P<0.05)。见表3。
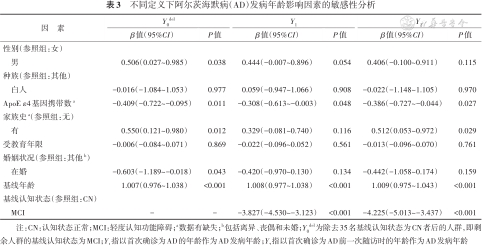
不同定义下阿尔茨海默病(AD)发病年龄影响因素的敏感性分析
不同定义下阿尔茨海默病(AD)发病年龄影响因素的敏感性分析
| 因 素 | Y0del | Y1 | Y2 | |||
|---|---|---|---|---|---|---|
| β值(95%CI) | P值 | β值(95%CI) | P值 | β值(95%CI) | P值 | |
| 性别(参照组:女) | ||||||
| 男 | 0.506(0.027~0.985) | 0.038 | 0.444(-0.007~0.896) | 0.054 | 0.406(-0.100~0.911) | 0.115 |
| 种族(参照组:其他) | ||||||
| 白人 | -0.016(-1.084~1.053) | 0.977 | 0.059(-0.947~1.066) | 0.908 | -0.022(-1.148~1.105) | 0.970 |
| ApoE ε4基因携带数a | -0.409(-0.722~-0.095) | 0.011 | -0.308(-0.613~-0.003) | 0.048 | -0.386(-0.727~-0.044) | 0.027 |
| 家族史a(参照组:无) | ||||||
| 有 | 0.550(0.121~0.980) | 0.012 | 0.329(-0.081~0.740) | 0.116 | 0.512(0.053~0.972) | 0.029 |
| 受教育年限 | -0.006(-0.084~0.071) | 0.869 | -0.022(-0.096~0.052) | 0.561 | -0.013(-0.096~0.070) | 0.761 |
| 婚姻状况(参照组:其他b) | ||||||
| 在婚 | -0.603(-1.189~-0.018) | 0.043 | -0.420(-0.970~0.130) | 0.134 | -0.442(-1.058~0.174) | 0.159 |
| 基线年龄 | 1.007(0.976~1.038) | <0.001 | 1.008(0.977~1.038) | <0.001 | 1.009(0.975~1.043) | <0.001 |
| 基线认知状态(参照组:CN) | ||||||
| MCI | - | - | -3.827(-4.530~-3.123) | <0.001 | -4.225(-5.013~-3.437) | <0.001 |
注:CN:认知状态正常;MCI:轻度认知功能障碍;a数据有缺失;b包括离异、丧偶和未婚;Y0del为除去35名基线认知状态为CN者后的人群,即剩余人群的基线认知状态为MCI;Y1指以首次确诊为AD的年龄作为AD发病年龄;Y2指以首次确诊为AD前一次随访时的年龄作为AD发病年龄
本研究中AD发病年龄为(76.6±7.5)岁,晚于巴西圣保罗市人群[(73.4±6.5)岁]和加勒比西班牙裔人群的AD发病年龄[(73.3±10.6)岁][10, 11]。入组偏倚可能是导致本研究AD发病年龄高的主要原因,ADNI在招募研究对象时为使CN人群的基线年龄与MCI和AD人群大致匹配,尽量减少年龄<70岁的CN者,且由于无法获得入组时就已经是AD,即基线认知状态为AD者的具体发病年龄(其AD发病年龄早于基线年龄),本研究排除了基线认知状态为AD者。然而经计算,被排除人群的基线年龄为(74.8±8.0)岁,低于本研究得到的AD发病年龄。
ApoE ε4基因携带数越多,AD发病年龄越早。有研究也证实ApoE ε4基因携带数与AD发病年龄有着显著的剂量效应关系,携带数量较多的人群AD发病年龄更早[12, 13]。本研究发现ApoE ε4基因携带数与AD发病年龄呈一定线性趋势,携带2个ApoE ε4基因比携带1个基因者发病年龄早2.8岁,比未携带ApoE ε4基因者早4.8岁,这与挪威的一项研究结果相近[14]。此外,ApoE ε4基因携带数也被证实与认知功能的下降速度有关,携带者认知功能下降速度比未携带者更快,AD发病年龄更早[15, 16]。
本研究中受教育年限对AD发病年龄的影响无统计学意义,这与教育可增加认知储备延缓AD发生的观点不一致[17, 18, 19]。认知储备学说认为大脑在发生AD神经病理学改变后,会使用现有的“认知储备/储存库”补偿病理学改变引起的功能下降[20, 21]。学校教育、社会经济地位、社会参与和认知活动等被认为能增加认知储备,可延缓AD症状发生[19,22]。但也有研究发现受教育年限与各认知领域随时间变化无关,与AD发病年龄也无关[10,23]。还有研究得出相反的结果,即高文化程度的老年人认知功能下降速度更快,发生AD的年龄更早[24, 25]。Roe等[25]认为受过更多教育的人更有可能从事认知相关工作,认知功能(如记忆、语言等领域)的细微变化可能会被更早发现,使这些人就医年龄更早,在发生AD后能更早被诊断出来,AD发病年龄更小。
本研究中基线状态为MCI的AD发病年龄较基线CN者早4.007岁,可能原因:一是MCI发展至AD历程较短。AD的自然病程包括较长的临床前阶段(CN阶段)、早期临床阶段(MCI阶段)和AD阶段,MCI是介于CN和AD之间的中间状态或过渡状态,因此MCI进展为AD的历程短于CN[26]。在控制基线年龄后,基线状态为MCI的AD发病年龄小于基线CN者。二是基线状态为MCI的平均基线年龄小。ADNI在招募研究对象时排除了年龄<70岁的CN者,而MCI者基线年龄<55岁被排除。本研究选取随访期间发生AD者为研究对象,在最终纳入样本中,基线状态为CN者的基线年龄(75.5岁)高于MCI者(73.9岁)。鉴于此,本研究在敏感性分析中剔除了基线为CN者35名,探索AD发病年龄的影响因素,并得到类似结果。
去除35名基线认知状态为CN者后的敏感性分析显示,男性的AD发病年龄比女性晚0.506岁,在婚者比其他婚姻状况者早0.603岁,有家族史者比无家族者晚0.550岁,差异均有统计学意义(P<0.05)。也有研究表明女性认知功能下降速度快于男性,在婚者AD发病年龄更早[27, 28, 29]。其中性别差异可能与女性雌激素水平的下降有关。雌激素可刺激α分泌酶活性,从而增强淀粉样蛋白前体加工生成非β-淀粉样蛋白[30, 31]。绝经后女性的雌激素,尤其是雌二醇显著减少,而男性的雌激素却没有明显变化[32],这导致女性的淀粉样斑块水平较男性更高,认知功能下降速度更快,进而更早发生AD。对于婚姻状况,de Oliveira等[29]认为在婚者发病年龄更早的可能原因是有伴侣存在使认知功能受损被更早发现,且有家族史者的AD发病年龄更晚这一结果与既往研究结论不一致[10,33],与本研究中的单因素分析结果亦相反。这一矛盾结果可能由于本研究排除了基线认知状态为AD的人群,而排除的这部分人群中有家族史者的基线年龄[(73.8±7.5)岁]比无家族史者[(76.2±7.9)岁]更早,且均小于本研究得到的发病年龄[(76.6±7.5)岁],因此有关家族史与AD发病年龄之间的关系有待依赖更完备的数据进一步探讨。
本研究资料来源于纵向多中心研究,随访时间长,研究对象人群基数大,依从性较好,且进行了多种敏感性分析,结果更稳定可靠。本研究存在局限性。首先,由于研究随访过程中的时间间隔平均为6.6个月,无法确定AD发病年龄的确切时间;其次,由于研究对象存在入组偏倚,可能会使得到的AD发病年龄偏大;最后,影响因素多为人口学因素,未纳入生活行为方式、精神状况和慢性病等潜在因素。
戎猛, 袁满琼, 方亚. 阿尔茨海默病发病年龄影响因素研究[J]. 中华流行病学杂志, 2023, 44(7): 1068-1072. DOI: 10.3760/cma.j.cn112338-20221007-00861.
Rong M, Yuan MQ, Fang Y. A study on factors associated with age of Alzheimer's disease onset[J]. Chin J Epidemiol, 2023, 44(7):1068-1072. DOI: 10.3760/cma.j.cn112338-20221007-00861.
所有作者声明无利益冲突



























