慢性胰腺炎(chronic pancreatitis,CP)是多种病因导致的胰腺组织不可逆性改变及胰腺功能损害的一种疾病,不完全是由急性胰腺炎进展而来。近年来,随着人们对CP认识的增加,临床检出率呈上升趋势。反复腹痛、多次住院等降低了患儿的生活质量,给患儿家庭及社会造成较大的疾病负担。目前小儿CP的诊断标准与治疗方案尚未统一,故需要制订一个切实可行的诊疗方案以期指导临床实践。
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
慢性胰腺炎(chronic pancreatitis,CP)是多种病因导致的胰腺组织不可逆性改变及胰腺功能损害的一种疾病,不完全是由急性胰腺炎进展而来。近年来,随着人们对CP认识的增加,临床检出率呈上升趋势。反复腹痛、多次住院等降低了患儿的生活质量,给患儿家庭及社会造成较大的疾病负担。目前小儿CP的诊断标准与治疗方案尚未统一,故需要制订一个切实可行的诊疗方案以期指导临床实践。
本共识参照了国内外成人CP诊疗现状,并结合了近几年儿科专家组成员的临床经验及多次讨论、问卷调查结果,并严格遵循《临床指南和专家共识的基本概念与制定规范》[1]。所有讨论中提出的干预措施基于Delphi法由参与制定共识的专家进行投票表决[2],推荐某一干预措施至少需要获得50%的专家认可,且持相反意见的专家比例需低于20%,未满足此项标准将不产生推荐意见;一个推荐意见被列为"强推荐"而非"弱推荐",需要得到至少70%的专家认可,本共识推荐意见均为"强推荐"。本共识的使用者为各级医疗机构小儿CP诊治相关医务工作者,应用目标人群为适宜接受CP诊疗的患儿。
CP是一种胰腺组织的慢性进行性炎症疾病,胰腺实质逐渐被纤维结缔组织替代,最终导致胰腺的内分泌和外分泌功能不全[3],影像学上表现为胰腺形态改变、胰腺钙化、胰管结石以及胰管不规则扩张等。特发性CP指的是排除其他已知病因的CP。
脂肪泻又称为脂肪吸收不良,指脂类物质随粪便排出过多。
胰腺假性囊肿(pancreatic pseudocyst,PPC)是指各种原因引起的胰腺损伤,外漏的胰液、渗出液等积聚于胰腺内或胰腺周围,刺激炎症反应和纤维结缔组织增生,形成纤维性假包膜积液。成人主要继发于急、慢性胰腺炎和胰腺损伤,小儿外伤导致更常见[4]。
胰腺外分泌功能不全(exocrine pancreatic insufficiency,EPI)是指由于各种原因引起的胰酶分泌不足或胰酶分泌不同步,导致患儿出现营养消化吸收不良等症状[5]。
近年来CP在小儿中的发病率及患病率呈上升趋势,发病率为1/200 000~1/50 000,患病率可达29/500 000;CP患儿男女比例差距不大,女性略高[6,7,8,9],目前国内尚缺乏相关数据。
CP病因复杂,主要有遗传因素、解剖因素、毒性因素、药物因素、代谢性因素、自身免疫性因素等,20%的患儿存在1个以上危险因素[7]。遗传因素是小儿CP的最常见病因,其中SPINK1、PRSS1、CFTR、CTRC突变最常见[10,11]。解剖因素造成的胰管梗阻是第二大病因,包括胰腺分裂、胰胆管汇流异常、胰胆结石、括约肌功能障碍等。其中最常见的为胰腺分裂,约7%存在胰腺分裂,但是大多数无临床症状,急性复发性胰腺炎及CP患儿中存在胰腺分裂的概率较正常人群高,可能是CP的独立危险因素[12]。毒性因素、药物因素在患儿中比成人更为常见,常见的药物为丙戊酸类、门冬酰胺酶类和硫嘌呤类等,大多数患儿只与一种药物关联,如长期使用也可能引起CP的发生[13]。代谢性因素包含高脂血症、高钙血症及一些先天性代谢缺陷,可对预后产生影响[14]。小儿自身免疫性胰腺炎较少见,分为2型:Ⅰ型血清免疫球蛋白G4(immunoglobulin G4,IgG4)升高,Ⅱ型与血清IgG4无关,其中Ⅱ型更常见[15]。除上述病因外,外伤、感染及全身系统性疾病等也可为CP的危险因素。
推荐意见1:遗传因素是小儿CP的最常见病因,其他危险因素包括:解剖因素、毒性因素、药物因素、代谢性因素、自身免疫性因素等。
CP患儿临床症状不典型,多为隐性起病。早期常表现为反复发作的上腹痛,部分伴有恶心、呕吐;晚期可出现胰腺功能障碍相关表现(脂肪泻、糖尿病等)。CP患儿常存在营养不良,多为轻度[16]。
CP患儿缺乏典型体征,部分患儿可出现上腹部压痛、拒按,肠鸣音减弱,当出现并发症时可触及腹部包块、移动性浊音阳性等,亦可出现营养不良及发育落后等相关体征。
超声检查可以观察胰腺的形态,了解主胰管或分支胰管是否扩张、是否存在胰管结石、胰腺实质回声是否均匀及钙化等,还可以观察到小网膜囊的肿胀、PPC的形成以及继发感染并脓肿形成等胰腺周围的改变[17]。高频超声组织分辨率更好,且不受探测深度的影响,因此高频超声在小儿CP中更具有优势。超声具有简便无创、无辐射及可反复多次检查等特点,因此适合作为初筛以及随访检查。
X线平片检查可以发现胰腺组织的钙化灶及胰管阳性结石影。
CT扫描表现为包括胰腺萎缩,胰腺钙化,胰管串珠样、不规则扩张或狭窄,胰管结石,PPC及胰腺周围脓肿等,尤其是可显示微小钙化灶。
磁共振成像(magnetic resonance imaging,MRI)对胰腺实质改变敏感,能够显示胰腺组织的成分变化,胰腺组织纤维化后,分泌功能受影响,故在抑脂T1W1和T2W1上均表现为低信号。常规MRI扫描可以显示胰腺形态及胰管形态的改变(表现为胰腺萎缩、胰管的串珠样改变、胰周筋膜的增厚等),磁共振胰胆管成像(magnetic resonance cholangiopancreatography,MRCP)可以评估胆管和胰管的情况,例如胰腺分裂及胰胆管汇流异常等,进一步了解儿童CP是否存在解剖变异[18]。因小儿CP多由遗传及解剖因素导致,且胰腺钙化及胰管阳性结石较成人少见,因此MRI及MRCP在儿童CP中诊断价值优于CT检查[19]。
内镜逆行胰胆管造影术(endoscopic retrograde cholangiopancreatography,ERCP)可以清晰显示胰胆管形态,胰管狭窄或扩张,胰管结石等病变[20]。但是ERCP为有创操作,操作难度大,仅在诊断困难或治疗时选用。
推荐意见2:应将超声检查纳入小儿CP的随访常规检查项目。MRI及MRCP对CP的诊断有重要价值,常用于超声检查后的进一步检查。超声及MRCP为诊断CP的"黄金组合"。
主要包括血清酶学测定、血常规、C反应蛋白等。血清酶学测定(血清淀粉酶、尿淀粉酶、血清脂肪酶)是胰腺炎检测的重要指标。CP急性发作时通常可检测到血淀粉酶、脂肪酶增高,然而对于无急性发作的CP血淀粉酶、脂肪酶可轻度增高或者完全正常。有研究报道CP患儿腹痛发作时,约半数患儿无血清胰酶异常[3]。
原因不明的CP患儿,特别是有胰腺疾病家族史的患儿,建议完善基因检测,其中SPINK1基因变异在亚洲地区最为常见(30%~50%),而PRSS1和CFTR变异相对少见[9]。
胰腺外分泌功能检测方法包括直接试验和间接试验。直接试验即直接通过十二指肠收集胰液,测定胰酶的含量,是诊断EPI的金标准,但其成本高,属侵入性检查,临床应用受限。间接试验应用更为普遍,包括粪便检测、72 h脂肪含量检测、脂肪吸收系数检测等,但敏感性及特异性较低[21]。
CP患儿疾病初期胰岛可能受损,随着病情进展,其胰岛素合成和释放减少可导致糖耐量异常[22]。需要通过测定空腹血糖、糖化血红蛋白水平(若有异常可考虑继续行口服葡萄糖耐量试验)、胰岛素释放试验以评估是否存在糖耐量受损和糖尿病[23]。
包括血钙、血脂、凝血功能测定、甲状旁腺激素检查、病毒检查、IgG4检查等。
推荐意见3:当怀疑CP时,应进行胰酶及胰腺内、外分泌功能检测,必要时可进行基因检测以帮助诊断。尚未诊断糖尿病的CP患儿建议每半年检测一次空腹血糖。
儿童CP基本病理变化包括不同程度的胰腺腺泡组织破坏和小叶间、小叶旁或合并小叶内纤维化,可能伴随胰腺组织的慢性炎症浸润、胰管扩张等[24]。可经超声内镜引导细针穿刺抽吸术、CT或腹部超声引导下的穿刺获取病理标本[25,26],也可通过手术或腹腔镜下取活检获得,从而与胰母细胞瘤、胰腺实性假乳头状瘤等鉴别。但儿童CP胰腺肿块少见,且目前无明确资料有恶变者,目前穿刺活检开展较少。
患儿以反复腹痛、恶心和呕吐等消化道症状就诊时应注意排除CP。
主要诊断依据:①影像学典型表现;②组织学典型改变(影像学及组织学表现见表1)。次要诊断依据:①反复发作上腹痛;②胰酶异常;③EPI;④胰腺内分泌功能不全表现。

慢性胰腺炎影像学及组织学表现
慢性胰腺炎影像学及组织学表现
| 特征性表现 | 典型表现 | 不典型表现 |
|---|---|---|
| 影像学 | 胰管结石;分布于整个胰腺的多发性钙化;ERCP显示主胰管不规则扩张和全胰腺散在不同程度的分支胰管不规则扩张;ERCP显示主胰管完全或部分梗阻(胰管结石或蛋白栓),伴上游主胰管和分支胰管不规则扩张 | MRCP显示主胰管不规则扩张或全胰散在不同程度的分支胰管不规则扩张;MRCP显示全胰腺散在不同程度分支胰管扩张,或单纯主胰管不规则扩张,或存在蛋白栓;CT检查示主胰管全程不规则扩张伴胰腺形态不规则改变;超声或超声内镜显示胰腺内高回声病变(考虑结石或蛋白栓),或胰管不规则扩张伴胰腺形态不规则改变 |
| 组织学 | 胰腺外分泌实质减少伴不规则纤维化(纤维化主要分布于小叶间隙,形成"硬化"样小结节改变) | 胰腺外分泌实质减少伴小叶间纤维化,或小叶内和小叶间纤维化 |
注:ERCP,内镜逆行胰胆管造影术;MRCP,磁共振胰胆管成像
主要诊断依据满足1项即可确诊;影像学或组织学呈现不典型表现,同时次要诊断依据至少满足2项亦可确诊;影像学或组织学呈现不典型表现,同时基因检测发现明确致病基因突变亦可确诊。影像学或组织学呈现不典型表现,同时次要诊断依据不满足2项以上为疑诊,疑诊者继续随访观察;影像学或组织学表现阴性者排除其他诊断后可随访观察(图1)[25,26,27,28,29,30]。
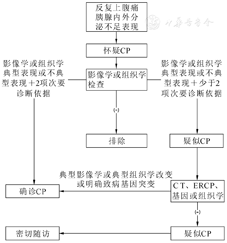

注:CP,慢性胰腺炎;ERCP,内镜逆行胰胆管造影术
推荐意见4:符合影像学或组织学典型表现即可确诊CP,若表现不典型则需要结合次要诊断条件协助诊断,基因检测也是诊断小儿CP的重要依据。
本共识建议将小儿CP分为早期、进展期、加重期及终末期(表2)。

小儿慢性胰腺炎临床分期
小儿慢性胰腺炎临床分期
| 临床分期 | 临床特征 |
|---|---|
| 早期 | 出现腹痛、胰酶升高等临床症状,影像学检查或组织学不典型 |
| 进展期 | 反复腹痛或急性胰腺炎发作,影像学检查或组织学典型改变,出现胰腺内或外分泌功能异常 |
| 加重期(并发症期) | 顽固性腹痛,临床症状加重,内、外分泌功能异常,临床可出现胰腺假性囊肿、胰源性胸腹水等并发症 |
| 终末期 | 腹痛减轻甚至消失,胰腺内、外分泌功能异常,临床出现腹泻、脂肪泻、生长发育落后和糖尿病等 |
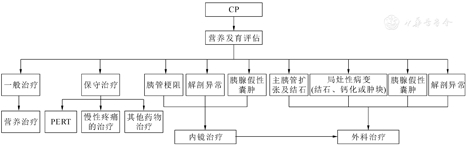
CP应尽早诊治,改善症状,防止器官功能进一步损害。根据患儿的症状、体征和辅助检查结果,由多学科医师包括消化内科、普外科、内分泌科、影像介入科、营养科及麻醉科等联合评估,并制订个体化治疗方案。
小儿处于生长发育阶段能量消耗大,CP患儿的高代谢状态、腹痛、EPI等严重影响了其营养状况,营养不良风险增加[31]。CP患儿营养不良发生率为25%~41%[16]。因此,应对CP患儿进行积极的营养风险筛查及评估,一般建议每6至12个月评估生长发育情况和饮食摄入情况。目前针对CP患儿营养风险筛查尚无公认的筛查工具,可根据患儿情况个体化选择。营养评估应对饮食史、体格检查和生化营养指标等进行综合评估。体格检查建议常规监测CP患儿体重、身高和身体质量指数,其他评估指标还包括中臂围、三头肌皮褶、握力、生物电阻抗等[32]。生化营养指标包括前白蛋白、视黄醇结合蛋白、转铁蛋白、脂溶性维生素、矿物质和微量元素(血清铁、锌和镁)等,建议每12至18个月根据临床需要进行脂溶性维生素检测[21]。
营养治疗是CP患儿治疗的有效辅助手段,无论CP患儿是否存在EPI,建议给予正常均衡饮食,应避免脂肪限制(除非高甘油三酯血症是潜在病因)[23,32]。对于营养状况不佳的患儿,应首先识别是否存在EPI,给予少量多次、高能量的膳食饮食调整[21]。若仍无法满足患儿的营养需求,可选择口服营养补充。对于补充足够的胰酶并排除细菌过度生长、不能缓解吸收不良及其伴随症状的患儿,可以使用含中链甘油三酯的口服营养补充[33]。疼痛、胃排空延迟、持续恶心或呕吐以及胃出口综合征患儿,建议选择鼻肠管饲,长期空肠造瘘途径可用于肠内营养超过30 d的患儿。肠内营养如果不耐受标准配方,可以使用含有中链甘油三酯的半元素配方[33]。肠外营养适用于继发于十二指肠狭窄的胃出口梗阻、复杂性瘘管疾病、胰腺手术前严重营养不良的患儿以及肠内营养不耐受的患儿[21]。另外,CP患儿常存在维生素、矿物质以及微量元素缺乏的风险,治疗时应注意监测,出现缺乏应给予补充。
推荐意见5:CP患儿无论是否存在EPI,均建议给予正常均衡饮食,避免脂肪限制。
推荐意见6:营养状况不佳的患儿,应给予少量多次、高能量的饮食,必要时予肠内营养治疗。
推荐意见7:CP患儿每6至12个月门诊复查生长发育情况和饮食摄入情况,每12至18个月根据临床需要进行脂溶性维生素检测。
CP患儿通过临床体征、症状和(或)吸收不良的实验室检查诊断EPI时,应启动PERT。CP患儿PERT剂量建议与囊性纤维化相关的EPI使用剂量建议相似(表3)[32,34]。儿童PERT推荐剂量主要基于体重或食物中的脂肪量,零食建议剂量减半。肠溶微球或直径<2 mm的微微球是EPI的首选制剂,为获得最佳效果建议胰酶应与餐同服[21]。对于无法经口喂养的患儿,胰酶应通过肠内饲管以推注方式给药,不建议与肠内营养剂混合[35]。PERT通常耐受性良好,副作用少见[36]。大多数患儿最大剂量应每日少于10 000 U脂肪酶/kg或每餐少于6 000 U脂肪酶/kg,以预防纤维化结肠病变[32]。PERT的疗效应通过胃肠道症状缓解和营养参数的改善来评估。当CP患儿在PERT治疗后临床反应不理想的情况下,可增加胰酶剂量或使用质子泵抑制剂(proton pump inhibitors,PPI)[36,37]。如果采取了这些措施仍有EPI,应评估其他导致与EPI类似的吸收不良的疾病,例如小肠细菌过度生长、乳糖不耐受症、乳糜泻等[36]。另外,PERT治疗患儿应避免高纤维饮食,因其会降低补充胰酶的有效性。

不同年龄段慢性胰腺炎患儿胰酶替代治疗推荐剂量
不同年龄段慢性胰腺炎患儿胰酶替代治疗推荐剂量
| 年龄 | 胰酶剂量 |
|---|---|
| <1岁 | 每120 ml配方奶或母乳中加入2 000~4 000 U脂肪酶,或喂养膳食中每克脂肪含约2 000 U脂肪酶 |
| 1岁≤年龄≤4岁 | 喂养膳食中每克脂肪需含2 000~4 000 U脂肪酶,根据需要调整剂量,每日最大剂量为10 000 U脂肪酶/kg |
| >4岁 | 每餐从500 U脂肪酶/kg开始,逐渐增加剂量至每餐1 000~2 500 U脂肪酶/kg,或每日10 000 U脂肪酶/kg,或喂养膳食中每克脂肪需含2 000~4 000 U脂肪酶 |
注:喂养膳食中脂肪,指患儿食用的包括膳食、零食和饮料在内的脂肪
①抗酸剂:如果PERT效果不佳,增加剂量(2倍或3倍)后仍无明显改善,须加用PPI;②生长激素释放抑制激素类似物:CP并发瘘管或腹水等并发症,建议初期采用肠内或肠外营养保守治疗,并适当添加生长激素释放抑制激素类似物;③抗生素:CP急性加重期不建议常规使用抗生素[34];④胰岛素:CP并发糖尿病时在内分泌专科医生指导下使用。
首先应消除导致CP的病因,若症状无明显缓解,则遵循世界卫生组织关于慢性非恶性疼痛的原则进行治疗。目的是缓解疼痛和改善功能状态。有效的疼痛治疗包含多种形式的综合治疗,其中药物治疗是重要的组成部分,非药物治疗包括理疗、针灸和心理治疗等。世界卫生组织用于癌痛治疗的三阶梯镇痛原则同样适用于CP引起的慢性疼痛的治疗。
推荐意见8:当EPI发生时,应进行PERT治疗,其使用剂量可参照囊性纤维化诱导的EPI的指南[32]。
推荐意见9:CP疼痛管理遵循世界卫生组织关于慢性非恶性疼痛的原则进行。
内镜治疗主要包括ERCP及超声内镜(endoscopic ultrasound,EUS)。EUS主要用于PPC经消化道的穿刺引流,此项技术在成人应用成熟,但在小儿应用尚缺乏大样本数据支持。ERCP及相关介入治疗技术在CP治疗的主要适应证为主胰管梗阻及PPC等,造成主胰管梗阻的原因主要包括胰管结石、主胰管狭窄及胰管解剖异常等,内镜可通过胰管支架置入及胰管结石去除以缓解梗阻,减少胰腺炎发作次数,减轻腹痛症状,改善患儿生活质量。对CP患儿进行ERCP需严格把握手术指征,婴幼儿需要充分评估胰胆管形态、胰管结石及是否存在解剖异常等情况后决定是否需进一步ERCP干预。
儿童胰管结石多为蛋白栓样结石,质地较松散,体积较小的主胰管结石可于ERCP下行十二指肠乳头柱状球囊扩张或切开后取出。而位于胰头或胰体>5 mm的主胰管阳性结石,内镜取出难度大,可考虑体外冲击波碎石术联合ERCP取石[37]。
根据胰管狭窄的程度、位置选择支架型号,首选置入单根胰管塑料支架[21]。目前小儿CP治疗过程中,胰管支架留置时间及更换时间需结合临床症状、胰腺炎反复发作次数、胰管狭窄再评估等综合判定[38]。
PPC出现症状且经内科保守治疗无效时可进行干预,干预方式有超声引导下经皮外引流、内镜引导下经乳头或胃或十二指肠壁引流等。
推荐意见10:ERCP主要术式包括胰管支架置入和胰管结石去除,主要适用于主胰管梗阻(胰管结石、主胰管狭窄及胰管解剖异常)及PPC等,可有效缓解临床症状以及减少胰腺炎的发生次数。
CP是一种进行性疾病,部分患儿随着疾病的进展可出现顽固性腹痛或胰腺内外分泌功能不足,内镜治疗虽然可以通过结石去除、胰管支架置入等手段解决部分主胰管梗阻的问题,但对于整个胰管引流是否通畅及胰腺肿物等方面治疗可能存在不足之处,需要外科手术治疗。
目前小儿CP外科手术治疗的相关文献较欠缺,手术治疗经验多基于成人数据。一项小儿CP多中心横断面研究显示76例患儿中有30例接受过手术治疗[41],而40%~75%CP成年患者最终需要手术治疗[42,43,44]。
CP手术时机存在一定争议[45]。有资料显示早期手术治疗(CP发病时间小于3年)可以获得更高的疼痛缓解率、更好地保留胰腺内外分泌功能及获得更好的长期生命质量,但缺乏大样本长期随访的队列研究[28,46,47]。为减少创伤,保留更多的胰腺组织,儿童CP外科手术治疗多用于保守或内镜治疗无效或不适宜时使用[26,48,49]。
小儿CP的手术方式应遵循个体化治疗原则,由多学科小组根据病因、胰管、胰腺组织及胰周脏器病变特点、并发症等因素进行术式选择。主要包括胰管引流术、胰腺部分切除术、联合术式、全胰切除联合自体胰岛移植术4类[48]。
胰管引流术主要适用于主胰管扩张、主胰管结石及胰头无明显炎性肿块者,可有效缓解疼痛、最大限度保留胰腺的功能,是小儿CP开展较多、应用范围较广的手术方式[26,50,51,52,53]。该手术并发症较少,术后疼痛缓解率可达73%~86%[41,53,54]。
胰腺部分切除术主要适用于CP合并局灶性结石、钙化或肿块者,比如胰头多发性结石、胰头部炎性肿块及胰体或尾部节段性CP患儿[55]。根据切除部位分为标准胰十二指肠切除术或保留幽门胰十二指肠切除术、中段胰腺切除术、胰体尾切除术,但胰腺部分切除术创伤大,术后并发症多[56,57]。
联合术式适用于胰头部局限性病灶同时合并胰管梗阻者,是在保留十二指肠和胆管完整性基础上,切除胰头部局限性病变组织,同时行胰管引流术以解除主胰管梗阻。主要手术方法有Beger术、Frey术及Berne术,其中Beger术及Berne术主要适用于CP合并胰头部组织病变明显者[25,26]。而小儿CP胰头部肿块少见,主要表现为胰头部胰腺组织的慢性炎症及远端主胰管梗阻,因此Frey术更适用于CP患儿[58,59]。Frey术后疼痛缓解率高达82%~91%,术后并发症更少,患儿预后较好[58,59,60]。
小儿CP病因以遗传因素为主,多种治疗方法并不能缓解胰腺实质的进行性损伤,治疗后均有可能存在症状的复发,并且表现为"小导管疾患",无明显的炎性肿块或主胰管扩张,行胰管引流或联合手术并不能缓解症状,因此全胰腺切除联合自体胰岛移植治疗小儿CP具有广阔的前景[48,61,62]。
推荐意见11:胰管引流术适用于主胰管扩张、主胰管结石而无炎性肿块者;胰腺部分切除术适用于小儿CP合并局灶性病变如结石、钙化或肿块者;联合术式适用于胰头部局限性病灶同时合并胰管梗阻者。
小儿CP并发症相对少见,其中最常见的为PPC。当PPC引起不适、出现并发症(感染、出血或破裂等)或持续增大时,应予以治疗[25]。内科及内镜治疗效果不佳时,外科手术治疗仍具有十分重要的意义。主要手术方式为囊肿空肠或囊肿胃内引流术,保证胰管通畅并取尽结石。如胰头囊肿旁小胰管内存在结石,可行包括囊肿在内的胰头部分切除术;部分胰体尾部的囊肿可以考虑行胰体尾切除术。解剖变异为小儿CP的常见原因,包括胰腺分裂、胰胆管汇流异常、环状胰腺等,当CP患儿合并有相关解剖变异时可能需要外科干预以解除诱发因素,但目前相关报道较少[63]。
推荐意见12:当PPC引起不适症状、出现并发症,且内科及内镜治疗效果不佳时,推荐手术方式为囊肿空肠或囊肿胃内引流术。
部分CP患儿病情可能相对稳定,通常无明显临床症状,但部分患儿可能随着病情的进展出现胰腺内外分泌功能不足、营养不良甚至影响生长发育,严重影响生命质量,对于此类患儿应定期随访。随访内容包括病史询问(腹痛或急性发作情况)、体格检查、营养及生长发育评估、实验室检查(胰酶及血糖)及影像学检查(超声或MRCP)[23,65]。
本共识经参照国内外成人及儿童CP的诊疗方案,结合参与共识制定专家的多番讨论和问卷调查结果,广泛征求意见并反复修改文稿制定推出。内容主要包括小儿CP的定义、诊断、辅助检查以及内外科治疗等,希望今后通过推进多中心研究,进一步完善相关内容。
执笔专家(排名不分先后):闫学强(华中科技大学同济医学院附属武汉儿童医院)、葛亮(天津市儿童医院)、秦鑫锞(华中科技大学同济医学院附属武汉儿童医院)、郑启鹏(首都儿科研究所)
参与讨论与制定共识的专家(按单位及姓名汉语拼音字母表排序):复旦大学附属儿科医院(陈功)、广州市妇女儿童医疗中心(温哲)、国家儿童医学中心首都医科大学附属北京儿童医院(黄柳明、李东丹、秦秀敏、王晓曼、吴捷)、河北医科大学第二医院(李英超)、湖南省儿童医院(尹强)、华中科技大学同济医学院附属武汉儿童医院(段栩飞、秦鑫锞、邵剑波、闫学强、周诗琼)、南方医科大学附属佛山市妇幼保健院(乐盛麟)、上海儿童医学中心(邓朝晖)、上海市儿童医院(吕志宝)、深圳市儿童医院(王斌)、四川大学华西医院(靳曙光、向波)、天津市儿童医院(葛亮、詹江华、赵煜)、新疆医科大学第一附属医院(李万富)、浙江大学医学院附属儿童医院(高志刚、楼金玕)
国际实践指南注册与透明化平台,PREPARE-2022CN595
Practice Guideline Registration for Transparency,PREPARE-2022CN595
所有作者均声明不存在利益冲突