
弥漫性毒性甲状腺肿(Graves病)合并肢端肥大症的病例在临床上非常罕见,现对1例因Graves病就诊而意外发现肢端肥大症的患者进行回顾分析,为该类少罕见病的诊断及治疗提供参考。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肢端肥大症是一种起病隐匿的慢性进展性内分泌疾病,最常见的发病原因是生长激素异常分泌,其中95%以上的患者是由垂体腺瘤分泌过量的生长激素所致,而异位分泌生长激素释放激素(growth hormone releasing hormone,GHRH)或分泌生长激素的神经内分泌肿瘤不超过5%[1,2]。虽然垂体生长激素腺瘤是鞍区良性肿瘤,其过量分泌生长激素促使肝脏过度合成胰岛素样生长因子-1(IGF-1)。长期暴露于生长激素和IGF-1导致多个系统并发症,其中包括甲状腺,国内关于肢端肥大症伴甲状腺疾病的报道较少,现对我院诊治的1例肢端肥大症合并弥漫性毒性甲状腺肿(Graves病)患者的临床资料进行总结,并结合相关文献进行分析,以提高临床医生的诊治能力。
男,32岁,因"面容改变手足发胀4年余,心悸、眼胀3个月余"入院。患者4年前开始出现面容改变,表现为颧骨突出、鼻翼增宽、嘴唇增厚,逐渐出现手足发胀和变大,鞋码由42码渐增大到43码,手指关节增粗,自觉皮肤粗糙,油脂汗液分泌较多。伴多饮、多尿。1年前体检发现甲状腺功能异常,未诊治。入院前3个月出现心悸和眼胀,行甲状腺功能检查,游离三碘甲状腺原氨酸(FT3)7.26 pmol/L(正常值3.28~6.47 pmol/L),促甲状腺激素(TSH)<0.005 mU/L(正常值0.49~4.91 mU/L),促甲状腺素受体抗体(TRAb)2.7 U/L(阳性);甲状腺超声示甲状腺形态饱满,腺体回声粗糙、不均匀,呈网格样改变,甲状腺血流信号丰富,甲状腺弥漫性病变。入院1周前(5月12日)复查甲状腺功能,总三碘甲状腺原氨酸(TT3)3.59 nmol/L(正常值1.01~2.48 nmol/L),总甲状腺素(TT4)141.85 nmo1/L(正常值69.97~152.52 nmol/L),FT3 12.56 pmol/L,游离甲状腺素(FT4)24.44 pmo/L(正常值7.64~16.03 pmol/L),TSH<0.05 mU/L;生长激素3.75 μg/L(正常值0~3 μg/L),IGF-1 545 μg/L(正常值71~234 μg/L)。为明确诊断而收入我科。体格检查:肢端肥大症面容,双眼突出,双侧甲状腺质地软,可闻及血管杂音,触发泌乳阴性,心肺腹查体未见明显异常,双下肢无水肿。入院完善相关检查,TRAb 2.7 U/L(阳性);抗甲状腺球蛋白抗体102.7 kU/L,抗甲状腺过氧化物酶抗体509.16 kU/L;随机生长激素4.05 μg/L;75 g口服葡萄糖抑制生长激素试验0、30、60、120和180 min分别为3.94、3.04、3.12、3.72和4.17 μg/L;超声心动示三尖瓣少量反流,二尖瓣极少量反流(生理性);腹部超声示左肾小囊肿;胸前12导联心电图示窦性心动过速(心率95次/min)。鞍区动态增强MRI示垂体强化不均匀,左侧可见类圆形延迟强化影,直径约7 mm,垂体瘤不除外(图1)。诊断为肢端肥大症垂体生长激素瘤合并Graves病。给予甲巯咪唑(Merck KGaA,国药准字J20171078,商品名:赛治)10 mg口服,1次/d;心率95~100次/min时给予酒石酸美托洛尔[阿斯利康药业(中国)有限公司,国药准字H32025390]12.5 mg口服,2次/d。治疗约40 d后(6月27日),TT3 0.93 nmol/L,TT4 62.04 nmol/L,FT3 4.86 pmol/L,FT4 9.28 pmol/L,恢复至正常水平;但是TSH仍<0.05 mU/L,继续口服原剂量甲巯咪唑治疗。8月8日复查甲状腺功能,TSH 5.23 mU/L,恢复正常;但复查肝功能示转氨酶升高,甲巯咪唑减量至5 mg/次,1次/d。10月3日复查甲状腺功能,结果均正常,甲巯咪唑继续减量至2.5 mg/次,1次/d;11月13日调整为2.5 mg隔日1次,此时患者眼胀等症状缓解。另一方面,患者生长激素和IGF-1水平均明显升高,进一步行口服葡萄糖抑制试验,结果示各时间点生长激素不能被抑制到1 μg/L以下,提示生长激素自主分泌;鞍区动态增强MRI示垂体左侧延迟强化,垂体瘤不除外。手术切除是肢端肥大症的一线治疗方法,神经外科会诊后建议控制甲状腺功能后择期手术,故暂给予患者醋酸奥曲肽微球(进口药品注册标准JX20050124,Novartis Pharma Schweiz AG)20 mg深部肌内注射以抑制生长激素分泌,约28 d注射1次。治疗后约1个月,生长激素0.88 μg/L,IGF-1 247 μg/L,明显下降。该患者出院后随访6个月,每个月复查甲状腺功能、血常规、肝功能、生长激素和IGF-1等,基本正常。患者除初次注射48 h出现一过性腹泻,未出现腹痛和注射部位不适等不良反应,未因药物的不良反应停药。
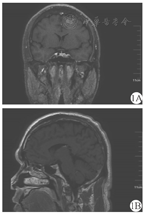

注:冠状位(1A)和矢状位(1B)动态增强MRI示鞍底局部下陷,垂体饱满,左侧可见类圆形延迟强化影,直径约7 mm
肢端肥大症是一种慢性进展性内分泌疾病,可引起全身多系统并发症,而甲状腺病变是肢端肥大症最常见的并发症之一。甲状腺激素与生长激素/IGF-1轴相互影响,甲状腺激素通过调节生长激素的分泌和生物活性,参与调节IGF-1的合成和分泌[3]。同样生长激素/IGF-1轴亦参与调控甲状腺细胞的增殖、功能和甲状腺激素的代谢[4,5],目前已报道的关于肢端肥大症合并甲状腺疾病主要包括弥漫性或结节性甲状腺肿、甲状腺结节、中枢性甲状腺功能亢进、自身免疫性甲状腺炎及甲状腺恶性肿瘤等[6],其中以甲状腺肿最为常见,一项回顾性研究结果显示有52%的肢端肥大症患者合并甲状腺肿[7]。Xu等[8]比较了无功能垂体瘤和垂体生长激素瘤合并甲状腺疾病的差别,发现垂体生长激素瘤患者合并甲状腺肿达75%,明显高于对照者。Natchev等[9]的一项横断面研究纳入了146例肢端肥大症患者,结果显示肢端肥大症患者甲状腺体积与肢端肥大症活动度明显相关。另外,肢端肥大症患者的甲状腺体积与生长激素、IGF-1呈线性正相关[10,11]。在长效生长抑素类似物治疗后或肿瘤切除后,生长激素和IGF-1水平会逐渐恢复,甲状腺体积较前也明显缩小[12],推测可能由于肢端肥大症活动期甲状腺激素分解加快,促使甲状腺素结合前白蛋白增多,FT4减少、肾脏碘清除率升高体内碘缺乏,从而导致甲状腺代偿性增生肿大。
Maiorano等[13]研究结果显示,IGF-1在甲状腺细胞增殖中扮演重要角色,免疫组织化学方法检测6例因手术切除的Graves病患者的甲状腺组织IGF-1和IGF-1受体的表达情况,与正常组织相比Graves病患者甲状腺组织IGF-1 mRNA过表达,表明IGF-1和IGF-1受体参与了Graves病的发生。Tseng等[14]对比了因Graves病导致甲状腺功能亢进症组和健康对照组的临床资料,结果显示甲状腺功能亢进症组患者血清IGF-1明显高于健康对照组,且IGF-1水平与TSH呈负相关。
Graves病是一种自身免疫性甲状腺疾病,与肢端肥大症共同发病的情况极为罕见。Halloul等[15]在2021年报道1例老年女性肢端肥大症同时合并空蝶鞍及Graves病患者,Graves病的严重程度随着伴发肢端肥大症而加重,肢端肥大症在经蝶切除肿瘤后缓解,甲状腺功能亢进症状、体征及甲状腺激素水平随之得到明显改善。本例患者仅口服甲巯咪唑10 mg约40 d后,FT3和FT4恢复正常,病情得到初步控制,不除外与其生长激素、IGF-1得到有效控制有关。关于IGF-1/IGF-1受体信号通路的激活对免疫功能的影响,Di Cerbo等[16]研究结果显示生长激素可能会刺激B淋巴细胞产生TSH受体抗体,从而促进了TSH受体抗体诱导的Graves病甲状腺毒症。IGF-1则通过结合IGF-1受体控制T淋巴细胞和B淋巴细胞的增殖和分化影响免疫反应,并且IGF-1和IGF家族其他成员与TSH协同调节甲状腺功能和生长。
综上所述,肢端肥大症增加了良、恶性甲状腺疾病的发生率,初次诊断的肢端肥大症患者,应常规进行甲状腺超声等检查,早期诊断、综合管理对肢端肥大症患者的预后起到积极的作用。
所有作者声明无利益冲突



























