
分析急性大血管闭塞性缺血性卒中(AIS-LVO)血管内治疗无效再通的影响因素。
回顾性选择2019年1月至2021年12月在海军军医大学第一附属医院脑血管病中心接受血管内治疗且成功再通的前循环AIS-LVO患者,以治疗后3个月改良 Rankin 量表(mRS)评分作为预后评价指标,mRS评分≤2分的患者为有效再通组,3~6 分为无效再通组。分析两组患者的危险因素、基线美国国立卫生研究院卒中量表(NIHSS)评分、基线格拉斯哥昏迷量表(GCS)评分、Alberta卒中项目早期CT评分(ASPECT)、核心梗死体积等指标,采用多因素 logistic 回归模型分析血管内治疗无效再通的影响因素。不符合正态分布的连续变量以[M(Q1,Q3)]表示。
符合入组标准的患者368例,男228例,女140例,年龄为68(61,77)岁。有效再通的患者196例,无效再通的患者172例,血管内治疗后3个月无效再通率为46.74%(172/368)。比较两组患者的一般资料和危险因素发现,无效再通组患者年龄[71(65,79)岁]大于有效再通组[65(59,72)岁]、基线NIHSS评分[18(14,22)分]和未达mtTICI分级3级再通率(36.1%)高于有效再通组[12(7,17)分、(19.9%)],基线GCS评分[11(9,13)分]低于有效再通组[14(11,15)分];比较两组患者影像学资料发现,无效再通组核心梗死体积[28(7,65)ml]大于有效再通组[6(0,17)分],ASPECTS[7(5,9)分]低于有效再通组[9(7,10)分]。除此以外,无效再通组高血压病、房颤、全身麻醉和症状性颅内出血比例更高,发病到穿刺时间与发病到再通时间更长(均P<0.05)。两组患者在急性卒中Org10172治疗试验(TOAST)分型和闭塞血管部位差异均有统计学意义(均P<0.05)。多因素logistic回归模型分析结果显示,年龄≥80岁(OR=1.935,95%CI:1.168~3.205),基线NIHSS评分≥20分(OR=1.999,95%CI:1.202~3.325),GCS评分(OR=2.299,95%CI:1.386~3.814),既往有卒中史(OR=1.977,95%CI:1.085~3.604),全身麻醉(OR=1.981,95%CI:1.143~3.435),未达3级再通(OR=2.846,95%CI:1.575~5.143),ASPECTS<6分(OR=2.616,95%CI:1.168~5.857),核心梗死体积>70 ml(OR=2.712,95%CI:1.130~6.505)是无效再通的影响因素。
年龄≥80岁、既往卒中史、基线NIHSS评分≥20分、GCS评分≤8分、全身麻醉、ASPECTS<6分、核心梗死体积>70 ml、未达到3级再通是影响AIS-LVO患者血管内治疗后发生无效再通的影响因素。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
血管内治疗已经成为急性大血管闭塞性缺血性卒中(acute ischemic stroke with large vessel occlusion,AIS-LVO)最有效的治疗手段,其能够显著提高血管再通率,改善临床预后,被各国指南一致推荐[1, 2]。随着血管内治疗技术不断成熟以及器械的不断更新,血管成功再通率已达80%以上[3]。但是,较高的血管再通并未带来理想的临床结局,良好预后率只有32%~46%[3, 4, 5, 6, 7, 8],仍有约60%的患者为无效再通[9],即血管内治疗后闭塞血管成功再通,但90 d的临床结局尚不能达到功能独立。因此,本研究拟探讨AIS-LVO患者血管内治疗后无效再通的影响因素,旨在帮助筛选合适的患者进行干预。
回顾性收集2019年1月至 2021年12月在海军军医大学第一附属医院脑血管病中心接受血管内治疗的AIS-LVO患者524例。纳入标准:(1)年龄≥18岁;(2)术前完成多模影像学检查,包括头颅计算机断层扫描(computed tomography,CT)、计算机断层扫描血管成像(computed tomography angiography,CTA)和计算机断层扫描灌注成像(computed tomography perfusion,CTP);(3)完成头颅CT平扫排除出血,头颅CTA证实急性前循环大血管闭塞且与临床表现相符,包括颈内动脉(internal carotid artery,ICA)颅内段、大脑中动脉(middle cerebral artery,MCA)M1段和M2段、大脑前动脉(anterior cerebral artery,ACA)A1段和A2段;(4)头颅CTP原始数据传输至RAPID(iSchemaView,Menlo Park,CA)软件进行自动化量化分析;(5)发病至股动脉穿刺时间≤24 h;(6)术后即刻血管成功再通,即改良脑梗死溶栓(modified thrombolysis in cerebral ischemia,mTICI)分级为2b/3级;(7)发病前改良Rankin量表(modified Rankin scale,mRS)评分≤2分。排除标准:(1)术后3个月失访;(2)患有严重心肝肾等重要器官功能不全、恶性肿瘤、自身免疫疾病等疾病。本研究符合《赫尔辛基宣言》对伦理的要求,患者知情同意豁免。
1. 一般资料收集:收集所有患者人口统计学信息和基本资料,包括年龄、性别、既往史。治疗前进行神经功能状况评估,包括基线美国国立卫生研究院卒中量表(National Institutes of Health stroke scale,NIHSS)评分、基线格拉斯哥昏迷量表(Glasgow coma scale,GCS)评分。记录患者发病至股动脉穿刺时间、发病-血管再通时间、麻醉方式、是否桥接治疗、急性卒中Org10172治疗试验(trial of Org10172 in acute stroke treatment,TOAST)分型。
2. 影像学评估:根据治疗前头颅CT平扫检查结果,进行Alberta卒中项目早期CT评分(Alberta stroke program early computed tomograghy score,ASPECTS)。头颅CTA确定闭塞血管部位;RAPID软件得出脑血流量(cerebral blood flow,CBF)<30% 的脑组织体积(ml),即CBF<30%的脑组织区判定为核心梗死区[7]。
3. 疗效评价:根据术后即刻数字减影血管造影(digital subtraction angiography,DSA)判定血管再通情况,再通程度按mTICI分级评价,0级为闭塞血管未再通,1级为闭塞血管以远有少量前向血流但远端血管造影剂充盈缓慢,2a级为闭塞血管以远有前向血流但灌注面积小于正常的50%,2b级为闭塞血管以远有前向血流且灌注面积>50%但仍不完全,3 级为远端血管完全充盈显影且与正常一致;其中mTICI 分级2b、3级定义为血管成功再通。术后出血转化分型按欧洲协作急性卒中研究(European Cooperative Acute Stroke Study,ECASS)Ⅱ分型标准执行[8]。其中,术后72 h内影像学提示出血转化,且NIHSS评分较基线NIHSS评分增加≥4分,定义为症状性颅内出血(symptomatic intracranial hemorrhage,sICH)。
4. 随访与分组:治疗后3个月采用mRS评分评价临床预后,若血管成功再通且mRS 评分3~6分判定为无效再通组;反之,mRS评分≤2分为有效再通组。
采用SPSS 26.0软件包进行统计分析,计量资料符合正态分布以表示,组间比较采用t检验;不满足正态分布或方差不齐,以[M(Q1,Q3)]表示,组间比较采用Mann-Whitney U检验;计数资料以百分数或构成比表示,组间比较采用χ2检验。将单因素分析中P<0.05的变量纳入多因素logistic回归分析无效再通的影响因素。双侧检验,检验水准α=0.05。
本研究回顾性分析了共524例患者临床资料,如图1所示筛选流程最终368例符合入组标准的患者纳入研究,男228例,女140例,年龄为68(61,77)岁。有效再通的患者196例,无效再通的患者172例,即无效再通率为46.74%(172/368)。
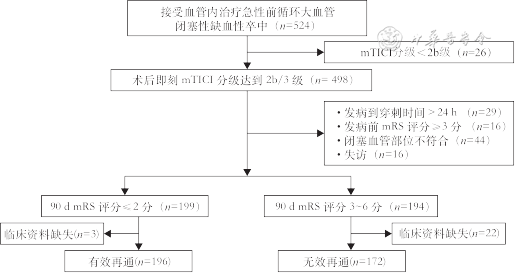

注:mTICI为改良脑梗死溶栓;mRS为改良Rankin量表
无效再通组的年龄71(65,79)岁、基线NIHSS评分18(14,22)分、高血压(69.19%)、房颤(48.26%)、既往卒中史(34.30%)、全麻手术(64.53%)占比及症状性出血发生率(13.37%)均高于有效再通组,基线GCS评分11(9,13)分和mTICI 3级占比(63.95%)低于有效再通组(均P<0.05);无效再通组发病到穿刺时间406(240,606)min、发病到再通时间485(309,669)min均晚于有效再通组(均P<0.05);同时,无效再通组与有效再通组患者在TOAST分型分布上差异有统计学意义(χ2=10.63,P<0.05);两组患者在性别、病前mRS评分、其他危险因素占比(糖尿病、高脂血症、冠心病、吸烟史、饮酒史)、桥接治疗方面的比较,差异无统计学意义(均P>0.05)(表1)。
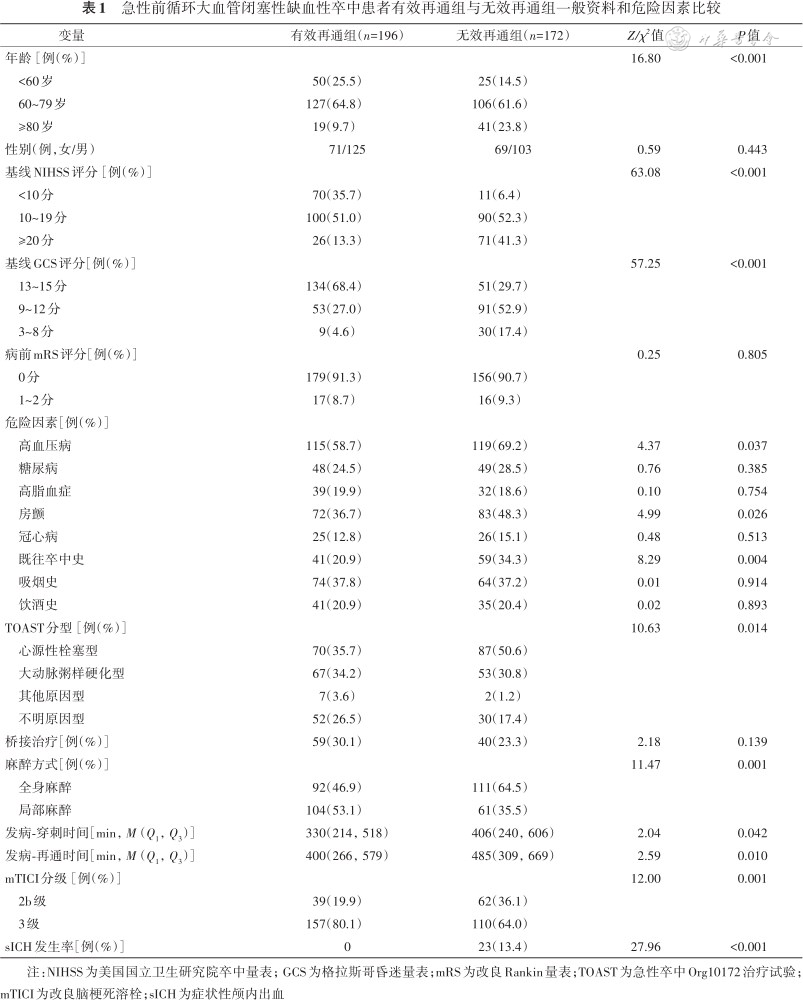
急性前循环大血管闭塞性缺血性卒中患者有效再通组与无效再通组一般资料和危险因素比较
急性前循环大血管闭塞性缺血性卒中患者有效再通组与无效再通组一般资料和危险因素比较
| 变量 | 有效再通组(n=196) | 无效再通组(n=172) | Z/χ2值 | P值 |
|---|---|---|---|---|
| 年龄[例(%)] | 16.80 | <0.001 | ||
| <60岁 | 50(25.5) | 25(14.5) | ||
| 60~79岁 | 127(64.8) | 106(61.6) | ||
| ≥80岁 | 19(9.7) | 41(23.8) | ||
| 性别(例,女/男) | 71/125 | 69/103 | 0.59 | 0.443 |
| 基线NIHSS评分[例(%)] | 63.08 | <0.001 | ||
| <10分 | 70(35.7) | 11(6.4) | ||
| 10~19分 | 100(51.0) | 90(52.3) | ||
| ≥20分 | 26(13.3) | 71(41.3) | ||
| 基线GCS评分[例(%)] | 57.25 | <0.001 | ||
| 13~15分 | 134(68.4) | 51(29.7) | ||
| 9~12分 | 53(27.0) | 91(52.9) | ||
| 3~8分 | 9(4.6) | 30(17.4) | ||
| 病前mRS评分[例(%)] | 0.25 | 0.805 | ||
| 0分 | 179(91.3) | 156(90.7) | ||
| 1~2分 | 17(8.7) | 16(9.3) | ||
| 危险因素[例(%)] | ||||
| 高血压病 | 115(58.7) | 119(69.2) | 4.37 | 0.037 |
| 糖尿病 | 48(24.5) | 49(28.5) | 0.76 | 0.385 |
| 高脂血症 | 39(19.9) | 32(18.6) | 0.10 | 0.754 |
| 房颤 | 72(36.7) | 83(48.3) | 4.99 | 0.026 |
| 冠心病 | 25(12.8) | 26(15.1) | 0.48 | 0.513 |
| 既往卒中史 | 41(20.9) | 59(34.3) | 8.29 | 0.004 |
| 吸烟史 | 74(37.8) | 64(37.2) | 0.01 | 0.914 |
| 饮酒史 | 41(20.9) | 35(20.4) | 0.02 | 0.893 |
| TOAST分型[例(%)] | 10.63 | 0.014 | ||
| 心源性栓塞型 | 70(35.7) | 87(50.6) | ||
| 大动脉粥样硬化型 | 67(34.2) | 53(30.8) | ||
| 其他原因型 | 7(3.6) | 2(1.2) | ||
| 不明原因型 | 52(26.5) | 30(17.4) | ||
| 桥接治疗[例(%)] | 59(30.1) | 40(23.3) | 2.18 | 0.139 |
| 麻醉方式[例(%)] | 11.47 | 0.001 | ||
| 全身麻醉 | 92(46.9) | 111(64.5) | ||
| 局部麻醉 | 104(53.1) | 61(35.5) | ||
| 发病-穿刺时间[min,M(Q1,Q3)] | 330(214,518) | 406(240,606) | 2.04 | 0.042 |
| 发病-再通时间[min,M(Q1,Q3)] | 400(266,579) | 485(309,669) | 2.59 | 0.010 |
| mTICI分级[例(%)] | 12.00 | 0.001 | ||
| 2b级 | 39(19.9) | 62(36.1) | ||
| 3级 | 157(80.1) | 110(64.0) | ||
| sICH发生率[例(%)] | 0 | 23(13.4) | 27.96 | <0.001 |
注:NIHSS为美国国立卫生研究院卒中量表;GCS为格拉斯哥昏迷量表;mRS为改良Rankin量表;TOAST为急性卒中Org10172治疗试验;mTICI为改良脑梗死溶栓;sICH为症状性颅内出血
有效再通组的基线ASPECTS为9(7,10)分,高于无效再通组的7(5,9)分(Z=5.89,P<0.05);有效再通组的核心梗死体积为6(0,17)ml,小于无效再通组的28(7,65)ml(Z=7.34,P<0.05);同时,有效再通组与无效再通组在闭塞血管构成比上差异有统计学意义(χ2=12.23,P<0.05);两组在串联病变方面比较差异无统计学意义(P>0.05)(表2)。
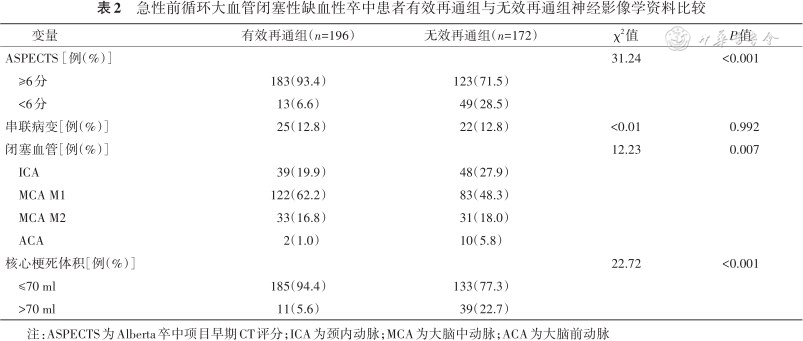
急性前循环大血管闭塞性缺血性卒中患者有效再通组与无效再通组神经影像学资料比较
急性前循环大血管闭塞性缺血性卒中患者有效再通组与无效再通组神经影像学资料比较
| 变量 | 有效再通组(n=196) | 无效再通组(n=172) | χ2值 | P值 |
|---|---|---|---|---|
| ASPECTS[例(%)] | 31.24 | <0.001 | ||
| ≥6分 | 183(93.4) | 123(71.5) | ||
| <6分 | 13(6.6) | 49(28.5) | ||
| 串联病变[例(%)] | 25(12.8) | 22(12.8) | <0.01 | 0.992 |
| 闭塞血管[例(%)] | 12.23 | 0.007 | ||
| ICA | 39(19.9) | 48(27.9) | ||
| MCA M1 | 122(62.2) | 83(48.3) | ||
| MCA M2 | 33(16.8) | 31(18.0) | ||
| ACA | 2(1.0) | 10(5.8) | ||
| 核心梗死体积[例(%)] | 22.72 | <0.001 | ||
| ≤70 ml | 185(94.4) | 133(77.3) | ||
| >70 ml | 11(5.6) | 39(22.7) |
注:ASPECTS为Alberta卒中项目早期CT评分;ICA为颈内动脉;MCA为大脑中动脉;ACA为大脑前动脉
多因素 logistic 回归模型分析显示,年龄≥80岁,基线NIHSS评分≥20分,GCS评分≤8分,既往有卒中史,全身麻醉,未达3级再通,ASPECTS<6分,核心梗死体积>70 ml为急性前循环大血管闭塞性缺血性卒中血管内治疗预后不良无效再通的危险因素(表3)。
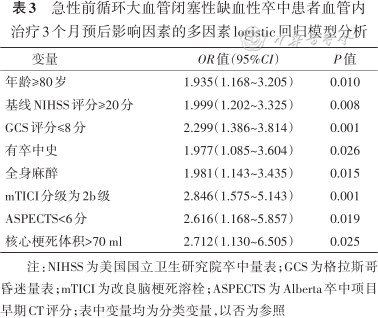
急性前循环大血管闭塞性缺血性卒中患者血管内治疗3个月预后影响因素的多因素logistic回归模型分析
急性前循环大血管闭塞性缺血性卒中患者血管内治疗3个月预后影响因素的多因素logistic回归模型分析
| 变量 | OR值(95%CI) | P值 |
|---|---|---|
| 年龄≥80岁 | 1.935(1.168~3.205) | 0.010 |
| 基线NIHSS评分≥20分 | 1.999(1.202~3.325) | 0.008 |
| GCS评分≤8分 | 2.299(1.386~3.814) | 0.001 |
| 有卒中史 | 1.977(1.085~3.604) | 0.026 |
| 全身麻醉 | 1.981(1.143~3.435) | 0.015 |
| mTICI分级为2b级 | 2.846(1.575~5.143) | 0.001 |
| ASPECTS<6分 | 2.616(1.168~5.857) | 0.019 |
| 核心梗死体积>70 ml | 2.712(1.130~6.505) | 0.025 |
注:NIHSS为美国国立卫生研究院卒中量表;GCS为格拉斯哥昏迷量表;mTICI为改良脑梗死溶栓;ASPECTS为Alberta卒中项目早期CT评分;表中变量均为分类变量,以否为参照
血管内治疗是目前AIS-LVO的首选治疗手段,通过恢复脑血流灌注,可以提高患者的临床预后。但血管再通并非都能获得良好临床结局,本研究结果显示仍有46.74%为无效再通。因此,筛选合适的患者对疗效优劣至关重要。研究分析发现年龄≥80岁、基线NIHSS评分≥20分、GCS评分≤8分、既往卒中病史、接受全麻、未达到3级再通、ASPECTS评分<6分、核心梗死体积>70 ml为无效再通的影响因素。
年龄和NIHSS评分是影响血管内治疗临床结局的最主要因素。相应地,两种因素势必会成为无效再通的关键因素。与药物治疗相比,血管内治疗能够显著改善50岁以上各年龄段患者的临床预后。但值得注意的是,随着患者年龄的增加,总体预后率呈显著下降趋势,尤其是>80岁的高龄患者临床结局并不理想,良好预后率仅为25.4%~44.1%[5,10]。本研究单因素分析中,无效再通组平均年龄显著高于有效再通组,其中无效再通组>80岁的高龄患者是有效再通组的2倍。而对于高龄患者来说,往往基础疾病多、围手术期发生并发症风险大,血管扭曲或狭窄病变多见[11]导致再通困难等情况。这些均可能成为患者预后不良的因素,也增加了无效再通的可能性。NIHSS评分是最广泛的用于评价卒中严重程度的指标。血管内治疗有益效应随着NIHSS评分增加呈显著下降趋势[12]。在重度卒中患者(NIHSS≥21分)中,即使在24 h内经治疗后NIHSS下降一个等级(10分),患者总体良好预后仍要差于基线NIHSS评分<10分的患者[13]。本研究中无效再通组基线NIHSS评分显著增高,≥20分占比是有效再通组3倍多。随着NIHSS评分增加,无效再通的风险势必增加。
本研究发现未到达mTICI 分级3级再通同样是无效再通的危险因素。研究已证实成功再灌注是血管内治疗取得良好预后的前提。同时,血管再通等级与临床预后密切相关。LeCouffe等[14]研究发现90 d功能预后与再灌注分级之间总体呈正相关,再灌注分级的增加,病死率和sICH的风险降低,而功能独立性逐步提高。当前多数临床研究,一般使用mTICI或者扩展TICI(eTICI)评价再灌注等级,但不管是采用何种分级评分均以达到2b级以上再通作为成功再灌注的评判标准。然而,越来越多的证据表明mTICI/eTICI分级 3级是改善功能预后的最佳血管造影预测指标。在一项纳入40项研究,共涉及8 691例患者的荟萃分析显示,mTICI/eTICI 分级3级再通的良好功能结局率最高,其次分别是eTICI分级 2c级和eTICI 分级2b级再通,其中,eTICI 分级2c级或mTICI/eTICI 分级3级患者的良好功能结局率相似[15]。因此,实现完全或者接近完全再灌注(eTICI 分级2c/3级)是血管内治疗技术所要达到的目标。
核心梗死范围和大小与患者临床预后的密切相关[16, 17]。其中,ASPECTS对临床预后具有很强的预测能力,评分越低,预后不良的可能越大,尤其是ASPECTS<6分。本研究中,ASPECTS<6分发生无效再通的风险显著增加。此外,本研究借助自动化软件对核心梗死体积进行了分析,并借鉴EXTEND-IA等研究,以核心梗死体积70 ml为界[18],发现核心梗死体积>70 ml的患者无效再通风险更高。但核心梗死体积对预后的界定值尚无定论。近期发表的ANGEL-ASPECT[19]、RESCUE-Japan LIMIT[20]、SELECT2[21]等研究结果表明对低ASPECTS和较大核心梗死体积患者选择血管内治疗的临床结局仍要优于药物治疗。这提示虽然无效再通发生风险更高,但在临床实践中,这部分患者可能仍应积极采取血管内治疗。
此外,研究发现既往卒中史和全身麻醉也是无效再通的危险因素。既往的研究也显示有卒中史的患者无效再通风险更高,这可能与既往卒中遗留神经功能依赖、高龄以及靶血管再通率降低有关[22]。关于血管内治疗麻醉方式选择仍无定论,但从既往以及本研究中均展现出接受全身麻醉可能显著增加无效再通风险,分析其原因可能与成功再通时间延长、麻醉本身会对呼吸循环产生影响,且施行全身麻醉的患者往往临床症状更重,这些可导致再灌注损伤及并发症的风险增高。为此,加强围术期麻醉管理、呼吸循环功能支持,可能是降低全身麻醉较高无效再通风险的可行临床实践方向。
本研究仍然存在一定的局限性。首先,这是一项单中心回顾性研究,病例选择存在一定的偏倚。其次,样本量偏小,无法得出完备的具有因果性的结论,需要更多前瞻性大样本研究来验证。
杨洁, 沈芳, 呼延梅华, 等. 急性大血管闭塞性缺血性卒中血管内治疗无效再通的影响因素分析[J]. 中华医学杂志, 2023, 103(29): 2218-2224. DOI: 10.3760/cma.j.cn112137-20230218-00231.
所有作者声明不存在利益冲突



























