
难治性溃疡在消化内科并不少见,明确病因是成功治疗的关键。报告1例以难治性胃巨大溃疡伴反复出血、高热、严重营养不良为主要临床表现,既往有结核性胸膜炎和自身免疫性角膜炎病史,经多学科协作和外科手术确诊为巨细胞病毒胃炎并最终治愈的罕见病例。通过分析难治性胃溃疡的诊治思路和巨细胞病毒胃炎的临床特点,为临床诊疗提供参考。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
难治性胃溃疡指溃疡最大径>5 mm且经质子泵抑制剂(proton pump inhibitor,PPI)治疗8~12周仍未愈合或伴有并发症的胃溃疡[1],其鉴别诊断较复杂,明确病因是成功治疗的关键。现报告1例表现为胃巨大溃疡伴反复出血和高热,经充分筛查胃溃疡的常见病因、多次内镜活体组织检查(以下简称活检)后仍难以明确诊断,应用足量PPI治疗无效,最终依靠手术病理确诊为巨细胞病毒胃炎的病例,旨在提高临床对该病的认识。
患者女,42岁,主诉"胸腔积液1年余,上腹痛半年",于2022年2月10日被北京协和医院消化内科收治入院。患者曾于2020年5月健康体检时发现双侧胸腔积液,以右侧为著,自觉无不适,未治疗。2021年6月出现中上腹痛,多于进食后出现,伴反酸、呕吐胃内容物,否认发热、黑便、便血。2021年8月13日外院胃镜检查见胃角小弯侧长径约2 cm的溃疡(A1期);幽门螺杆菌快速尿素酶试验结果呈阴性;活检病理示胃黏膜重度慢性炎伴糜烂,肉芽组织形成;胸部计算机断层扫描(computed tomography,CT)检查示左肺尖纤维条索、右中叶部分肺不张,双肺多发小结节灶,纵隔和肺门多发淋巴结钙化,右侧胸腔积液较2020年5月时增加;胸腔积液检验结果显示,单核细胞占93.4%,腺苷脱氨酶(adenosine deaminase,ADA)为80.9 U/L,结核分枝杆菌DNA检测结果呈阴性,未见肿瘤细胞。外院诊断为陈旧性肺结核、结核性胸膜炎、胃溃疡,患者拒绝抗结核治疗,仅口服雷贝拉唑和硫糖铝,治疗8周后腹痛无缓解。2021年10月9日复查胃镜,结果示胃角小弯侧溃疡长径约4 cm,较2021年8月时进展,新见胃窦体交界前壁长径为1 cm的溃疡;活检病理示黏膜上皮糜烂伴再生性改变,较多淋巴细胞和浆细胞浸润,部分胃窦黏膜血管管壁增厚,管腔闭塞,腔内可见炎症细胞聚集。2021年10月,外院予异烟肼、吡嗪酰胺、乙胺丁醇、利福喷丁行抗结核治疗,患者用药后出现高热(体温为39 ℃),伴寒战、盗汗,加用泼尼松(口服,25 mg/次、1次/d)后热退,盗汗好转,遂将泼尼松规律减量至10 mg/次、1次/d进行维持治疗。2022年1至2月患者体温正常,复查胸腔积液完全吸收,但腹痛加重。2022年1月10日胃镜检查示胃角、胃窦可见大小分别为6 cm×8 cm、2 cm×2 cm的活动性溃疡;活检病理示胃黏膜中度慢性炎,另见炎性坏死和肉芽组织形成;幽门螺杆菌快速尿素酶试验结果呈阴性。为进一步诊治,患者于2022年2月10日被收治于北京协和医院消化内科。患者否认病程中出现口腔和外阴溃疡,否认光过敏、关节炎、皮疹,起病以来食欲差,入院前半年内体重减轻13 kg。既往史:曾于2019年起因眼红、畏光、视力下降确诊自身免疫性角膜炎,予泼尼松龙滴眼液治疗后好转。用药史:否认非甾体抗炎药服用史。家族史:患者父亲因肝癌去世,余无特殊。
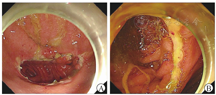
患者入院体格检查示体温为36.7 ℃,血压为110/75 mmHg(1 mmHg=0.133 kPa),脉率为85次/min,体重指数为14.3 kg/m2(身高为1.63 m,体重为38 kg),消瘦,慢性病容。双肺呼吸音较弱,腹韧,上腹部深压痛,无反跳痛、肌紧张。肝脾肋下未及,未及腹部包块。肠鸣音为2~3次/min。双下肢无水肿。血常规检查示白细胞计数为5.07×109/L,血红蛋白为108 g/L,血小板计数为309×109/L,粪便隐血试验阳性,肝、肾功能无异常,超敏C反应蛋白(hypersensitive C-reactive protein,hsCRP)为18.00 mg/L,红细胞沉降率为41 mm/1 h,铁蛋白为82 ng/mL,凝血功能无异常。结核菌素试验、结核感染特异性T细胞检测结果均呈阴性。外周血巨细胞病毒和EB病毒DNA、巨细胞病毒免疫球蛋白M、巨细胞病毒抗原血症检测结果均呈阴性。外周血需氧菌、厌氧菌、结核分枝杆菌、真菌培养和痰液病原学培养结果均呈阴性;胃黏膜活检组织结核分枝杆菌DNA检测(聚合酶链反应法)结果呈阴性。胸腔积液检验示白细胞计数为880×106/L,单核细胞占94.8%,ADA为60.2 U/L,结核感染特异性T细胞检测阳性[以每1×106个单个核细胞(mononuclear cell,MC)中斑点形成细胞(spot forming cell,SFC)的数目计,为64 SFC/(1×106MC)],细菌和真菌培养结果均呈阴性。抗核抗体谱、抗中性粒细胞胞质抗体、针刺试验结果均呈阴性。糖类抗原125为56.9 U/mL,胃泌素为127 pg/mL(未停用PPI),血清和尿免疫固定电泳检查均未见异常,在胸腔积液中未找到肿瘤细胞。腹盆部增强CT检查示胃体和胃底部黏膜面不规则伴黏膜面异常强化。2022年2月11日复查胃镜,于胃角见巨大溃疡,横贯胃角,延伸至幽门口,溃疡表面薄白苔,窦体交界前壁另可见2处长径为5~10 mm、与胃角溃疡外形特点相似的溃疡(图1);幽门螺杆菌快速尿素酶试验结果呈阴性;活检病理示胃黏膜中度慢性炎和轻度活动性炎,局部腺体增生,高倍视野下未见异常形态;免疫组织化学检查示巨细胞病毒阴性;特殊染色检查示抗酸染色未见抗酸杆菌,弱抗酸染色阴性;原位杂交技术检查示EB病毒编码的小RNA原位杂交(Epstein-Barr virus encoded small RNA-in situ hybridization,EBER-ISH)阴性。为除外淋巴瘤,2022年2月28日先后行超声内镜细针穿刺及胃镜下深挖和黏膜圈套活检,仍可见胃角、窦体交接前壁处巨大溃疡,溃疡形态、大小与2022年2月11日胃镜检查所见大致相同(图2);病理示(胃角)炎性渗出物和肉芽组织;免疫组织化学检查示CD10(部分阳性),Bcl-6阳性,CD2(T细胞)、CD3(T细胞)、CD20(B细胞)、CD4(T细胞)、CD5(T细胞)、CD7(T细胞)、CD8(T细胞)均阳性,Mum-1阳性,CD30(Ki-1)、CD56、巨细胞病毒均阴性,Ki-67指数为70%; EBER-ISH阴性。完善18F-氟代脱氧葡萄糖、正电子发射计算机断层显像检查见甲状腺左叶2个代谢增高的低密度结节,最大标准摄取值(maximum standard uptake value,SUVmax)为25.6;胃体大、小弯侧局部胃壁略增厚伴代谢增高(SUVmax为7.3);胃小弯侧、腹膜后多发代谢轻度增高淋巴结;右肺上叶代谢增高微结节,右肺中叶代谢增高结节、实变影(SUVmax为9.4)。甲状腺左叶代谢增高结节经超声穿刺活检确诊为甲状腺乳头状癌。
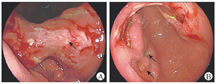


初步诊断为胃巨大溃疡性质待定,上消化道出血;结核性胸膜炎;重度营养不良,低白蛋白血症,重度贫血;甲状腺乳头状癌。最终诊断为巨细胞病毒胃炎,继发性血管炎,上消化道出血,腹腔镜下远端胃次全切除术(胃-空肠Roux-en-Y吻合)后,吻合口溃疡;结核性胸膜炎;重度营养不良,低白蛋白血症,重度贫血;甲状腺乳头状癌。
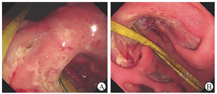
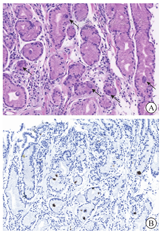
患者入院后反复上腹痛伴高热,最高体温为39.8 ℃,hsCRP升至114.53 mg/L,消耗症状明显,故置入空肠营养管进行鼻饲。为除外药物热停用抗结核药物3 d,患者最高体温未下降。2022年3月9日起反复呕血,血红蛋白最低为46 g/L,伴失血性休克,分别于3月10、12和23日行胃镜下止血治疗。提请病理科、呼吸内科、感染内科、风湿免疫科进行多学科讨论。关于胸腔积液,感染内科和呼吸内科考虑结核性胸膜炎诊断成立,但不能解释胃溃疡和患者全身表现,又因患者胃肠道耐受差,故于2022年3月11日起予抗结核药物静脉给药治疗,具体方案为异烟肼0.4 g/次、1次/d,左氧氟沙星0.5 g/次、1次/d,阿米卡星0.4 g/次、1次/d,利奈唑胺0.6 g/次、1次/d 。在胃溃疡治疗方面,因多次活检均无淋巴瘤和感染性疾病证据,而2021年10月9日外院胃镜活检见胃角小血管壁增厚、管腔狭窄,存在血管炎的表现,加之既往有自身免疫性角膜炎病史,风湿免疫科考虑胃溃疡为血管炎所致可能,不除外继发于结核感染。2022年3月11日起给予甲泼尼龙40 mg/次、1次/d静脉滴注,此后患者体温正常,腹痛缓解。2022年4月26日复查hsCRP降至15.00 mg/L,同日复查胃镜示胃角巨大溃疡较治疗前(2022年2月11日和28日)稍变浅;胃窦前壁、大弯、后壁侧仍可见散在溃疡(图3)。2022年4月28日将抗结核药物(异烟肼、利福平、左氧氟沙星、乙胺丁醇)调整为口服剂型。治疗1周后,患者再次出现发热(最高体温为39.2 ℃)、腹痛,hsCRP升至57.00 mg/L,血红蛋白由85 g/L降至62 g/L。患者在规范抗结核和抗血管炎治疗近2个月后疗效不理想,经消化内科、感染内科、风湿免疫科和基本外科多学科会诊,考虑有手术指征,遂于2022年5月10日行腹腔镜下远端胃次全切除+胃-空肠Roux-en-Y吻合术。术中见胃体部与腹壁致密粘连,该处胃壁组织菲薄,游离后见长径约为5 cm的胃壁缺损,符合慢性穿透性溃疡。手术标本高通量二代测序(next generation sequencing,NGS):巨细胞病毒种特异性序列数为19,相对丰度为63.4%。术后标本病理学检查示胃黏膜慢性炎,多灶淋巴细胞聚集,可见溃疡形成,部分穿透肌层,胃壁散在炎症细胞浸润,神经纤维增生,系膜及胃壁内小动脉内膜增厚,部分管腔狭窄,巨细胞病毒染色阳性(图4),病变不除外感染和缺血损伤;两侧断端未见特殊,淋巴结慢性炎;特殊染色检查示抗酸染色未见抗酸杆菌,弱抗酸染色阴性;原位杂交技术检查示EBER-ISH阴性。结合手术标本病原和病理学检查结果,修正诊断为巨细胞病毒胃炎。2022年5月13日起予更昔洛韦200 mg/次、1次/12 h静脉输注抗巨细胞病毒治疗。同时因胸腔积液明显改善,且抗结核治疗已满半年,停用抗结核药物。
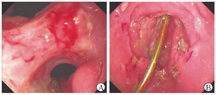


术后第10天患者突发便血,血红蛋白降至61 g/L,5月23日复查胃镜和胶囊内镜均见胃-空肠吻合口、空肠-空肠吻合口局部浅溃疡,其余残胃和小肠黏膜均未见异常(图5)。结合手术病理所见的血管炎征象,考虑术后吻合口溃疡为巨细胞病毒感染继发缺血所致可能性大,在积极抗巨细胞病毒感染的基础上继续应用甲泼尼龙(静脉滴注,20 mg/次、1次/d),并予抑酸、保护胃黏膜等对症治疗。患者便血停止,逐渐恢复经口进食,改用口服剂型的糖皮质激素。2022年6月5日复查血红蛋白为91 g/L,粪便隐血试验阴性,hsCRP降至7.5 mg/L,于6月7日出院。出院后予更昔洛韦(口服,1 g/次、3次/d,至2022年7月26日停药,抗巨细胞病毒总疗程约为10周)和泼尼松(口服,20 mg/次、1次/d,2个月后规律减停)维持治疗。2022年8月23日门诊随诊,患者一般情况明显改善,食欲和体力恢复,体重指数增高至19.6 kg/m2。2022年12月6日随诊,患者体重指数恢复至21.8 kg/m2,停用所有药物并恢复正常生活和工作。

消化内科冯云路副主任医师:该例患者表现为难治性胃巨大溃疡伴全身炎症反应和消耗症状,反复大出血。难治性胃溃疡病因需考虑特殊感染、肿瘤、免疫性疾病、持续幽门螺杆菌感染、药物(如非甾体抗炎药或糖皮质激素)和严重共患疾病等,应与以下疾病进行鉴别诊断。①感染:患者有陈旧性肺结核和结核性胸膜炎,需考虑胃结核的可能性,但胃结核较为罕见,且本例抗结核治疗对胃溃疡无效,可以排除;需考虑其他病原体包括巨细胞病毒、EB病毒和非结核分枝杆菌感染等,但外周血和组织标本病原学检测均无阳性发现。②肿瘤:患者高热、盗汗,体重下降明显,胃溃疡形态不规则,需警惕淋巴瘤,但多次活检及穿刺结果均呈阴性,尚缺少诊断依据。③免疫性疾病:克罗恩病、系统性血管炎等也可导致上消化道溃疡,但克罗恩病表现为孤立性胃溃疡相对少见[2];贝赫切特综合征多表现为单个、深大溃疡,周围可见火山口样隆起,溃疡底部较平整,该例患者的胃溃疡表现与贝赫切特综合征有相似点,但其他临床表现不支持。该例患者的胃溃疡不能排除由血管炎所致,支持点包括内镜活检病理、自身免疫性角膜炎病史、溃疡形态特征等,但患者在规范糖皮质激素治疗后病情无明显改善,溃疡愈合困难,故果断进行手术治疗。手术组织NGS和病理免疫组织化学结果均支持巨细胞病毒感染,至此巨细胞病毒胃炎得到确诊。患者在术后积极抗巨细胞病毒感染治疗2周后发现吻合口溃疡,结合手术病理中所见的血管炎特征,考虑为巨细胞病毒感染所致的血管炎引起胃黏膜缺血,因此,需要维持抗巨细胞病毒感染和抗血管炎治疗"双管齐下",同时营养支持治疗也很关键[3]。
呼吸与危重症医学科留永健副主任医师:该例患者表现为反复胸腔积液,性质为渗出液,多次病原学检查结果呈阴性,胸腔积液单核细胞占比>90%,ADA升高达60 U/L以上。此外2021年外院胸部CT检查提示左肺尖纤维条索、右肺中叶部分肺不张,双肺多发小结节灶,纵隔和肺门多发淋巴结钙化,高度提示结核。虽然胸腔积液或痰诱导病原培养未见结核分枝杆菌,但结合上述检查结果、我国结核高发的背景和抗结核治疗有效,临床可以诊断肺结核、结核性胸膜炎,但肺部病变难以解释胃溃疡。
感染内科曹玮副主任医师:同意结核性胸膜炎的诊断。结核感染继发免疫炎症现象并不少见,患者可出现感染灶以外的皮肤、关节、血管或眼部受累,且受累部位结核菌检测阴性,应是结核相关性免疫损伤所致。该例患者既往确诊自身免疫性角膜炎,存在免疫系统异常激活的易患因素。胃溃疡在糖皮质激素和环磷酰胺治疗1个多月后有一定的愈合趋势,而此前经近半年的抗结核治疗病情却一直进展,故考虑胃溃疡并非结核感染本身所致,而是由于免疫介导改变。患者胃溃疡合并高热和全身炎症反应,抗血管炎治疗有利于胃溃疡愈合,提示胃溃疡形成与免疫系统过度激活有关。在抗结核和抗炎治疗后病情反复,最终通过手术病理确诊巨细胞病毒胃炎,抗巨细胞病毒治疗后病情最终得以改善。文献报告胃肠道巨细胞病毒感染可继发黏膜血管内皮损伤和缺血,从而加重胃溃疡[3,4]。本例患者在已切除胃溃疡病灶、积极抗巨细胞病毒治疗的情况下仍出现了吻合口溃疡、消化道出血,且在加用糖皮质激素后出血停止,回顾整个临床演变过程和治疗反应,支持巨细胞病毒感染继发血管炎。
病理科周炜洵主任医师:该例患者的多次胃镜活检结果均未见特殊感染和淋巴瘤的证据,但2021年10月9日外院胃镜活检病理见胃角部位小血管管壁增厚、管腔狭窄,有血管受损,需考虑继发性血管炎。北京协和医院2022年2月11日胃镜活检病理提示黏膜炎症伴反应性增生,高倍视野下未见异常形态细胞;巨细胞病毒、EB病毒及结核检查均无阳性发现。2022年2月28日行深挖活检仍无淋巴瘤证据,可以排除淋巴瘤。2022年5月10日远端胃次全切除手术标本的免疫组织化学染色提示巨细胞病毒阳性,支持巨细胞病毒感染,此外可见系膜及胃壁内小动脉内膜增厚,部分管腔狭窄,为血管受损表现。综上,该病例的表现符合巨细胞病毒胃炎继发血管炎。
风湿免疫科沈敏主任医师:该例患者最终确诊巨细胞病毒胃炎,病理检查曾发现血管炎征象,且在本次起病前的1年余患有自身免疫性角膜炎,在常规抗感染疗效欠佳时需怀疑继发性血管炎。2012年Chapel Hill血管炎分类标准[5]提出,除传统意义上经典的原发性血管炎外,还包括与其他疾病相关的继发性血管炎,其中感染是继发性血管炎最常见的原因。该例患者需重点考虑与感染相关的血管炎。很多病原体都可引发血管炎,其主要机制可分为直接和间接作用两类[6]。直接作用包括病原体直接侵犯和破坏血管壁,从而导致炎症反应,包括巨细胞病毒、葡萄球菌属、链球菌属、沙门菌属、密螺旋体属、立克次体属、单纯疱疹病毒1型和2型等病原体;间接作用指病灶内并无病原体,因结核分枝杆菌、麻风分枝杆菌、乙型肝炎病毒、人类免疫缺陷病毒等病原体所诱发的炎症反应而造成血管损伤,其发病机制可能是病原体与宿主共享抗原表位或修饰自身抗原,导致免疫系统的交叉反应。该例患者的胃溃疡形态特点与血管炎的胃肠道受累相似、有感染性疾病基础、病理提示血管炎样改变、单纯抗巨细胞病毒疗效欠佳,可以诊断为与巨细胞病毒感染相关的继发性血管炎。
基本外科徐徕副主任医师:该例患者在积极抗结核和抗血管炎治疗后溃疡愈合不理想,仍有反复出血,且具有手术指征。通过手术切除病灶,不仅可避免溃疡加重导致出血甚至穿孔,还能获取组织病理进行明确诊断。患者最初营养状况极差、手术风险高,经鼻饲进行肠内营养治疗后,全身状态有所改善,依赖多学科协作在围手术期进行的合理处置,从而明确诊断并改善了患者预后。
消化内科吴东主任医师:该例患者病情迁延、危重,诊疗经过复杂,经多学科协作最终确诊为巨细胞病毒胃炎继发血管炎,预后较好。该病例对临床诊疗有诸多提示作用:①巨细胞病毒胃炎诊断的金标准是组织病理检查结果,外周血巨细胞病毒相关病原学检验结果呈阴性不能排除本病;②单纯依靠常规内镜活检确诊巨细胞病毒胃炎有一定困难,若溃疡顽固且反复出血,应及时选择外科手术治疗以控制出血并确诊;③对于疑难病例应优先考虑"一元论",但不应放弃特定条件下的"二元论",该例患者结核性胸膜炎与巨细胞病毒胃炎并存,就是"二元论"的佐证;④感染性疾病与自身免疫病并无截然分界,前者可以成为后者的诱因,而后者则增大了感染性疾病的治疗难度,有时需抗感染与抗炎治疗并行,方能收效。
巨细胞病毒为机会性感染病原体,免疫功能正常者多表现为潜伏感染,而在免疫抑制状态时巨细胞病毒潜伏感染可被激活并致病。巨细胞病毒感染累及胃肠道并不少见,其中巨细胞病毒胃炎好发于免疫抑制患者,而罕见于免疫功能正常人群[7]。巨细胞病毒损伤血管内皮细胞,以及宿主对巨细胞病毒的免疫反应这两种机制均可导致胃壁血管损伤,进而引起胃黏膜缺血和溃疡形成,并伴有局部或全身炎症反应[4],严重者可引发胃穿孔、出血、幽门梗阻等并发症[8]。
巨细胞病毒胃炎的内镜表现缺乏特异性,黏膜损伤形态多变。Chen等[9]回顾了北京协和医院2007至2017年的6例巨细胞病毒胃炎患者资料,其中5例患者合并胃溃疡,包括多发溃疡4例和多发糜烂1例;溃疡呈不规则或椭圆形,长径为0.5~1.5 cm,所有患者均有胃窦受累表现。巨细胞病毒胃炎的诊断有赖于病变部位的组织病理学,苏木精-伊红染色见细胞核内巨细胞病毒包涵体或免疫组织化学染色阳性对于诊断的特异性高[10]。巨细胞病毒的血清学检测并不能作为确诊或排除巨细胞病毒胃炎的可靠依据,北京协和医院所报道的6例巨细胞病毒胃炎患者中仅有1例巨细胞病毒免疫球蛋白M阳性和2例血巨细胞病毒DNA拷贝数升高。
本例患者多次巨细胞病毒血清学检测、内镜活检结果均呈阴性,最终通过手术才得以确诊,可见巨细胞病毒胃炎诊断难度较大。因此,对于不明原因的难治性胃溃疡,即使外周血巨细胞病毒相关检测结果呈阴性,也需考虑巨细胞病毒胃炎的可能。
中文:周青杨,阮戈冲,宋锴,等.以难治性胃巨大溃疡伴反复出血为表现的巨细胞病毒胃炎[J].中华消化杂志,2023,43(6): 411-415. DOI: 10.3760/cma.j.cn311367-20230209-00055. 英文:Zhou QY, Ruan GC, Song K, et al. Cytomegalovirus gastritis characterized by refractory giant gastric ulcer with recurrent bleeding[J]. Chin J Dig,2023,43(6): 411-415. DOI: 10.3760/cma.j.cn311367-20230209-00055.
所有作者声明不存在利益冲突



























