
报道1例以肝功能异常及血红蛋白升高起病,最终诊断肾囊肿和糖尿病综合征的病例。患者诊治过程曲折,期间经历了多家医院就诊、3次肝穿刺组织学检查,但病因一直未能明确。最终,通过基因检测等检查确诊。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者男,29岁,未婚,身高165 cm,体质量55 kg,体质量指数20.2 kg/m2。因"发现肝功异常、血红蛋白升高10年余"于2021年6月8日入本院肝病中心一科。患者10年余前体检发现肝功能异常伴血红蛋白升高,辗转多家医院检测,行相应检测(表1)未明确诊断。既往发现血糖升高2年,口服阿卡波糖治疗。否认饮酒病史,否认家族中有类似病史患者。查体:体温35.6℃,血压135/83 mmHg(1 mmHg = 0.133 3 kPa),呼吸20次/min,神志清楚,皮肤巩膜无黄染,心肺未见异常,腹软,肝脾未扪及,双下肢无水肿。实验室检查:碱性磷酸酶187 U/L,γ-谷氨酰转移酶226 U/L,其余肝、肾功能指标基本正常;B超提示不均质性脂肪肝,CT提示胰腺发育缺陷,胰体、胰尾缺失,双肾多发囊肿(图1)。近10年肝功能和辅助检查结果见表1。患者于2010年、2015年及2021年3次肝活检结果除提示肝脏脂肪变外无其他异常(图2)。基因检测提示HNF1B基因exon 1-9杂合缺失(图3)。最终诊断肾囊肿和糖尿病综合征。随后对其父母及姐姐的基因检测未见基因突变(图4)。
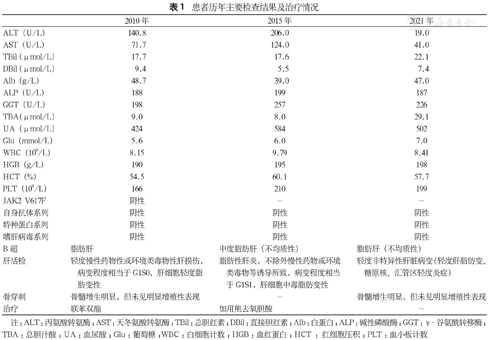
患者历年主要检查结果及治疗情况
患者历年主要检查结果及治疗情况
| 2010年 | 2015年 | 2021年 | |
|---|---|---|---|
| ALT(U/L) | 140.8 | 206.0 | 19.0 |
| AST(U/L) | 71.7 | 124.0 | 41.0 |
| TBil(μmol/L) | 17.7 | 17.6 | 22.1 |
| DBil(μmol/L) | 9.4 | 5.5 | 7.4 |
| Alb(g/L) | 48.7 | 39.0 | 47.0 |
| ALP(U/L) | 188 | 199 | 187 |
| GGT(U/L) | 198 | 257 | 226 |
| TBA(μmol/L) | 9.0 | 8.0 | 29.1 |
| UA(μmol/L) | 424 | 584 | 502 |
| Glu(mmol/L) | 5.6 | 6.0 | 7.0 |
| WBC(109/L) | 8.15 | 9.79 | 8.41 |
| HGB(g/L) | 190 | 195 | 198 |
| HCT(%) | 54.5 | 60.1 | 57.7 |
| PLT(109/L) | 166 | 210 | 199 |
| JAK2 V617F | 阴性 | - | - |
| 自身抗体系列 | 阴性 | 阴性 | 阴性 |
| 特种蛋白系列 | 阴性 | 阴性 | 阴性 |
| 嗜肝病毒系列 | 阴性 | 阴性 | 阴性 |
| B超 | 脂肪肝 | 中度脂肪肝(不均质性) | 脂肪肝(不均质性) |
| 肝活检 | 轻度慢性药物性或环境类毒物性肝损伤,病变程度相当于G1S0,肝细胞轻度脂肪变性 | 脂肪性肝炎,不除外慢性药物或环境类毒物等诱导所致,病变程度相当于G1S1,肝细胞中毒脂肪变性 | 轻度非特异性肝脏病变(轻度肝脂肪变、糖原核、汇管区轻度炎症) |
| 骨穿刺 | 骨髓增生明显,但未见明显增殖性表现 | - | 骨髓增生明显,但未见明显增殖性表现 |
| 治疗 | 联苯双酯 | 加用熊去氧胆酸 | - |
注:ALT:丙氨酸转氨酶;AST:天冬氨酸转氨酶;TBil:总胆红素;DBil:直接胆红素;Alb:白蛋白;ALP:碱性磷酸酶;GGT:γ-谷氨酰转移酶;TBA:总胆汁酸;UA:血尿酸;Glu:葡萄糖;WBC:白细胞计数;HGB:血红蛋白;HCT :红细胞压积;PLT:血小板计数
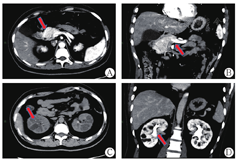

注:图中箭头所示胰腺发育缺陷,胰体、胰尾缺失,双肾多发囊肿
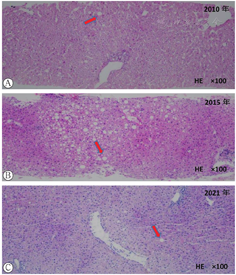

注:箭头提示肝脏脂肪变
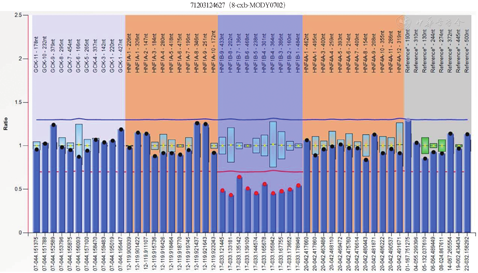

注:基因检测提示HNF1B基因exon 1-9杂合缺失(箭头示)

注:基因检测提示HNF1B基因exon 1-9无杂合缺失(箭头示)
HNF1B基因表达的蛋白质称为肝细胞核因子-1β(HNF-1β)蛋白,其存在于包括肺、肝、肠、胰腺、肾、生殖道和泌尿道等许多器官和组织中,在生长发育过程中起重要作用。HNF-1β蛋白不仅参与肝脏和胆道系统的转录和功能调节,还参与肾脏、泌尿生殖道和胰腺β细胞的转录和功能调节。在HNF-1β肾病中观察到的肾小管异常包括高尿酸血症伴或不伴痛风、低钾血症、低镁血症和多尿[1]。
青少年起病的成人糖尿病(MODY)是一种常染色体显性遗传病,异常高血糖是其疾病特征,目前已发现了13种亚型。HNF1B基因是MODY5亚型的致病基因(也称为HNF1B-MODY或MODY5),占MODY患者数的2%~5%。MODY5最常见的临床表型为肾脏发育异常和早发糖尿病,常在30岁以前发病,也称为肾囊肿和糖尿病(RCAD)综合征。RCAD患者的肾脏异常主要表现为囊肿,也可能有胰腺畸形,肝功能异常或尿酸升高等表现。虽然此病逐渐被人们认识,但仍有38%的患者最初被误诊为2型糖尿病[2]。在日本的一项回顾性分析中,在33例患者中绝大多数病例有肾、泌尿道形态异常,38.7%伴有糖尿病,19.3%伴有高尿酸血症,41.9%有低镁血症,22.6%有胰腺畸形,32.3%伴有肝脏异常。因此,建议对肾畸形患者,尤其是与其他器官受累相关的患者,应考虑进行HNF1B基因检测[3]。
本例患者通过HNF1B基因检测明确诊断为RCAD。与既往文献报道不同的是,本例患者并不是以糖尿病为首发症状,而是以转氨酶升高、胆汁淤积及高血红蛋白为首发表现,随后出现血糖及尿酸升高表现,但其特别的胰腺缺陷及肾囊肿表现,在既往诊治中被忽视,未能提早诊断。到目前为止,HNF1B基因缺陷的肝脏和胆道表型仅在单个患者中得到确认,多为儿童[4,5],多为胆汁淤积、胆道闭锁[3]或胆道囊肿[4,5,6]。另外患者高血红蛋白,多次骨穿刺检查及JAK2基因阴性,除外原发性真红细胞增多症。而HNF1B基因缺陷是否引起高血红蛋白在既往鲜见相关报道。
此例患者HNF1B基因变异的方式是杂合性缺失,属于拷贝数变异(CNVs)的一种,CNVs是DNA的大规模缺失或复制,需要专门的检测方法,如基于微阵列的基因组杂交或多重连接探针扩增,仅仅通过DNA测序是不易发现的。此患者开始的基因检测仅进行了全外显子测序+线粒体基因组测序,并未发现突变位点。当发现胰腺缺陷及肾囊肿表现后,针对HNF1B基因进行了多重连接探针扩增检测,最终才发现了HNF1B基因的拷贝数变异。此患者的父母和姐姐均未发现与患者同样的症状及基因改变,考虑此段变异为新的拷贝数突变,即是自己这代发生的,不是从父母遗传来的。在我国既往报道的病例多为HNF1B转录活化区杂合错义突变,可能是受到检测技术的局限性,这种杂合性缺失的拷贝数变异罕见报道。然而,生物信息学的最新进展使得从DNA二代测序数据中检测CNVs成为可能[7]。
总之,RCAD是一种较为罕见的遗传性疾病,随着人们对此类疾病认识的深入,更多的患者能够早期得到正确的诊断。但拷贝数变异这种突变形式需要专门的检测方法,提示临床医师在怀疑此病时,不仅要做全外显子测序,还要进行多重连接探针扩增检测来协助诊断。
王征,侯维,郑素军.肝功能异常的少见原因:肾囊肿和糖尿病综合征1例[J].中华肝脏病杂志, 2023, 31(7): 752-755. DOI: 10.3760/cma.j.cn501113-20230619-00267.
所有作者均声明不存在利益冲突



























