
该文报道1例仑伐替尼治疗晚期原发性肝癌导致的肾损害。患者为63岁男性,因“肝癌4年,血压升高近2年,水肿7个月”入院。阿特珠单抗联合仑伐替尼治疗肝癌过程中,血压升高及肾功能不全进行性加重。肾活检病理光镜提示内皮细胞病变及肾小管间质损害,电镜提示系膜细胞和系膜基质中度增生,系膜区可见较多团块状低电子密度沉积物,内皮下可见少量电子致密物,病理诊断为内皮细胞病(血栓性微血管病)和继发性局灶节段性肾小球硬化症。考虑为仑伐替尼继发肾损伤。予停用仑伐替尼并给予血管紧张素受体拮抗剂治疗后,门诊随诊8个月余,血压正常、尿蛋白转阴及肾功能显著改善。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者,男性63岁,因“肝癌4年,血压升高近2年,水肿7个月”于2021年11月19日入住北京协和医院肾内科。2017年2月患者因“全身乏力”行正电子发射体层成像-计算机体层成像(PET-CT)发现肝右叶低密度肿块[标准摄取值7.7],且肝内及胰腺、十二指肠、淋巴结多发转移,诊断原发性肝癌(T3N1M1,Ⅳ期);血清白蛋白(albumin,Alb)40.3 g/L,血清肌酐(serum creatinine,Scr)94 μmol/L;行肝动脉导管介入及放射治疗。于2017年8—12月予纳武利尤单抗治疗(140 mg/2周,静脉输注,共18个疗程),期间监测血压、肾功能均正常。2019年1月复查PET-CT发现肝脏肿物增大伴左侧锁骨上新发肿大淋巴结(标准摄取值6.8),调整为静脉输注阿特珠单抗1 200 mg/月联合口服仑伐替尼8 mg qd。此后1个月,监测血压升高至150~160/90~100 mmHg,予苯磺酸氨氯地平片10 mg qd可控制血压于130~140/90~95 mmHg,复查血生化:Alb 42.1 g/L,Scr 89 μmol/L,血脂正常。2020年4月患者无诱因双下肢水肿,渐行性加重,尿量无减少,血压进一步升高至150~160/90~100 mmHg;监测血生化变化(4—10月):Alb 37.6→30.0 g/L,Scr 95→214 μmol/L,血钾4.69 mmol/L,总胆固醇6.44 mmol/L,三酰甘油1.89 mmol/L;尿常规:蛋白(3+),潜血(+),葡萄糖(+),24 h尿蛋白量3.26 g。患者于2021年11月19日收住本院肾内科。既往史:慢性乙型病毒性肝炎(乙肝)12年余,近5年服用阿德福韦酯10 mg qd;2020年7月曾患脑梗死,口服通心络1.44 g tid半个月。个人史:否认特殊化学品及放射性物质接触史。吸烟史30余年,已戒烟1年;饮酒史30余年,已戒酒12年。入院查体:体温36.5 ℃,心率53次/min,血压163/95 mmHg,血氧饱和度99%。营养差,神志清,精神差,双手可见肝掌,双侧上下肢肌力及肌张力均正常,双侧巴宾斯基征阴性,双下肢轻度水肿。
入院诊断:肾病综合征,慢性肾功能不全,高血压,原发性肝癌(T3N1M1,Ⅳ期),慢性乙肝,脑梗死病史。
入院后仑伐替尼减量为4 mg qd,并调整降压药硝苯地平控释片30 mg bid、琥珀酸美托洛尔缓释片47.5 mg qd,监测血压119~155/73~91 mmHg;复查血生化:Alb 31.0 g/L,Scr 176 μmol/L,血钾 4.5 mmol/L,血脂正常;尿沉渣分析、尿常规:蛋白1.0 g/L,葡萄糖5.5 mmol/L,红细胞25 个/μl;24 h尿蛋白量1.72 g。血糖正常范围,糖化血红蛋白4.8%,系统性血管炎相关自身抗体谱、抗核抗体谱、冷球蛋白、血清免疫固定电泳、抗磷脂酶A2受体抗体及抗肾小球基底膜抗体均阴性;泌尿系超声:右肾9.0 cm×5.1 cm×4.8 cm,左肾9.1 cm×3.8 cm×5.4 cm。
2021年11月29日行B超引导下肾活检。病理结果:免疫荧光(图1A,图1B):全片共9个肾小球,1个硬化。IgG(-),IgA(-),IgM(+~2+),C3(2+~3+),C4(+~2+),C1q(+),纤维蛋白原(-),Alb(-),λ(+),κ(-)。IgM及C4为弥漫分布在系膜区和毛细血管袢的颗粒样沉积,其余为弥漫节段分布在系膜区和毛细血管袢的颗粒样沉积。光镜(图1C,图1D):全片共30个肾小球,1个球性硬化,6个节段性硬化。可见局灶节段性系膜细胞增生和系膜基质增多,伴局灶节段性内皮细胞增生、肿胀,部分硬化节段可见足细胞增生。大部分毛细血管袢可见明显扩张,袢腔内可见血浆蛋白渗出。肾小球基底膜节段性增厚伴明显变性,可见内疏松层肿胀、增宽及双轨形成。肾小管上皮细胞可见颗粒及空泡变性。可见散在分布的轻度肾小管基底膜增厚。间质可见散在分布的水肿和轻度纤维化,伴有极少量单个核为主的炎性细胞浸润。部分小叶间动脉壁轻度增厚。电镜(图1E,图1F):系膜细胞与系膜基质中度增生,系膜区可见较多团块状低电子密度沉积物,内皮下见少量电子致密物。内皮细胞增生、肿胀,肾小球基底膜内疏松节段性增宽,上皮下偶见电子致密物。上皮细胞足突偶见融合。未见肾小管间质特殊变化。病理诊断:内皮细胞病(血栓性微血管病)、继发性局灶节段性肾小球硬化症(focal segmental glomerulosclerosis,FSGS)。
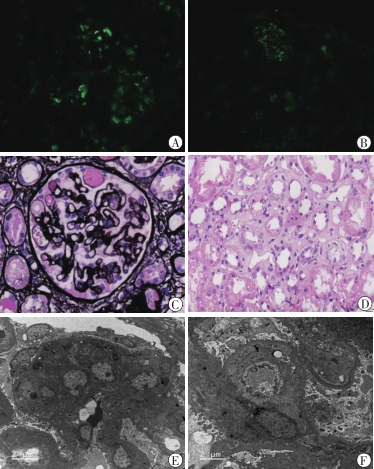

注:A:C3(2+~3+)节段分布在系膜区和毛细血管袢,颗粒样沉积(免疫荧光 ×200);B:C4(+~2+)弥漫分布在系膜区和毛细血管袢,颗粒样沉积(免疫荧光 ×200);C:光镜下,局灶节段性内皮细胞增生、肿胀,足细胞节段性增生,毛细血管袢腔内可见血浆蛋白渗出,肾小球基底膜节段性增厚伴变性(PASM染色 ×400);D:光镜下,肾小管间质水肿(HE染色 ×400);E:系膜区可见较多团块状低电子密度沉积物,内皮细胞增生、内皮下少量电子致密物,上皮细胞足突偶见融合(电镜 ×3 000);F:基底膜内疏松层增宽(电镜 ×5 000)
病理结果显示肾小球改变符合血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)通路抑制后肾脏改变,无肾脏免疫相关不良反应特征性间质性肾炎改变。与肿瘤科及患者再次讨论协商后,2021年12月8日停用仑伐替尼,保留阿特珠单抗[程序性死亡受体配体1(programmed death-ligand 1,PD-L1)抑制剂],调整降压药为加用氯沙坦并逐渐调增剂量至100 mg qd、硝苯地平控释片剂量调整为30 mg qd。患者双下肢水肿减轻,血压检测121/73 mmHg。
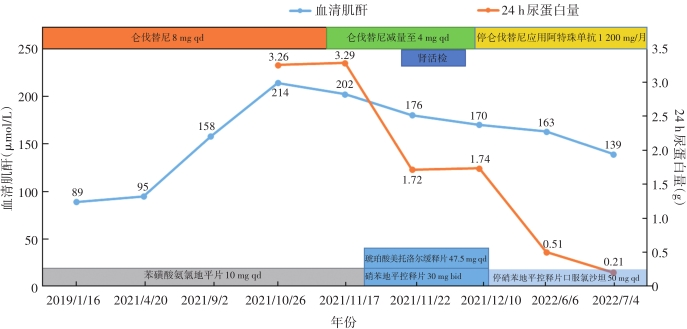
出院后随诊情况:血压持续改善,水肿基本消失,食欲和精神均改善。2021年12月13日复诊测血压126/75 mmHg,停用硝苯地平控释片、单药氯沙坦50 mg qd控制血压仍满意;血生化:Alb 32 g/L,Scr 170 μmol/L,尿素氮11.55 mmol/L,血钾4.6 mmol/L;24 h尿蛋白量2.03 g。2021年12月15日再次应用阿特珠单抗1 200 mg,此后每月规律应用阿特珠单抗1 200 mg 1次。2022年6月6日复诊,查Scr 163 μmol/L,24 h尿蛋白量0.51 g。2022年7月4日随诊复查Scr 139 μmol/L,24 h尿蛋白量0.21 g。随访Scr及24 h尿蛋白量变化见图2。

肝细胞癌(hepatocellular carcinoma,HCC)是消化系统中常见的恶性肿瘤,恶性程度高,易复发转移,晚期治疗效果有限。近年,抗肿瘤治疗进展迅猛,分子靶向药物和免疫检查点抑制剂均成为治疗晚期HCC的新选择,尤其是PD-L1抑制剂联合抗血管生成靶向药物仑伐替尼成为热点方案。本文首次报道了我国临床应用过程中仑伐替尼致肾损害的情况。
本例老年男性肝癌患者在多种抗肿瘤药物治疗过程中出现蛋白尿及肾功能改变。梳理其病史,我们发现该患者因乙肝长期口服阿德福韦酯,肝脏肿瘤治疗前期使用约18个化疗周期程序性死亡受体1(programmed death-1,PD-1),在此阶段肾功能基本稳定。病程中,因肿瘤进展改为PD-L1联合VEGF-酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKIs)后血压升高,1年后患者出现蛋白尿和肾功能异常。入院前门诊仑伐替尼已减半,住院后血压和蛋白尿均改善。筛查系统性血管炎相关自身抗体谱、抗核抗体谱、冷球蛋白、血清免疫固定电泳、抗磷脂酶A2受体抗体及抗肾小球基底膜抗体均为阴性,监测血糖及糖化血红蛋白正常范围,基本排除糖尿病肾病、狼疮肾炎及紫癜性肾炎。肾活检病理提示肾小球内皮细胞损伤、血栓性微血管病改变,伴随继发性FSGS样改变。治疗中加用小剂量血管紧张素受体拮抗剂氯沙坦钾片后,血压改善,血肌酐一过性升高后回落。
综合上述,肾损害考虑药物相关性,仑伐替尼导致的肾损害为首位因素。重点鉴别诊断包括;(1)免疫检查点抑制剂相关肾脏不良事件中,急性肾损伤最常见[1],病理特征主要为间质性肾炎。该患者肾活检病理示肾间质水肿,考虑与低蛋白血症、肾病综合征有关,免疫相关不良反应证据不足。虽有个案报道免疫检查点抑制剂可继发FSGS或膜性肾病而表现为肾病综合征[2],但是根据患者用药、停药过程,前期使用18个化疗周期纳武利尤单抗治疗中肾脏无异常表现,停用仑伐替尼、保留阿特珠单抗后,血压、蛋白尿均显著改善。因此肾功能受损无法用PD-1/PD-L1抗体治疗解释。(2)患者因乙肝长期使用阿德福韦酯,此药是阿德福韦的前体,在体内水解为阿德福韦发挥抗病毒作用,可导致肾小管损害、间质性肾炎。但本例患者已规律口服阿德福韦酯5年,期间监测肾功能未发现异常。故不考虑抗乙肝病毒药物引起的肾损害。而进一步治疗是鉴于患者肾功能异常,调整抗病毒治疗为恩替卡韦。
仑伐替尼治疗属于阻断VEGF通路TKIs的抗肿瘤治疗方法。目前VEGF通路靶向的TKIs已发展到第3代,常见药物包括奥希替尼、仑伐替尼,主要通过抑制VEGF和成纤维细胞生长因子信号通路而调节血管生成细胞表面和细胞内分子,抑制肿瘤血管生成从而抑制肿瘤的增殖和转移,抑制VEGF信号传导可抑制一氧化氮的合成,因此可导致高血压。Ito等[3, 4]的研究表明,VEGF通路的TKIs可通过抑制一氧化氮合成从而促进血管收缩因子发挥收缩肾脏入球小动脉作用,继而导致肾小球内血流减少、肾功能受损。其潜在肾损害病理生理机制是TKIs引起的直接细胞损伤和微循环障碍导致缺血性损伤。VEGF通路相关蛋白在肾脏发育及功能维持上起着重要作用,足细胞旁分泌及血液循环内分泌的VEGF作用于肾小球内皮细胞,导致足细胞及内皮细胞病变[5, 6]。高血压、蛋白尿等全身及肾脏微血管损伤表现是VEGF通路靶向阻断治疗中最常见的不良反应,常见肾脏病理改变为血栓性微血管病、微小病变肾病及FSGS[7]。
2018年仑伐替尼在中国批准上市,作为晚期HCC的一线或二线用药,是一种口服的多靶点TKIs,能够抑制VEGF受体(VEGF receptor,VEGFR)1~3及血小板衍生生长因子受体(血小板源生长因子β、Ret、c-kit),从而多靶点发挥抗肿瘤作用。既往报道,仑伐替尼相关的不良反应主要与胃肠道相关,包括腹泻(29%~90%)、厌食(50%~82%)、恶心(37%~60%)、呕吐(22%~50%)及体重减轻(41%~46%)[8, 9]。仑伐替尼对VEGFR1~3均具有抑制活性,在3种VEGFR亚型中,VEGFR2对肿瘤生长过程中的新血管生成最重要。而仑伐替尼的抗肿瘤活性很大程度上取决于对新血管生成的抑制。Sueta等[10]对接受仑伐替尼治疗6 d患者进行临床研究发现,血压升高伴随血清一氧化氮浓度降低。Schlumberger等[11]在一项随机、双盲、多中心研究中分析261例患者接受仑伐替尼治疗的预后,69.3%的患者出现高血压,32.2%的患者出现蛋白尿。Furuto等[12]2018年报道肾活检为FSGS样损害,肾小球出现系膜溶解、内皮肿胀和小动脉出现收缩等肾微血管病特征。Delsante等[13]2021年报道3例接受仑伐替尼治疗患者出现蛋白尿及Scr升高,经肾活检证实肾脏存在微血管病变,包括肾小球基底膜重复与节段性细胞插入、系膜松解、局灶性毛细血管内和小动脉血栓。上述报道总体与本例相符。截至目前,我国尚无仑伐替尼相关肾损害的报道。
仑伐替尼导致的不良反应的治疗基于其发病机制设计,VEGF通路抑制继发高血压、肾损害的主要发生机制是内皮功能障碍,一氧化氮途径抑制,内皮素1增加,血管重塑,全身血栓性微血管病,氧化应激,毛细血管稀疏,肾钠排泄减少,因此临床使用血管紧张素转化酶抑制剂/血管紧张素受体拮抗剂类降压药控制血压及尿蛋白,同时减量或停用抗肿瘤药物至关重要。但需注意的是,尽管停药后大多数患者肾功能改善、尿蛋白减少,但肿瘤进展风险增加,因此需及时调整抗肿瘤方案。目前,虽然治疗此类患者的最佳方案仍不确定,但是更早、更精确地监测尿蛋白水平,及早调整仑伐替尼剂量或更换抗肿瘤药物,密切监测肾功能、尿常规,是防止进一步的肾损害以及停药带来的肿瘤进展风险的有效临床应对策略。
随着各类新型抗肿瘤治疗药物的涌现及联合交叉使用,抗肿瘤药物相关肾损伤问题在临床医学实践中日益突出。不同抗肿瘤机制的药物通过不同机制引起不同程度的肾损伤,包括肾小球性、肾小管间质性和肾血管性疾病。本例患者的诊治过程提示,仔细梳理用药史和及时的肾活检病理检查是肿瘤患者药物相关性肾损害诊疗的关键,及时停用可疑药物,结合病史及临床表现、治疗反应可最终做出病因学的确诊,及时调整抗肿瘤方案,最大限度地保证患者的整体获益。
黄菊, 叶葳, 文煜冰, 等. 多药联合治疗晚期原发性肝癌中的仑伐替尼致肾损害1例及文献复习[J]. 中华肾脏病杂志, 2023, 39(8): 616-619. DOI: 10.3760/cma.j.cn441217-20221006-01006.
所有作者声明无利益冲突































