
心血管疾病(cardiovascular disease,CVD)已经成为危害人类健康的重大疾病,是导致人类因疾病死亡的主要原因之一[1]。CVD的发病风险与多种因素相关,包括吸烟、血脂异常、肥胖、糖尿病和高血压等[2]。肠道菌群在维持人体的生理和代谢健康方面起着至关重要的作用。研究表明,肠道菌群能够调节人体的病理生理过程,并影响CVD的发生与发展[3]。越来越多的研究证实了肠道菌群与CVD密切相关。本文就肠道菌群与CVD之间的关系进行综述,为进一步探究肠道菌群在CVD中的作用机制提供思路。
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
心血管疾病(cardiovascular disease,CVD)已经成为危害人类健康的重大疾病,是导致人类因疾病死亡的主要原因之一[1]。CVD的发病风险与多种因素相关,包括吸烟、血脂异常、肥胖、糖尿病和高血压等[2]。肠道菌群在维持人体的生理和代谢健康方面起着至关重要的作用。研究表明,肠道菌群能够调节人体的病理生理过程,并影响CVD的发生与发展[3]。越来越多的研究证实了肠道菌群与CVD密切相关。本文就肠道菌群与CVD之间的关系进行综述,为进一步探究肠道菌群在CVD中的作用机制提供思路。
人类肠道中含有多种微生物,这些微生物在宿主的健康中起着重要作用,肠道微生物已成为影响人类健康和疾病的核心因素,其中肠道菌群更是与一些疾病息息相关[4]。成人肠道微生物群非常多样化,它由数万亿个微生物组成,但主要由4个门主导:厚壁菌门(Firmicutes,F)、拟杆菌门(Bacteroidetes,B)、放线菌门和变形菌门。肠道微生物群组成的微妙平衡是维持肠道免疫力和全身稳态的关键,当这种平衡被破坏时,可能导致不良的后果。肠道菌群参与人体各种功能的调节,如为宿主提供代谢营养,参与生长促进和免疫调节,消除致病微生物,维持肠道屏障的完整性和正常的稳态[5]。肠道菌群主要通过两种途径与宿主相互作用,一种是代谢依赖性途径,如三甲胺(trimetlylamine,TMA)/三甲胺N-氧化物(trimetlylamine oxide,TMAO)、短链脂肪酸(short-chain fatty acids,SCFA)及胆汁酸(bile acid, BA)途径;另一种是细菌易位相关内毒素血症途径,如尿毒症毒素途径[6]。除了细菌来源的代谢物有调节CVD风险的能力,细菌细胞壁的成分(脂多糖和肽聚糖)也可以被宿主的先天免疫系统识别,促进CVD的发生。微生物相关分子模式如脂多糖和肽聚糖分别被宿主Toll样受体和核苷酸寡聚化结构域样受体选择性地识别,Toll样受体参与了细胞激活和炎症的发生,其中Toll样受体2和Toll样受体4表达在高脂血症小鼠中发挥整体促动脉粥样硬化作用[7]。研究发现,肠道菌群中的有益菌包括乳酸杆菌和双歧杆菌[8]。拟杆菌门和厚壁菌门占有益菌总数的90%以上[9]。由厚壁菌增多和/或拟杆菌减少引起的F/B比值增加被广泛认为是肠道生态失调的特征,并且与肥胖、糖尿病和CVD有关。高血压动物模型中微生物丰富度降低,F/B比值显著增加,提示高血压时存在肠道生态失调,而口服米诺环素可以重新平衡高血压大鼠模型中的肠道微生物群[10]。研究表明,高脂肪饮食可导致拟杆菌门的减少,以及厚壁菌门和变形菌门的增加[11]。上述研究表明,CVD与肠道菌群存在密切联系,相关机制研究见图1。
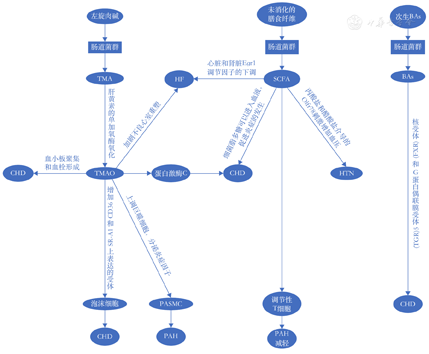

注:BAs,胆汁酸;CHD,冠心病;HF,心力衰竭;HTN,高血压;PAH,肺动脉高压;PASMC,肺动脉平滑肌细胞;SCFA,短链脂肪酸;TMA,三甲胺;TMAO,氧化三甲胺
普通拟杆菌和多雷拟杆菌是人体肠道菌群中优势种,它们是拟杆菌门的拟杆菌属中最丰富的2个种。通过定量PCR证实了普通拟杆菌和多雷拟杆菌在冠心病患者中的丰度显著降低。另外一项研究报告了冠心病患者的特征性变化,其中乳酸杆菌显著增加,乳酸杆菌属于厚壁菌门[12]。而拟杆菌减少,特别是在有肥胖、糖尿病和高血压风险的患者中。可以看出F/B比值在冠心病中增加,冠心病中存在明显的肠道菌群失衡。
抑制肠道微生物易位可以减少局部炎症,抑制单核细胞浸润,减少心肌梗死面积[13]。Yoshida等[14]的动物实验表明,通过灌胃补充活的普通拟杆菌和多雷拟杆菌可减少斑块炎症反应,减少动脉粥样硬化斑块的形成。活拟杆菌治疗可改善内毒素血症和全身炎症,通过活拟杆菌治疗诱导,可以引起血浆循环脂多糖(lipopolysaccharide,LPS)浓度降低,从而抑制动脉粥样硬化发病机制中的系统性固有免疫细胞和炎症激活。使用活拟杆菌属治疗后,LPS水平的下降可能会降低主动脉中Toll样受体4 (toll-like receptors, TLR4)的表达,从而减少动脉粥样硬化斑块中巨噬细胞和CD4+ T细胞的聚集。
肠道菌群代谢物TMAO和SCFA可直接影响冠心病的发生[15]。TMAO来源于TMA,其由肠道微生物群从含有左旋肉碱或磷脂酰胆碱的营养物质中产生,随后被含肝黄素的单加氧酶氧化为TMAO[16]。研究表明[17],TMAO的长期增加与冠心病风险较高相关。TMAO的作用被描述为"肠道微生物群与动脉粥样硬化性心脏病之间的第一个潜在直接联系"[18]。TMAO通过多种机制加速动脉粥样硬化。TMAO导致动脉粥样硬化的机制可能是通过在动脉壁中形成泡沫细胞,TMAO在体内可以增加CD36和SR-A1表达的受体,导致泡沫细胞的形成。高水平的TMAO影响脂质代谢,炎症反应促进内皮功能障碍和血小板再激活的恶化,并刺激血栓形成[19],TMAO能活化蛋白激酶C (protein kinase C ,PKC ),从而增加黏附分子的表达,如血管细胞黏附分子1(vascular cell adhesion molecule-1,VCAM-1)、ICAM-1、E-选择素、白细胞介素(interleukin ,IL )-6 ,IL-1和还原型辅酶Ⅱ,即烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)氧化酶的活化,细胞黏附分子上调在动脉粥样硬化斑块的形成中起初始作用[20]。TMAO可增加血小板内质网中的钙浓度,从而导致血小板聚集和血栓形成,增加急性冠状动脉综合征的风险[21]。SCFA是在细菌发酵未消化的膳食纤维、不可消化的碳水化合物或抗性淀粉时形成的,主要包括乙酸、丙酸和丁酸,其中乙酸盐和丙酸盐主要由拟杆菌产生,而丁酸盐通常由厚壁菌产生。SCFA可以为肠上皮细胞提供能量,也可以作为信号分子参与代谢、免疫和炎症反应,SCFA丁酸盐被认为有助于肠道健康,因为它调节肠道上皮完整性。当肠道上皮受损时,细菌脂多糖可以进入血液(内毒素血症),会促进炎症的发生,继而增加了冠心病的风险[15]。胆汁酸(bile acids ,BAs)是存在于哺乳动物和其他脊椎动物胆汁中的类固醇酸。原发性BAs在肝脏中由胆固醇合成,次生BAs由结肠细菌产生。BAs排泄减少可增加冠心病的风险,其可能通过核受体和G蛋白耦联膜受体5发挥作用,调节促进动脉粥样硬化发展的各种代谢途径[22]。
通过高血压动物模型证实,肠道微生物群产生SCFA的细菌丰度较低,产生乳酸的细菌丰度较高,拟杆菌丰度较低,变形杆菌和蓝藻丰度较高。动物干预研究表明,这些动物模型中高血压的血压水平可以通过粪便微生物群移植和抗生素治疗来改变[10]。Dan等[23]对人体粪便样本进行16S扩增子测序,发现与血压正常的患者相比,产生SCFA的细菌在高血压患者中的丰富性较低。
报道显示,高血压耐药患者使用广谱抗生素治疗可显著降低血压水平,推测转基因修饰是其潜在机制[24]。高血压动物模型中,使用了血管紧张素Ⅱ的大鼠含有较低丰度的拟杆菌门[10]。目前发现一些已知的降压药物通过调节肠道微生物群发挥其调节血压的作用。有研究发现,氯沙坦可以恢复大鼠肠道F/B比例、产醋酸和乳酸的细菌,以及严格的厌氧菌的生态失调,并提高肠道的完整性[25]。氯沙坦治疗后的这些微生物变化有助于血管保护,减少了大鼠的肠道菌群失衡,这种效果似乎与它减少肠道交感神经作用有关,可提高肠道的完整性。氯沙坦引起的肠道菌群变化,可能通过调节肠道免疫系统,起到保护血管和降低血压的作用[25]。在动物模型和人高血压患者中,益生菌的摄入会影响宿主的血压水平。一项纳入了9项随机对照临床试验的荟萃分析表明,益生菌摄入对收缩压和舒张压有潜在影响[26]。富含纤维的饮食、醋酸镁和口服米诺环素补充剂可以恢复肠道微生物群的稳态,降低F/B比并降低血压。生物失调可促进低密度脂蛋白氧化,因此,肠道失衡也通过氧化低密度脂蛋白介导的血管收缩参与高血压,高水平的氧化低密度脂蛋白通过抑制一氧化氮合成和内皮素-1而导致高血压[27]。
Pasini等[30]的研究表明,充血性心力衰竭患者可能伴有肠道致病菌和念珠菌种类过度生长,如弯曲杆菌、志贺菌、沙门菌、小肠结肠炎耶尔森菌和念珠菌属。假粪杆菌减少和瘤胃球菌增加是充血性心力衰竭患者肠道微生物群的基本特征[31]。
心力衰竭患者的全身性充血也可能导致肠壁水肿,导致肠通透性增加。因此,在肠道水平上,肠道透性增加导致肠道内革兰氏阴性菌进入体循环产生内毒素,微生物和微生物代谢物的易位。这些过程可能进一步激活细胞因子,并可能产生全身炎症,导致心力衰竭的进展[32]。有研究证明,慢性心力衰竭患者的肠壁厚度、肠通透性和肠功能不全增加[33]。心功能分级较差的心力衰竭患者中,TMAO浓度水平更高,在一项为期5年的纵向长期随访研究中,对720例有心力衰竭病史的患者进行了TMAO血浆浓度与全因死亡率之间关系的调查,发现心力衰竭患者的TMAO平均值显著高于对照组(P<0.001)[34]。
TMAO在心力衰竭患者的循环中均升高,预示着总体预后恶化。Organ等[35]进行的一项动物研究证实了膳食胆碱及其肠道微生物依赖性代谢物TMAO可以加剧不良心室重塑和压力超负荷期间纤维化反应的发展。这些发现表明,TMAO通路通过发生不良的心室重塑来增强心力衰竭易感性,并可能加速心力衰竭的进展。在一种动物模型中,长期饮食诱导的TMAO增加也与肾纤维化增加有关[36]。在高血压的小动物模型中发现,醋酸盐是一种由高纤维饮食产生的SCFA,当作为饮食的补充时,醋酸盐可显著降低血压、心脏纤维化、左心室肥厚和肾纤维化。在这项研究中,醋酸盐膳食补充剂导致心脏和肾脏Egr1调节因子的下调,由于Egr1与适应不良的心脏肥大和纤维化、肾纤维化和炎症有关,所有这些都存在于晚期心力衰竭患者中[37]。
Kim等[38]用宏基因组学法对18例1型肺动脉高压患者和13名正常对照者的粪便微生物组进行比较后发现,肺动脉高压组中与TMA/TMAO和嘌呤代谢有关的细菌群落增加;而产生丁酸和丙酸的细菌,如粪球菌、丁酸弧菌、毛螺旋菌科、真杆菌、艾克曼菌和拟杆菌等在对照组中增加。病毒组学分析(virome analysis)显示,肺动脉高压人群中肠球菌富集,乳球菌噬菌体相对耗竭。Jose等[39]研究发现,与对照组20例非肺动脉高压患者相比,在20例肺动脉高压患者的粪便中发现鼠李糖类厌氧菌的数量增加,肠杆菌、双毛瘤胃球菌和白毛瘤胃球菌的数量相对缺乏。
在肺动脉高压中肠道菌群失调有启动免疫失调和早期血管周围炎症的作用,肠道菌群失调导致促炎代谢物增加和抗炎代谢物减少,这可能是引发肺动脉高压的机制。肺动脉高压患者肺动脉病变的一个重要特征和实验模型是不同程度的血管周围炎症浸润。虽然触发和/或加重炎症反应的机制尚不完全清楚,但炎症先于血管病变支持免疫失调是导致肺动脉高压血管重塑的原因[40]。最近,越来越多的动物和临床证据表明,肠道生态失调可能通过以下2个方面在诱导或加重肺动脉高压的炎症反应中起重要作用。首先,肠道生态失调破坏肠道屏障功能,并将肠道微生物群迁移到宿主循环中,引发免疫反应[41]。其次,肠道微生物群通过控制内毒素、SCFA、色氨酸和TMA/TMAO的代谢来参与宿主免疫反应的调节[42]。先前的研究表明[43],肺动脉高压患者和MCT治疗大鼠的血清内毒素和sCD14水平显著升高,其通过激活Toll样受体4/核因子κB炎症信号通路促进免疫反应和肺血管重塑,并证实肺动脉高压中肠道细菌移位和巨噬细胞活化。
肠道微生物组参与多种途径,被认为是额外的代谢器官,其代谢物可能被体循环吸收并发挥生物作用,从而影响宿主的健康。SCFA(如乙酸盐、丙酸盐和丁酸盐)、色氨酸代谢物、TMA/TMAO和胆汁酸与肺动脉高压发病机制有关已得到证实,肠道生态失调导致SCFA减少,并加剧炎症反应和肺动脉高压,肠道微生物组通过调节色氨酸和炎症的代谢来影响肺动脉高压[43]。微生物产生的SCFA促进了结肠中调节性T细胞(regulatory cells,Treg)的产生,调节性T细胞具有抗炎作用[44]。Sharma等[45]在肺动脉高压大鼠模型研究中,发现肺动脉高压组大鼠表现出双歧杆菌和链球菌的消耗,这些属通常被认为是有益的细菌群落,与SCFA的产生有关。Karoor等[46]通过研究肺动脉高压大鼠模型,发现补充外源性丁酸盐可以缓解肺血管疾病。Callejo等[47]在肺动脉高压大鼠中发现产生醋酸盐的细菌减少,血清中的醋酸盐亦降低。有研究发现,与对照组大鼠相比,肺动脉高压组的代谢物明显失调,34种代谢物水平高于对照组,2种代谢物水平低于对照组。该研究还对肠道微生物群及代谢组进行相关分析,发现肠道微生物群的变化与宿主代谢组的变化之间存在相关性。Huang等[48]研究发现,在严重肺动脉高压的患者和野百合碱-肺动脉高压动物模型中,TMAO升高。该研究还证实,TMAO通过上调巨噬细胞分泌的炎症因子来增加肺动脉平滑肌细胞的增殖和迁移,并使用3,3-二甲基-1-丁醇(1-Butanol,3,3-dimethyl,DMB)抑制TMAO合成,并显著降低了肺动脉高压病理改变,这表明TMAO中涉及的炎症途径可能直接促进肺动脉高压的发病。Sanada等[49]发现,血管内皮生长因子受体拮抗剂SU5416+缺氧诱导的大鼠肺动脉高压模型中,与炎症抑制相关的拟杆菌和阿克曼菌减少,拟杆菌通过多糖A的产生来诱导Treg,Treg可抑制血管损伤后的过度炎症反应,从而可能诱导肺动脉高压的发生。
越来越多的证据表明,肠道菌群与CVD有密切联系。随着CVD进展,肠道菌群发生一系列变化,肠道菌群出现失衡。而这又反过来促进CVD的发展。除了肠道菌群失衡本身对CVD产生影响,肠道菌群代谢物通过多种途径也影响着CVD。目前已有大量研究发现肠道菌群失衡与CVD相关,然而其具体机制仍需进一步阐明。一些新的微生态制剂的研发仍处于临床试验阶段,可进一步研究微生态制剂在CVD治疗中的潜在益处和局限性。肠道菌群的分子遗传学及免疫学机制的研究空间也很大。总之,肠道菌群调节是防治CVD的新途径。靶向调节肠道菌群在CVD的防治中具有重要潜力,将为临床治疗提供新的思路。
刘演龙,常开丽,张灿,等.肠道菌群的改变与心血管疾病发生和发展的相关性研究进展[J/OL].中华心血管病杂志(网络版),2023,6:e1000146(2023-08-18). http://www.cvjc.org.cn/index.php/Column/columncon/article_id/324. DOI: 10.3760/cma.j.cn116031.2023.1000146.


























