
发育性髋关节发育不良(DDH)既往被称为先天性髋脱位(CDH),为小儿运动系统常见的结构性畸形之一,是指在发育过程中由于各种因素导致的股骨近端与髋臼的形态及两者相对位置关系的异常。在新生儿期,不稳定的髋关节并不罕见,但其中大部分在3月龄内恢复稳定;但如果髋关节的半脱位或脱位持续未得到改善,其解剖结构将会进一步发生变化。随着时间的推移,DDH可导致慢性疼痛、畸形、运动障碍,进而发展成早发性退行性骨关节疾病,最终导致残疾。DDH早期治疗的目的是恢复髋臼和股骨头的同心圆关系,主要以非手术治疗为主,而当年龄增加或无法通过闭合复位矫正时则以手术治疗为主,以达到改善步态、缓解疼痛和延长髋关节寿命的目的。成人未经治疗的DDH自然病程多数预后较差,早期诊断与治疗DDH可改善疾病预后、降低后期需要手术治疗的概率,并可减轻疾病对患者、家庭及社会造成的负担。对于DDH的诊断和治疗,此前国内外相关学术组织制定了各自的指南,但对于DDH的早期识别、早期诊断、早期治疗和从婴儿到成人的全过程序贯管理,国内尚缺少相应共识。在此背景下,本次指南的制订由中华医学会骨科学分会关节外科学组发起,筛选出我国骨科临床医师最为关注的15个DDH相关临床问题,最终形成基于循证医学的20条有关DDH临床诊断与治疗的推荐意见,旨在推动临床医师对DDH的全程序贯规范化治疗,进而提升治疗水平及临床疗效。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
发育性髋关节发育不良(development dysplasia of the hip,DDH)是指因某种因素导致患儿出生时或在生长发育过程中出现股骨头与髋臼的形态或位置的异常。1887年,William Adams首次提出了先天性髋脱位(congenital dislocation of the hip,CDH)的概念;1992年,北美小儿骨科学会(Pediatrics Orthopaedic Society of North America,POSNA)将此疾病正式更名为DDH。DDH可引起明显的关节疼痛和功能障碍[1],是患者在成年后发生进行性髋关节骨关节炎并需要行全髋关节置换术治疗(total hip arthroplasty,THA)的重要原因[2]。DDH还可引起患者双下肢不等长、跛行、脊柱前凸或侧弯等严重影响患者生活质量的后果和并发症[3, 4]。研究表明,中国DDH总体的发病率约为1.52%,其中男性约为0.75%,女性约为2.07%[5]。虽然在DDH患者中需要接受THA的患者只占2.6%~9.1%,但是其中接受THA的年轻患者则占21%~29%[6, 7]。随着诊疗技术的发展,DDH的早期诊断水平有了明显提高,同时针对早期DDH也有了新的治疗选择,从而减少了DDH进展到晚期需要接受THA的概率;此外,随着对DDH病理改变认识的深入,对DDH患者施行手术治疗时也产生了一系列新的理念和技术。美国儿科医师协会(American Academy of Paediatrics,AAP)于2000年制定了儿童DDH的临床实践指南[8];2013年美国超声医学协会(American Institute of Ultrasound in Medicine,AIUM)、美国放射学会(American College of Radiology,ACR)、儿科放射学会(Society for Pediatric Radiology,SPR)和超声影像医师协会(Society of Radiologists in Ultrasound,SRU)合作制定了DDH的超声筛查指南[9, 10, 11];美国骨科医师协会(American Academy of Orthopaedic Surgeons,AAOS)于2015年对DDH的检查及非手术治疗制定了相关指南[12];欧洲儿科放射学会(European Society of Paediatric Radiology,ESPR)于2011年制定了《欧洲儿科放射学会髋关节筛查推荐规范》[13]。中华医学会骨科学分会于2009年制定了《发育性髋关节发育不良诊疗指南(2009年版)》[14];中华医学会小儿外科分会骨科学组及中华医学会骨科分会小儿创伤矫形学组于2017年制定了《发育性髋关节发育不良临床诊疗指南(0~2岁)》[15],针对2岁以下的DDH患儿的诊断及治疗进行了规范。上述各指南均以婴幼儿时期的早期筛查和治疗为重点,但对DDH从初期筛查、早期干预到晚期关节功能重建缺少序贯性的指导,同时一些较新的技术没有被纳入。
基于此,本指南由中华医学会骨科学分会关节外科学组发起并负责制订,由《中华解剖与临床杂志》编辑部组织相关领域的方法学专家提供指南制订方法学和证据评价支持。本指南在前述指南的基础上,依据循证医学的原则对DDH的诊断和治疗给出推荐意见,不仅在临床工作上具有参考、规范化的作用,对社会公共卫生亦具有重要意义。
针对纳入的临床问题,按照循证医学文献检索格式对临床问题进行解构。根据解构的临床问题进行证据检索:(1)检索数据库,包括Medline、Embase、Cochrane Library,以及国内的CNKI、万方数据和中国生物医学文献数据库;(2)检索研究类型,优先检索5年内已发表的系统评价、荟萃分析及随机对照试验(randomized controlled trial,RCT),当最新证据不足或证据等级较低时增加检索5年以前发表的系统评价、荟萃分析、RCT以及队列研究、病例对照研究等;(3)检索关键词,包括development dysplasia of the hip,congenital dislocation of the hip,DDH,hip dislocation,髋关节发育不良,髋关节脱位,先天性髋脱位,髋臼发育不良;(4)检索时间为建库至2022年4月30日,草拟指南正文前对最近发表的证据开展进一步检索,更新检索的截止时间为2022年9月1日。
本指南采用证据评价与推荐意见分级、制定和评价(grading of recommendations,assessment,development and evaluation,GRADE)方法(http://www.gradeworkinggroup.org)对证据质量和推荐意见的推荐强度进行分级。GRADE证据质量和推荐强度分级与定义分别见表1和表2。按问题、推荐意见(证据级别、推荐级别)、证据概述的框架进行阐述。本指南共筛选出涉及DDH诊断和治疗两个方面的15个临床问题,最终形成20条推荐意见。

本指南中涉及的证据质量分级与定义
本指南中涉及的证据质量分级与定义
| 证据质量分级 | 定义 |
|---|---|
| 高(A) | 来自一项及以上随机对照试验的高质量证据 或高质量随机对照试验研究的Meta分析 |
| 中(B) | 来自一项及以上随机对照试验的中等质量证据 或一项及以上执行良好的非随机或观察性研究 的中等质量证据或Meta分析 |
| 低(C) | 基于临床经验的专家共识 |

本指南中涉及的推荐意见的推荐强度分级与定义
本指南中涉及的推荐意见的推荐强度分级与定义
| 推荐强度分级 | 定义 |
|---|---|
| 强推荐 | 干预措施利大于弊 |
| 弱推荐 | 干预措施利弊不确定或可能利大于弊 |
| 不推荐 | 干预措施风险较大或弊大于利 |
| GPS | 基于非直接证据或专家意见、经验形成的推荐 |
注:GPS(good practice statement)为专家建议
推荐意见1:DDH是多因素疾病,主要与遗传因素和机械因素有关(证据等级C,弱推荐)。
目前,业内学者认为DDH的病因是多因素的,主要与家族史和机械因素有关[16]。DDH有明显的家族史,患有此病的患者家族中,其发病率可高达20%~30%,且女性患者多于男性[17]。研究显示,臀位分娩的新生儿中约23%患有DDH[16,18];机械因素与胎儿在子宫内完全屈曲髋关节的姿势有关,当股骨处于内收和外旋状态,加上大转子的异常应力,将使股骨头朝髋臼后上方挤出[19]。
推荐意见2:DDH的解剖病理特点包括骨骼与软组织两部分,髋臼、股骨头、股骨颈、股骨干等骨组织,以及盂唇、圆韧带、关节囊等软组织,都会出现相应的病理改变,同时伴随有髋关节周围肌肉功能障碍(证据等级C,强推荐)。
DDH的解剖病理特点包括骨骼与软组织两部分。骨骼的变化是DDH病理改变的最重要部分,包括髋臼、股骨头、股骨颈和股骨干。髋关节的正常发育需要髋臼与股骨头的正常接触。髋关节在妊娠11周时已完全形成,此后股骨头的发育速度快于髋臼,至妊娠结束时只有不到50%的股骨头被髋臼覆盖[20]。分娩前限制胎儿活动(如臀位)或分娩后髋关节长时间伸展位(如襁褓)可导致髋臼与股骨头偏心接触[21]。如果异常应力长期存在将导致髋关节解剖结构改变[22]。不完全脱位时,股骨头仅与髋臼外上缘接触,异常集中的应力使髂骨生长受限、髋臼上缘扁平或缺损;完全脱位时,髋臼仍可保持原始形态,但缺少恰当的力学刺激导致髋臼发育较小且扁平[23]。
在婴儿站立前,髋臼的前、上、后缘发育不良导致髋臼较浅,股骨头较小、圆韧带肥厚、股骨头可脱位或不脱位,但均较易回纳入髋臼[24]。站立负重后应力集中对髋臼的影响更为明显,导致髋臼顶部的生理弧度消失、拱形结构变为斜坡状、髋臼外缘出现缺损,髋臼窝内充满脂肪组织和纤维组织,脱位的股骨头压迫髂骨翼形成假臼。随着时间推移,异常应力导致股骨头呈楔形[25]、股骨颈前倾增大、髂腰肌和髋内收肌群挛缩、盂唇内翻[26]、下方关节囊被拉入髋臼,进一步降低了股骨头复位进入髋臼的可能性[27]。
成年DDH患者的髋臼常为扁平状的浅窝,且随着发育不良程度的增加、髋臼外上侧的骨性结构缺损,髋臼顶经常表现出过度的倾斜与髋臼角增加,股骨头前方的包容性降低[21,28, 29],髋臼依脱位程度不同呈现浅杯形、浅盘形、贝壳形、三角形等不同病理形态,髋臼窝因不同程度骨赘增生呈现裂隙形、封闭形、三角形、浅平形等不同病理形态[30]。股骨颈前倾角增加伴有股骨髓腔狭窄[31]:DDH患者股骨颈前倾角平均为22.2°,而正常髋关节平均为14.3°[29];DDH患者的股骨干内外径和前后径均较小,大转子常旋转至更后方[27]。随着年龄的增长,严重的单侧脱位DDH患者将会出现肢体缩短、脊柱侧弯,双侧脱位患者会发生腰椎前凸增加。软组织方面,由于股骨头脱位和患肢缩短导致关节囊增厚并向外、向上延伸形成后突状,其缩窄部分与髋臼盂唇相结合,逐渐向股骨头方向延伸并毗邻外展肌。外展肌功能障碍将导致步态不稳,出现髂腰肌增厚,腘绳肌、内收肌、股直肌、阔筋膜张肌等挛缩,坐骨神经和股深动脉短缩;与此同时,往往合并盂唇以及圆韧带的撕裂[32]。
推荐意见3:DDH属于人群常见病,且发病率存在明显的种族和地域差异(证据等级C,强推荐)。
由于DDH的症状隐匿且使用的影像学检查定义存在差异,因此DDH发病率的估计值变化较大[33]。轻度髋关节不稳在新生儿中较为常见,发病率可高达40%,但随着生长发育多可自行纠正[34]。以色列一项研究纳入了9 030例婴儿(18 060个髋关节),于出生后1~3日接受体格检查和超声筛查,DDH检出率为5.5%,但在2~6周龄复查时仅0.5%的患儿被诊断为DDH[34]。
临床研究中报道的婴儿DDH发病率相差较大,其原因可能与调查的样本量、筛查方法及诊断标准有关,也与调查对象的种族和地域有关。如非洲新生儿的发病率为仅为0.06‰,而美国土著高达76.1‰[35]。我国尚缺少全国性的普查数据,仅有地区性研究发表:北京3.80‰、上海0.91‰[36]、天津2.66‰[37]、香港0.87‰[38]、台湾2.9‰[39]。王玉欢等[40]新近发表的研究中,通过对扬州市8 853例新生儿筛查,发现其DDH的发病率为1.20%。
成年人DDH的患病率与婴儿有较大差异。一项对3 620名丹麦成年人横断面研究发现,男性DDH患病率为4.3%,女性为3.6%[41]。另一项对25 767名中国成年人的横断面研究结果显示,DDH的总体患病率为1.52%,其中男性0.75%、女性2.07%[5]。我国不同地区人群DDH的患病率也有差异,华南地区约0.7%,华东地区约1.1%,华北地区约3.8%[42]。
推荐意见4:DDH的高危因素包括父母任一方或双方有DDH、女性、臀位生产、羊水过少、早产、合并其他畸形(证据等级C,强推荐)。
DDH的发病机制尚未明确,遗传因素、激素水平、机械因素等都被认为可能在DDH的发生发展中产生影响。目前多认为,家族史、女性、臀位生产、羊水过少、早产、合并其他畸形(如马蹄足、斜颈等)等为DDH的高危因素[43]。
遗传因素在DDH的发生中起到了一定作用[44]。有阳性家族史的婴儿中,DDH的绝对危险度为1%~4%[45]。一项Meta分析表明,阳性家族史的新生儿DDH相对危险度为1.39(95%CI 1.23~1.57)[46]。一项纳入589例DDH患者的回顾性研究[47]发现:已有1名孩子患病时,后续出生的孩子发生DDH的风险为6%;父母中有一方患病时,所生孩子发生DDH的风险为12%;父母有一方患病且已有一名孩子患病时,后续出生的孩子发生DDH的风险为36%。Stevenson等[44]研究也表明,DDH患者的一级亲属中DDH发病风险较正常人显著上升。
女孩DDH的发病率远高于男孩,可能与母亲的雌激素导致女性新生儿韧带松弛有关[8]。研究表明,女婴患DDH的风险约为1.9%[45],约为男婴的2~3倍。一项包含31个研究(20 196例患儿)的Meta分析发现,女婴发生DDH的相对危险度为2.54(95%CI 2.11~3.05)[46]。
根据机械力学的理论,臀先露胎位、羊水过少、巨大胎儿、多胎妊娠、使用襁褓都是DDH的危险因素[48, 49, 50]。妊娠晚期臀先露胎位可能是DDH最大的危险因素[50],臀先露的女婴DDH绝对风险高达12%,而臀先露男婴则为3%[45,51],其中以单臀先露的胎产式危险性最高[18]。一项Meta分析发现,臀先露相对于其他胎产式的相对危险度为3.75(95%CI 2.25~6.24)[46]。一项队列研究进一步探讨了臀位外倒转术对DDH风险的影响,发现成功的臀位外倒转术可将需治疗的DDH风险从9.3%降至2.8% [52]。分娩方式对DDH发生率的影响证据还较少[51],通过剖宫产缩短处于临产前臀先露胎位的时间可能会降低DDH的风险[46]。但是,国内一项针对扬州地区8 853例婴儿的临床研究则发现,臀先露胎位未能成为DDH发病的危险因素[40],因此仍需进一步研究。
其他与胎儿活动减少或胎位异常相关的情况也可能与DDH相关,但其对DDH发生风险的影响尚不明确,如斜颈、跖骨内收畸形、马蹄内翻足等[53],但在围产期保健中应重视有上述异常的婴儿并作为重点观察对象[54]。
推荐意见5:DDH的临床表现在不同年龄患者间差异较大,包括新生儿体格检查发现髋关节不稳定、婴儿髋关节外展受限、幼儿步态异常、青少年及成年人活动时疼痛和活动受限等(证据等级B,强推荐)。
DDH的临床表现取决于患者的年龄和病变程度。临床表现可能包括:新生儿体格检查发现髋关节不稳定,婴儿髋关节外展受限,幼儿步态异常,青少年及成年人活动时疼痛和活动受限等。
行走期前的幼儿DDH可表现为双下肢不等长、髋关节外展受限、关节弹响,行走期后主要为无痛性跛行[28, 29]。新生儿及3月龄以下的婴儿主要通过Ortolani试验和Barlow试验进行识别[28, 29,31]。出生3个月后,随着肌肉的生长、软组织的挛缩,Ortolani试验和Barlow试验的可靠性下降,且很难发现双侧髋关节脱位且无法复位的患儿。对于3月龄以上的婴幼儿患者,DDH主要以髋关节外展受限、双下肢不等长、臀纹不对称为临床表现。当患儿可自行站立和行走时,往往出现跛行(单侧脱位)或摇摆步态(双侧脱位),能够配合检查的患儿则可出现Trendelenburg试验阳性[27]。
成年后DDH的症状与其他内源性因素引起的髋关节疼痛类似[1],青少年或成人DDH常表现为腹股沟区以及髋外侧C形分布的疼痛(C sign)[21]。活动量增多引起外展肌疲劳时,将会加重疼痛和跛行[1]。
推荐意见6:影像学检查对DDH早期诊断和关节功能的评估具有重要价值。疑似DDH患者应根据年龄选择超声或X线检查,必要时可进行CT和MRI检查,以进一步明确诊断以及进行鉴别诊断(证据等级B,强推荐)。
Graf超声检查方法是DDH早期筛查首选方法[55]。髋关节超声检查以其无创、无辐射、动态可视化等优势,已经成为对新生儿以及出生后最初几个月的小月龄婴儿髋关节进行评估的一种准确方法[56, 57, 58]。超声检查可以同时显示骨质和软骨,并评估髋关节的稳定性和形态特征,且不需要镇静、无电离辐射,属于无创操作[59]。由于相当一部分新生儿具有生理性髋关节不稳定,因此,对超声检查的时机仍有争议。AIUM-ACR-SPR-SRU联合指南建议,除非临床筛查发现髋关节脱位或不稳定的表现,否则不应对6周龄内的婴儿进行髋关节超声检查[10]。我国《发育性髋关节发育不良临床诊疗指南(0~2岁)》中未明确超声检查的具体时机[15]。Donnelly等[60]认为出生后6周是髋关节超声检查的重要时间。Gokharman等[61]对超声筛查时机进行了研究,认为出生后8周进行超声检查优于出生后4周。
在评估4~6个月月龄的患儿时,对超声结果存在不确定性时可选择X线检查[62]。X线片也是大月龄婴儿、儿童和成年人DDH的常规检查。下肢及脊柱的全长X线片有助于明确双下肢长度差距(leg length discrepancy,LLD)的原因,如骨盆倾斜、脊柱侧凸、股骨或胫骨不等长[63]。
CT在DDH的诊断中应用较少,而是更多地应用于充分评估畸形以及术前规划中。MRI可辅助评估关节囊增厚、圆韧带增粗、髋臼内软组织充填,以及不同阶段的软骨损伤、盂唇内翻和发育情况等。相比于关节镜检查时的镜下所见,MRI的敏感度约为98%、特异度约为99%[64],但其高昂的费用和扫描过程中需要镇静不利于婴幼儿的筛查和随访[65]。
推荐意见7:建议使用Graf法对幼儿期DDH进行超声检查评估(证据等级B,强推荐)。
超声检查技术包括髋部形态特征的静态评估(Graf法)[66]和髋关节稳定性的动态评估(Harcke法)[67]及二者的联合应用。虽然在新生儿期超声检查常可发现轻微的髋关节不稳定或髋臼不成熟,但其优势在于可用于当有异常体征时的明确诊断、评估高危婴儿以及在观察或治疗DDH时监测髋关节的发育;在这种选择性应用中,它不仅可以指导治疗,还能防止过度治疗[68]。目前国内主要应用Graf法超声检查,其诊断标准[66,69, 70]为:Ⅰ型,α角≤60°,β角<55°,为发育正常的髋关节;Ⅱa型,α角50°~59°,55°<β角<77°,为生理性发育不成熟(3月龄以下);Ⅱb型,α角50°~59°,55°<β角<77°,为发育延迟(3月龄以上);Ⅱc型,α角43°~49°,β角<77°,为髋臼发育不良;D型,α角43°~49°,β角>77°,为髋关节半脱位;Ⅲ型,α角<43°,β角>77°,为髋关节脱位伴髋臼窝变浅,股骨头着力在髋臼软骨顶,盂唇、软骨盂唇向头侧移位;Ⅳ型,α角<43°,β角>77°,为髋关节脱位伴髋臼窝显著变浅、畸形,股骨头着力不在髋臼软骨顶,盂唇、软骨盂唇位于股骨头和髋臼之间。但超声检查对检查医师的技术、患儿的配合程度和体位、机器的清晰度要求较高[71]。
推荐意见8:与选择性筛查相比,普遍筛查具有更多的临床获益和更高的社会价值(证据等级C,强推荐)。
既往对使用超声进行新生儿普遍筛查还是选择性筛查颇有争议。有研究表明,采用超声进行婴儿的髋关节普遍筛查和选择性筛查在诊断晚期DDH时差异有统计学意义[57,72]。Holen等[72]研究显示,普遍筛查检出的晚期病例率为0.13‰,选择性筛查检出的晚期病例率0.65‰,两者差异无统计学意义。虽然不对所有的婴儿进行DDH普遍筛查可能会使那些没有危险因素且临床查体正常的DDH患儿漏诊,并导致其治疗困难及更高昂的治疗花费,但普查也意味着需要更大的资源投入[57,72];此外,普遍筛查中发现的异常患儿有相当一部分可自行恢复正常,假阳性伴随的过度治疗可能继发股骨头坏死等顾虑,也限制了普遍筛查的开展。
但越来越多的研究表明,普遍筛查可有效减少保守治疗和手术治疗的需求、并降低治疗难度,因此间接降低了社会总体经济负担[73]。奥地利于1992年开始了普遍筛查模式,使得DDH切开复位率由1992年的0.35%下降到2004年的0.13%,相应治疗费用下降约20%[74]。因此,推广婴儿髋关节超声早期筛查符合卫生经济学的成本效益原则[75]。同时,通过选择筛查时间点、优化超声诊断图像和把握治疗原则,可有效降低DDH诊断的假阳性率和过度治疗导致的风险[76]。
我国部分地区也实行了髋关节超声的早期普遍筛查。以天津市的普遍筛查模式为例,区、县的妇幼机构先进行初筛,对初筛阳性或疑似DDH者进行复筛,若仍为异常则转诊小儿骨科进行确诊和治疗。实践证明,这种初筛-复筛-确诊的模式,对避免漏诊和及时正确的治疗具有积极意义[77]。尤其在我国,各地DDH的发病率差异较大,在一些重点地区进行普遍筛查或可有效促进DDH的预防工作[78, 79],不仅可减少残疾的发生、对提高人口素质也有重要意义[46,80]。在临床工作中,多数学者建议将出生后的筛查时间定在6周龄,可降低生理性髋关节不成熟导致的假阳性,并配合产妇常规复诊时间[81]。此外,对于有高危因素的新生儿,即使超声筛查正常,仍需要在其生长过程中跟踪随访,以便及时发现可能出现的问题[69]。
推荐意见9:在诊断DDH时,幼儿需注意与继发型髋关节脱位相鉴别,如畸胎型和神经肌肉型髋关节脱位;成人需与其他引起双下肢不等长及髋关节疼痛的疾病相鉴别,如股骨头坏死、髋关节骨关节炎等(证据等级D,弱推荐)。
根据疑似DDH患者的病史、症状、体征、影像学表现及实验室检查可作出相应的综合判断,应注意与其他能引起关节疼痛、活动受限的疾病相鉴别[82]。
幼儿期DDH主要需要与继发型髋关节脱位相鉴别,如畸胎型和神经肌肉型髋关节脱位[83]。畸胎型髋关节脱位是在出生前不明原因造成的胚胎损伤,出生时表现为非常明显的髋关节畸形伴有髋关节完全脱位[84],髋臼窝小而浅、且充满纤维脂肪组织,髋关节活动受限较DDH更为严重,无法行Ortolani试验[82];此外,常伴有其他严重的畸形,如脊柱裂、Larsen综合征、畸形侏儒症、先天性多关节挛缩等[85]。神经肌肉型髋关节脱位主要继发于脑瘫或先天性脑膜膨出症,是由于中枢神经系统病变导致肌肉张力异常、长时间异常应力引发髋关节骨性结构发育不良,进而导致髋关节失稳甚至脱位[86]。
成人DDH需与其他引起双下肢不等长及髋关节疼痛的疾病相鉴别,如股骨头坏死、髋关节骨关节炎等。成人DDH可合并有股骨头坏死及骨关节炎的表现,但通过X线片上对髋臼发育不良的指标进行测量通常可明确诊断,必要时可辅以CT或MRI检查[87]。
推荐意见10:DDH的分型是指导治疗方案选择的重要依据,儿童与成年人的DDH具有各自不同的分型特点。儿童DDH常用的分型系统主要有Tönnis分型和国际髋关节发育不良协会(International Hip Dysplasia Institute,IHDI)分型;成人常用的分型系统主要有Crowe分型和Hartofilakidis分型(证据等级B,强推荐)。
儿童DDH常用的分型系统主要有Tönnis分型[88, 89]和IHDI分型[89]。
Tönnis分型是基于股骨头骨化核与髋臼的相对位置进行分型:过髋臼外上缘作双侧髋臼外上缘连线(superolateral margin of the acetabulum,SMA)的垂线为Perkins线(P线),SMA线与P线垂直相交形成四个象限。股骨头骨化核位于内下象限为Ⅰ度、位于外下象限为Ⅱ度、与SMA线接触为Ⅲ度、位于外上象限为Ⅳ度(图1)。
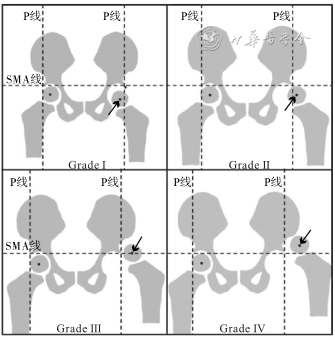

注:SMA线为双侧髋臼外上缘连接;P线为过髋臼外上缘且垂直于SMA线的Perkins线
由于DDH患儿股骨头骨化核出现延迟,并且存在偏心可能,IHDI提出了基于股骨近端干骺端中心与髋臼相对位置的分型系统。IHDI分型:双侧Y形软骨上方髂骨下缘的连线为Hilgenreiner’s线(H线),过髋臼外上缘做Hilgenreiner’s线的垂线为Perkins线(P线),二者构成的外下象限的角平分线为D线。股骨近端干骺端中点位于P线的内侧或P线上为Ⅰ度、位于P线之外但不超过D线之间为Ⅱ度、位于D线之外但不超过H线之间为Ⅲ度、位于H线之上为Ⅳ度(图2)。
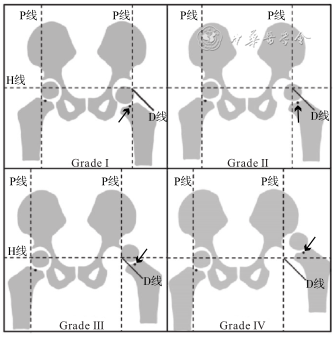

注:H线为双侧Y形软骨上方髂骨下缘连线Hilgenreiners线;P线为过髋臼外上缘且垂直于H线的Perkins线;D线为H线与P线构成的外下象限的角平分线
成人DDH目前已有多种分型系统,其中最常用的是Crowe分型系统[90]。Crowe分型是一种定量分型,基于股骨头移位距离与股骨头及骨盆高度的比例将DDH分为4种不同类型(表3)。另一种常用的成人DDH分类系统由Hartofilakidis等[91]提出。与Crowe分型不同的是,Hartofilakidis分型是一种定性分型,它依据髋关节的X线表现分为发育不良、低脱位和高脱位(表4)。

成人发育性髋关节发育不良Crowe分型系统
成人发育性髋关节发育不良Crowe分型系统
| 分型 | 股骨头移位距离/骨盆高度 | 股骨头移位距离/股骨头高度 |
|---|---|---|
| Crowe Ⅰ | <10% | <50% |
| Crowe Ⅱ | 10%~<15% | 50%~<75% |
| Crowe Ⅲ | 15%~<20% | 75%~<100% |
| Crowe Ⅳ | >20% | >100% |

成人发育性髋关节发育不良Hartofilakidis 分型系统
成人发育性髋关节发育不良Hartofilakidis 分型系统
| 分型 | 脱位程度 | 亚型 |
|---|---|---|
| 髋臼发育不良 | 可有不同程度半脱位,但股骨头仍位于真臼内 | A |
| 低脱位 | 股骨头位于假臼内,假臼下缘仍与真臼上缘部分重叠 | B1:假臼与真臼重叠>50%,接近A型; B2:假臼与真臼重叠<50%,接近C型 |
| 高脱位 | 股骨头位于假臼内,且与真臼无接触 | C1:股骨头完全位于假臼中; C2:无假臼形成,股骨头位于臀大肌中 |
推荐意见11:早诊断、早治疗,并依据患者年龄、性别、病变程度等采用阶梯化与个体化治疗方案,早期争取实现髋臼与股骨头的同心圆复位和髋关节发育,晚期则进行髋关节结构和功能的重建(推荐强度GPS)。
DDH发现的越早,治疗的效果越好。有研究显示,8岁时才对DDH进行治疗其获益并不优于不治疗[92]。因此,早发现、早诊断是治疗的关键。无论何时诊断DDH,其治疗目标均为同心圆复位、重建髋关节稳定性和功能;其所需的治疗方法因患者诊断时的年龄、髋关节病变严重程度而异[93]。应根据患者具体情况建立阶梯化治疗方案,方案包括疾病宣教、挽具治疗、药物治疗、矫正性手术治疗及重建手术治疗等[94]。
对于幼儿期患者,恢复髋关节的同心圆复位最为重要,可为纠正股骨头和髋臼发育异常创造条件,因此常以闭合或切开复位为主,辅以挽具或截骨手术。即使是在髋关节发育完全的较年长青少年期患者,同心圆复位仍有助于预防或延迟髋关节骨关节炎的发生[95]。股骨头和髋臼均具有生长和重塑能力,如果能够维持同心圆复位,则可使DDH的病理变化随时间推移逐渐好转[96]。研究表明,髋臼重塑最晚可持续至11岁[97],脱位的髋关节复位后4~6年达到最大限度的髋臼重塑[98]。
青少年及年轻成人中由于可能已经接受过早期的DDH治疗,其病理改变更为复杂[99],尤其需要考虑既往治疗史。目前,多认为青少年及年轻成人DDH的评估逐渐向成人保髋的标准靠拢,需要细致分析每个病例髋关节畸形特点,以决定恰当的干预时机和干预措施[100]。
DDH长期非手术治疗的效果并不十分清楚,主要受制于DDH进展成终末期髋关节骨关节炎的不确定性[101, 102]。成人DDH由于长时间的头臼覆盖不良、局部应力增高、磨损加剧,常伴发髋关节骨关节炎,因此,其治疗策略是改善髋关节稳定、缓解疼痛、挽救髋关节功能。运动疗法、物理治疗、非甾体抗炎药乃至手术都有助于缓解症状[102]。临床医师需要针对以下几个方面对DDH患者进行评估:(1)DDH程度评估,需了解并评估受累关节的疼痛和功能状况;(2)合并疾病评估,特别是有无肥胖、营养不良、糖尿病等合并疾病;(3)环境心理评估,包括患者的社交状态、心理预期,以及是否存在睡眠不良、抑郁或焦虑等情况;(4)治疗风险评估,特别是拟对患者进行药物镇痛治疗时,需要了解镇痛治疗的心血管风险和胃肠道风险;(5)患者具体情况、主观意愿及预期评估。详细的评估目的在于改善症状、提高生活质量、延缓疾病进展、避免过度治疗,使处于不同疾病阶段和程度的DDH患者获得最适合自身病情的个体化治疗方案[94]。
推荐意见12:临床医师应谨慎评估患儿症状及相关检查结果,并根据DDH患儿的年龄、分型选择相应的治疗方案(推荐强度GPS)。
(1)0~6月龄患儿:在此时期的治疗主要通过获得同心圆复位后,应用髋关节屈曲外展挽具或支具维持髋关节稳定、改善髋关节发育[103]。1月龄以下的婴儿髋关节脱位较少见,但髋关节不稳定较为常见[104]。在发现患儿有髋关节不稳的阳性体征后是否应立即开始支具治疗目前存在互相矛盾的证据[105]。研究表明,高危患儿在2~6周龄时超声检查异常并随机接受 Pavlik 挽具治疗或持续观察,虽然3个月随访时超声测量的髋臼覆盖率支具固定组更优,但X线测量的髋臼指数没有差异[106]。因此,对于体格检查发现髋关节不稳定或松弛的新生儿患儿,可于1月龄后复查以避免过度诊断和治疗[105];若体格检查髋关节稳定但超声表现异常、或存在DDH的危险因素,可于6周龄时复查超声[12,50]。
对3月龄以内、临床查体阴性但超声检查异常,即Graf Ⅱa型患儿的治疗仍存在争议[107],但更多研究倾向于积极治疗。经超声筛查为Graf Ⅱa、Ⅱb、Ⅱc型,不论是否存在髋关节不稳定的表现,均应从6周龄开始Pavlik挽具或其他支具治疗;不同地区采用支具有所不同,Pavlik挽具是研究最为充分且最常使用的支具[93]。开始治疗时每日佩戴23 h(仅洗澡时可摘除)、每6周进行复查,待髋关节稳定后可改为仅睡眠时佩戴,继续治疗6周[108];如佩戴Pavlik挽具超过9个月仍残留发育不良,则应考虑改用固定外展支具治疗[15]。
对Graf D、Ⅲ、Ⅳ型脱位的髋关节,治疗开始时间应更早、治疗期间复查需更频繁,且治疗成功率偏低,目前正在探索新的治疗策略[109]。此类患儿应在2周龄即开始Pavlik挽具治疗,并每3周复查1次。如髋关节可稳定复位,则继续Pavlik挽具治疗至体格检查、超声、X线片均显示正常[93];如髋关节可复位但不稳定,或Pavlik挽具治疗9个月后仍未恢复正常,则应更换为固定外展支具[110];如Pavlik挽具治疗3周后仍无法复位,则应考虑闭合或切开复位并予人类位石膏固定[15],同时应警惕后外侧髋臼侵蚀和发育异常(Pavlik病)[111]。
(2)6月龄至1.5岁患儿:治疗目标仍是恢复并维持同心圆复位。目前对这一时期非完全脱位DDH的研究证据十分有限,对单纯髋臼的发育不良可随访观察或在夜间佩戴外展支具进行治疗[112],对髋关节半脱位应予外展支具并每3个月复查1次[93]。对大于6月龄的患儿应用Pavlik挽具治疗,其复位的成功率较低,且发生股骨头坏死的风险较高[113]。因此,对脱位的髋关节行麻醉下闭合复位是首选;如闭合复位失败或复位后不稳定,可结合髋关节造影决定是否进行切开复位。复位后应采用人类位石膏固定以维持复位、促进髋臼发育[114]。人类位石膏固定时间为3个月,可每6周复查1次并更换石膏[115];随后更换为硬质外展支具持续固定3~6个月、再间断固定至复查正常[15]。
对治疗后复位失败、再脱位、或仍有残余畸形者,可择期行截骨手术[98]。
(3)1.5~6岁患儿:在患儿站立行走后,髋关节的力学负荷增加导致脱位的程度更大、软组织挛缩更重。此时仍可以尝试闭合复位,但成功率不高,即使成功也常残余部分发育不良[116],因此常需要手术治疗。对IHDI Ⅲ度以上、身高超过80 cm、体质量>10 kg、髋臼指数>40°的患儿,采取一期切开复位联合截骨手术治疗,可能预后更好[117]。
髋关节复位越早,手术预后越好、获益越大。大龄儿童往往已经开始出现股骨头畸形,将导致同心圆复位的可能性下降并增加骨质坏死的风险[118]。手术中可能需要同时进行髂腰肌和内收肌松解、关节囊成形、髋臼截骨、股骨短缩和去旋转化截骨等[119, 120]。在此时期需格外关注手术的风险,包括骨坏死、股骨近端生长障碍、残余发育不良以及需要二期手术等。
(4)6岁以上患儿:包括未诊断、已诊断未治疗和已治疗的大龄儿童和青少年。由于此时髋关节已基本失去重塑潜力,因此,对于无法通过切开复位和重建治疗的症状性DDH应予挽救性手术,以减少残余畸形、改善髋关节生物力学环境,达到缓解疼痛、延缓退变的目的[121, 122, 123]。青少年和成人时期主要采用髋臼周围截骨术(bernese periacetabular osteotomy,PAO)、三联截骨术、髋臼加盖成形术等,其中以PAO最为常用[124]。文献报道,PAO可很好地达到“保髋”目的,以患者接受THA为终点,18年生存率可以达到74%[125]。
推荐意见13:DDH确诊患儿选择支具的类型仍存在争议,在使用支具治疗DDH期间应进行定期体格检查和影像学评估(证据等级D,弱推荐)。
目前应用最广、研究最多的是Pavlik挽具,其临床疗效确定,并发症较少且轻微[44];其禁忌证主要包括神经肌肉疾病导致的肌力不平衡、多发关节挛缩、韧带松弛等。其他常见支具还有Von Rosen支具、Craig支具、Frejka支具等。目前仍缺乏不同类型的支具治疗DDH的高质量比较研究。硬质支具可能比软质支具有更好的临床预后[126];虽然硬质和软质支具均存在相对未知的潜在风险[127],但硬质支具可能导致更多股骨头坏死等并发症的风险[126]。
开始支具治疗后,在治疗期间应定期对患者进行体格检查和影像学重新评估,根据评估结果修改治疗持续时间甚至治疗计划,以避免出现复位失败或持续性的发育不良[110]。
推荐意见14:单纯关节镜手术用于治疗DDH无明确的临床获益,可作为辅助术式联合PAO;还可用于临界DDH(borderline DDH,BDDH)中盂唇损伤和撞击的治疗(证据等级D,弱推荐)。
髋关节镜手术用于治疗DDH需非常谨慎,因为DDH中髋关节软骨、盂唇的病变通常很复杂,如果潜在的病变在术中未得到纠正,很可能会复发或导致病情进展[128, 129],甚至有可能导致医源性的髋关节不稳定[130]。Byrd和Jones[131]对48例因DDH接受髋关节镜手术的患者进行了1年的随访,其中24例患者的症状未能得到改善,14例患者出现骨关节炎的表现。目前,关节镜手术更为理想的作用可能是作为PAO的辅助术式,以改善术中对软骨、盂唇和股骨近端手术视野的显露;在关节镜探查中,如发现髋臼负重部分显著的关节炎改变,也可确定为不适合后续PAO手术的患者[132]。
BDDH患者的数量较DDH更多[133]。在DDH治疗中,对于尚不需要采用截骨手术治疗的BDDH患者,目前髋关节镜手术应用最广,并充满争议[134]。髋关节稳定的BDDH患者合并股骨颈Cam畸形时,多数需要髋关节镜手术治疗[135],镜下最常见的处理方式是盂唇修复、Cam成形及关节囊缝合;术后短中期的随访获得了令人满意的结果[131,136, 137],并且与PAO相比术后并发症更少,仅为3.3%[138]。但也有学者认为,髋关节镜治疗只是改善了BDDH中软组织带来的问题,即髋关节的次要稳定,并没有解决与异常骨形态相关的生物力学问题[128]。如一项纳入了28个研究的系统评价结果表明[139],髋关节镜手术治疗 BDDH 后,短期并发症发生率较低,但患者年龄过大、股骨前倾角过大以及髋臼前方覆盖不足都是导致预后不佳的危险因素。目前,仍缺乏多中心、大样本量的长期随访证据来明确髋关节镜手术在BDDH中的优势[134],多数学者认为选择合适的患者是髋关节镜治疗BDDH成功的关键[140]。结合文献报道及专家意见[141, 142, 143],推荐髋关节镜治疗BDDH的适应证为:(1)中青年患者且无髋关节骨关节炎表现;(2)主要由于盂唇撕裂、圆韧带撕裂、关节囊松弛等导致的软组织性髋关节不稳及疼痛症状;(3)合并有股骨髋臼撞击,尤其是Cam畸形。患者具有以下因素则可能预示髋关节镜手术效果不佳[144, 145, 146, 147, 148, 149, 150, 151]:(1)高龄;(2)肥胖;(3)有髋关节不稳定的表现;(4)明显的股骨畸形,如颈干角>135°、前倾角>25°;(5)过度增生肥大的盂唇及髋臼侧软骨损伤[152]。
推荐意见15:截骨手术应根据患者的年龄、症状、畸形程度选择合适的手术方案(证据等级C,强推荐)。
幼儿期DDH截骨的目的是辅助切开复位以恢复髋臼和股骨头的同心圆结构,如复位后髋关节仍不稳定则需截骨;成人DDH截骨的目的则是增加股骨头覆盖以改善功能、延缓骨关节炎的发生。
DDH的截骨手术包括骨盆截骨和股骨截骨两部分。骨盆截骨手术可大致分为以下3种:(1)改变髋臼方向的截骨,如Salter截骨、三联截骨、PAO;(2)改变髋臼形态的截骨,如Pemberton截骨、Dega截骨;(3)姑息性截骨,如Chiari截骨术、造盖术。股骨截骨术包括短缩、内翻和去旋转矫正。
Salter截骨术完全截断髂骨,以耻骨联合为支点将髋臼部分向前移位并同时向前外侧旋转[153],可用于18个月~6岁的DDH患儿,但不适用于髋臼指数较大的DDH患儿[154],也不建议同时行双侧Salter截骨术[155]。对于髋臼容积增加或髋臼顶倾斜度加大(髋臼指数>40°)的患者,可选择Pemberton或Dega髋臼成形术,二者不完全截断髂骨,分别以Y型软骨和骨盆后柱为支点旋转;由于DDH主要是髋臼前外侧对股骨头包容不足,因此Pemberton术更常用[129]。3~4岁的DDH患儿可考虑髋臼侧截骨术联合股骨截骨术[130];4~8岁的患儿采用髋臼侧截骨术依然可能有效,但一定要联合股骨截骨[131]。
对于年龄较大的青少年或成人DDH患者,应用三联截骨或PAO对DDH病理改变的纠正更为彻底,可通过增加负重的透明软骨面积以达到延缓DDH进展的目的。三联截骨同时截断髂骨、耻骨以及坐骨以获得更大的移动度和旋转度[156],其中Tönnis改良三联截骨术的矫形能力强大、中远期疗效良好[157]。PAO手术则在彻底矫正畸形的基础上,改善髋臼对股骨头的覆盖[158],保留完整的髋臼后柱以可实现术后早期活动,对截骨块的控制也更为精准[159]。PAO手术的适应证为:(1)髋关节骨关节炎 Tönnis 0~Ⅱ期,伴有髋关节疼痛;(2)头臼吻合度好;(3)髋臼外侧中心边缘角<20°、髋臼顶倾斜角>10°、髋臼前方中心边缘角<20°、股骨头超出指数>25%中,至少存在一项;(4)髋关节活动度好(屈曲≥100°、外展≥30°)[113,160]。对于存在严重髋关节残余畸形的青少年和年轻成人DDH患者,可采用姑息性截骨手术,如骨盆内移截骨术等[98]。
股骨截骨手术的主要目的是降低头臼之间的压力、恢复股骨颈前倾角和颈干角、平衡软组织张力、矫正下肢力线[20],一般应用于2岁以上的DDH患儿。应根据股骨侧畸形类型及严重程度来选择合适的截骨方案,有多种股骨侧截骨方式可供选择,包括短缩、内翻、去旋转截骨等。短缩截骨可降低髋关节复位难度以避免髋关节过度牵拉造成神经损伤[161]。内翻及去旋转截骨可矫正过大的股骨颈前倾角及颈干角、改善头臼匹配;但应避免过度内翻导致的股骨偏心距过大和髂腰肌与髋臼的撞击。
近些年手术机器人和计算机辅助导航的应用得到了越来越多的关注,这些技术在一定程度上使得DDH的诊断和截骨手术规划更加精准,未来将有希望解决截骨手术创伤大、学习曲线长等问题[152]。
推荐意见16:当继发髋关节骨关节炎导致疼痛、活动受限时可考虑行THA手术(证据等级C,弱推荐)。
髋关节表面置换(hip resurfacing arthroplasty,HRA)的应用一直存在较多争议。相较于THA,HRA的优势在于有更好的术后功能、更低的脱位率和能够保留更多骨量,理论上对于年轻的DDH患者具有一定的优势[162]。但是,HRA无法纠正股骨畸形、无法调整髋关节旋转中心、术后较多的磨损相关并发症(全身金属离子水平升高、局部组织不良反应等)限制了该术式的应用[163],因此在国内HRA较少开展。DDH有明显的异常病理结构改变,如髋臼变浅、股骨头变小、股骨颈前倾角增大、双下肢长度差异等,因此从操作技术角度来看,HRA的操作更加复杂;并且,由于股骨头颈的阻挡,髋臼的直视定位更加困难[162]。目前,国内外学者普遍认为,对DDH患者实施HRA的适应证有以下两个:(1)Crowe Ⅰ~Ⅱ型或Hartofilakidis分型中半脱位和低脱位的DDH患者,要求髋臼形态及股骨头上移不能变化太大,除手术难度的因素外还可能与表面置换无法有效延长肢体长度有关;(2)股骨髓腔形态异常而无法置入常规股骨柄的DDH患者。对于后者,既往如需THA,只能采取劈开股骨并捆扎、应用髓腔延长杆、定制假体等方法,HRA使得股骨侧的处理变得简单[164]。目前关于HRA治疗DDH的研究仍较少,需要更多高质量的临床研究以明确其有效性和安全性。
DDH患者接受THA的平均年龄远低于非DDH患者,在Hartofilakidis等[165]的一项研究中,DDH患者疼痛发作的平均年龄为34.5岁、出现高位髋关节脱位的平均年龄约为31岁。由于此类患者通常比较年轻,所以THA的选择需要非常慎重。DDH患者选择THA的适应证为:严重的髋关节脱位(Crowe Ⅲ或Ⅳ型)、股骨头明显变形、关节间隙狭窄或严重的髋关节骨关节炎;当出现因DDH继发下肢运动功能障碍、脊柱侧凸畸形等其他病变时可适当放宽THA的年龄要求[166]。
DDH患者行THA手术最常见的并发症包括假体无菌性松动、术后脱位、聚乙烯内衬磨损、术中骨折、神经损伤、股骨截骨不愈合等[20]。假体无菌性松动是导致翻修的最主要原因,尤其是活动量较大的年轻患者[167];因此,需要根据患者年龄、体质量和髋臼骨质条件选择最合适的摩擦界面[168]。术者需进行详细的术前规划,并在术中仔细操作,以避免相关并发症[20]。
推荐意见17:DDH患者接受THA时应注意髓腔形态和异常增大的前倾角,以选择合适的股骨柄假体(证据等级C,强推荐)。
DDH患者常伴有较大的股骨前倾角变异,因此,在THA中需要注意纠正异常的股骨前倾角。常用的纠正方法包括股骨截骨术、水泥型股骨柄假体、带凹槽的圆锥形股骨柄、组配型股骨柄假体以及个体化定制的股骨柄[169, 170, 171, 172]。需要注意的是,常规股骨柄假体用于DDH患者常常由于假体尺寸过大导致假体位置不佳,甚至出现股骨骨折[173],因此,需要准备尽可能小的股骨柄假体。
选择股骨柄假体时需要充分考虑患者的髓腔形态,全涂层的假体在临床应用中取得了令人满意的效果,在初始稳定性良好和充分骨长入的前提下,尤其适用于年轻和活动量较大的患者,但假体近端应力遮挡的问题仍值得关注[174]。严重畸形的DDH患者可考虑选用组配式股骨柄以调整股骨长度和偏心距,但这种假体价格较高,且存在假体强度不足及组配界面腐蚀的风险[175]。定制型股骨柄假体可能是未来的发展趋势,但其制作的时间较长,且一旦在术中出现不匹配将会出现进退两难的情况[17]。必要时可以考虑骨水泥型股骨柄假体,但存在截骨部位骨水泥渗漏和假体寿命较短的隐患。
推荐意见18:年轻的DDH患者行THA时,在条件允许的情况下应优先选择陶瓷对陶瓷或陶瓷对高交联聚乙烯界面(证据等级C,强推荐)。
假体摩擦界面的选择应结合界面寿命、界面相关并发症和骨床条件等因素个性化综合考虑:DDH手术患者往往较年轻,应尽可能选择使用低磨损率的假体界面;假体界面相关的并发症主要是假体周围骨溶解和头-颈界面侵蚀;DDH患者骨发育异常,骨量不足和骨缺损等因素限制了假体尤其是髋臼假体的尺寸和安装方向。
文献证据显示目前陶瓷对陶瓷界面的摩擦寿命最长,陶瓷磨屑引起假体周围骨溶解的可能性也低于聚乙烯,因此术中条件允许时,陶瓷对陶瓷界面应当作为年轻患者的首选[176]。聚乙烯内衬的防脱位高边可在需要的方向上增加5°~10°的股骨头覆盖,如术中判断脱位风险较高时可使用防脱位高交联聚乙烯内衬增加稳定性[177]。此外,如髋臼骨量不足以置入足够大的髋臼假体,由于无法获得相匹配的小尺寸陶瓷内衬,因而不能安装陶瓷内衬时,也可选择高交联聚乙烯内衬。
推荐意见19:DDH高脱位的患者接受THA时,为了实现恢复真臼位置、重建软组织生物力学功能的理想疗效,必要时可选择股骨截骨(证据等级C,弱推荐)。
DDH患者股骨侧发育不良往往导致股骨近端畸形,使用普通假体可能增加股骨周围骨折、术后脱位等风险[173]。在THA治疗高脱位DDH(如Crowe Ⅳ型,短缩>4 cm)时,为了实现复位至真臼内并避免神经牵拉损伤[178],进行股骨截骨常常是十分必要的[17]。股骨截骨可分为转子下截骨、大转子截骨和小转子截骨[179]。
转子下截骨可有多种方式,如横形截骨、斜形截骨、V形截骨、Z形截骨和S形截骨等。在以上截骨方式中,横形截骨因其效果确切、操作简单、容错率高等优势最为常用[179]。生物力学研究显示,横形截骨、斜形截骨、V形截骨三者的稳定性相当[180]。Z形和S形截骨理论上可以兼顾更大的股骨旋转角度和更多的截骨接触面,但临床上观察其并未显示出更好的疗效,相反因其复杂的操作步骤和更长的截骨线增加了骨折的风险[181]。一项纳入了37个临床研究、795个髋关节的Meta分析结果显示,横形、斜形、V形、Z形截骨等在截骨面愈合、神经损伤、术后脱位、翻修率等指标上并无差别[182]。Chen等[183]采用长斜形宽大截骨面结合股骨大转子内侧凹槽状截骨,可获得与转子下斜行截骨相似的短期效果,并具有初始稳定性好、方便调整外展肌力臂、松解软组织挛缩等优势。Wang等[184]报道转子下横形截骨结合组配式假体的10年随访疗效满意。
大转子截骨术通过截断大转子并重新固定,可以在THA术中更好地暴露术野、并获得更理想的外展肌力臂[185]。但是,有临床研究表明,大转子截骨术可能导致较高的截骨面不愈合率[186]。小转子截骨术则相对较少应用,因为小转子截骨对股骨长度的改变有限、同时可能导致外展肌无力[187]。
由于DDH患者股骨形态异常和软组织状况的变异非常大,因此,目前还没有一个能够处理所有复杂病例的普适性或通用的术式。术者需要综合考虑多种因素,包括髋关节脱位程度、骨骼畸形情况、术前软组织张力、髋关节外展肌群功能、下肢长度差异等制定手术方案[188, 189, 190, 191, 192]。同时,需注意过量的截骨可能破坏股骨近端的髓腔结构,导致术后骨不连、股骨柄失稳等并发症[193]。
推荐意见20:DDH患者接受THA时应尽可能将髋臼假体置入真臼的位置,适当上移同时内移髋臼假体的位置是可以接受的(证据等级C,强推荐)。
DDH的髋臼侧常存在骨量不足,尤其是上外侧,因此获得初始稳定性和足够骨长入至关重要[194]。对于严重的骨缺损,可使用骨水泥、自体骨移植、多孔金属垫块、内移截骨、加强环等技术进行处理[195, 196, 197, 198]。取得良好远期效果的关键是:置入物的初始机械稳定性、置入物与宿主骨之间良好的压配表面以及假体表面涂层[17]。生物型髋臼假体最为常用,理想的假体表面涂层应当具有高孔隙率、合适的孔隙大小、较低的弹性模量以及足够的表面粗糙度。现有的多孔金属髋臼杯,如骨小梁金属髋臼杯、钽金属髋臼杯等均取得了良好的临床效果[199]。
髋臼假体的位置决定了重建后髋关节的旋转中心,进而影响髋关节生物力学、下肢长度和股骨重建。虽然直接在假臼置入髋臼假体在技术上比真臼重建更容易,但可能导致较高的脱位率、关节假体应力过高、外展肌功能不全[200]。一项10年的随访研究表明,一般身高的患者臼杯上移超过25 mm将显著增加内衬磨损速度和假体松动率[201]。因此,应当尽可能在真臼内置入髋臼假体。
国内周建生等[202]研究发现,在对髋臼发生明显病理变化的CroweⅢ型DDH病例施行THA时,术中仔细解剖、清除骨赘复原出真臼髋臼窝及髋臼切迹解剖结构,并以此定位髋臼中心,可以实现解剖位准确置入髋臼假体,并获得良好的初始稳定性和假体覆盖率,影像学量化评分优良率94.56%。
也有研究表明,适当上移同时内移髋臼假体的位置也是可以接受的,此技术可增加髋臼杯的宿主骨覆盖、改善臼杯的稳定性、降低翻修率[203],但应当注意选择合适的股骨柄假体以重建股骨偏心距及外展肌力臂[17]。此外,该技术对术者手术技巧、适应证具有较高的要求[204],同时也增加了髋臼骨折、假体骨盆内脱位的并发症风险,需慎重选择。
近年来,手术机器人的临床应用可为DDH高难度THA手术提供个性化的术前计划、实时的术中导航、准确的假体定位和软组织平衡。国内Chai等[205]研究表明,对于CroweⅢ~Ⅳ型的THA手术,手术机器人辅助可显著改善髋臼假体的置入位置。
本指南制定专家委员会名单
执笔者:张洋(南方医科大学南方医院骨科)
指导专家:王坤正(西安交通大学第二附属医院骨科);史占军(南方医科大学南方医院骨科);胡永成(天津医院骨与软组织肿瘤科);周建生(蚌埠医学院第一附属医院骨科);张洪(解放军总医院第四医学中心骨科医学部);陈晓东(上海交通大学医学院附属新华医院骨科)
编写专家(以姓名汉语拼音排序):曹力(新疆医科大学第一附属医院);范卫民(南京医科大学第一附属医院);胡懿郃(浙江大学医学院附属第一医院);黄伟(重庆医科大学附属第一医院);金群华(宁夏医科大学总医院);刘军(天津医院);刘强(山西大医院);吕松岑(哈尔滨医科大学附属第二医院);毛新展(中南大学湘雅二医院);钱齐荣(上海长征医院);曲铁兵(中国康复研究中心北京博爱医院);尚希福(中国科学技术大学附属第一医院);盛璞义(中山大学附属第一医院);孙水(山东省立医院);田华(北京大学第三医院);田晓滨(贵州省人民医院);王飞(河北医科大学第三医院);王健(南方医科大学南方医院);夏春(厦门大学附属中山医院);夏亚一(兰州大学第二附属医院);肖骏(华中科技大学同济医学院附属同济医院);许建中(郑州大学第一附属医院);许鹏(西安市红会医院);姚振均(复旦大学附属中山医院);尹宗生(安徽医科大学第一附属医院);张文明(福建医科大学附属第一院);张先龙(上海交通大学附属第六人民医院);赵建宁(解放军东部战区总医院);周宗科(四川大学华西医院);朱裕昌(上海市第十人民医院)
审定专家(以姓名汉语拼音排序):陈伯华(青岛大学附属医院);高曙光(中南大学湘雅医院);高忠礼(吉林大学中日联谊医院);海涌(首都医科大学附属北京朝阳医院);郝定均(西安市红会医院);马信龙(天津医科大学总医院);邵增务(华中科技大学同济医学院附属协和医院);沈彬(四川大学华西医院);孙天胜(解放军总医院);王跃(四川省人民医院);徐卫东(海军军医大学附属长海医院);杨柳(陆军军医大学第一附属医院);张寿(海口市人民医院);赵杰(上海交通大学医学院附属第九人民医院);郑秋坚(广东省人民医院)
中华医学会骨科学分会关节外科学组. 中国发育性髋关节发育不良诊疗指南(2023版)[J]. 中华解剖与临床杂志, 2023, 28(8): 493-511. DOI: 10.3760/cma.j.cn101202-20230612-00145.
所有作者声明不存在利益冲突



























本文中,第497页第二栏第八行中“α角≤60°”更正为“α角≥60°”。更正的同时表示歉意!