
研究肥大细胞在特应性皮炎(AD)表型及2型炎症因子释放的免疫活化中的作用。
9份AD皮肤样本来自西安交通大学第二附属医院皮肤科,9份健康皮肤对照样本来自西安交通大学第二附属医院骨外科手术切除多余正常皮肤,对其进行甲苯胺蓝染色和荧光染色,明确AD皮损中肥大细胞脱颗粒活化状态。通过野生型小鼠足趾肿胀渗出实验,探究卡泊三醇(MC903)能否在体内直接激活肥大细胞;利用野生型和KitW-sh/W-sh肥大细胞缺失小鼠构建MC903-AD模型,以探究肥大细胞是否影响AD小鼠的表型、组织病理及2型炎症因子水平;提取小鼠腹腔原代肥大细胞,通过钙成像、类胰蛋白酶和β-氨基己糖苷酶释放实验、单核细胞趋化蛋白-1(MCP-1)和趋化因子CXC配体-2(CXCL-2)释放检测等,探究MC903体外激活肥大细胞释放炎症介质能力。
与健康对照相比,AD患者皮损中处于活化状态的脱颗粒肥大细胞数目较健康对照组增多,分别为(5.40±1.14)和(2.20±0.84)个(P<0.001)。与野生型AD小鼠相比,KitW-sh/W-sh肥大细胞缺失AD小鼠的表型减轻,小鼠AD指数评分(ADI)分别为(10.00±0.89)和(5.50±1.05)分(P<0.001),且2型炎症因子释放减轻,白细胞介素(IL)-4水平分别为(29.50±1.87)和(15.33±1.86)pg/mg(P<0.001),IL-13水平分别为(6.32±0.25)和(3.93±0.22)pg/mg(P<0.001),IL-31水平分别为(9.73±0.38)和(6.89±0.27)pg/mg(P<0.001),TSLP水平分别为(206.00±4.43)和(99.00±4.86)pg/mg(P<0.001)。MC903在体内注射可以导致小鼠足趾肿胀。MC903可以在体外激活肥大细胞。
AD患者皮损中活化的肥大细胞数目较健康对照组增多;KitW-sh/W-sh肥大细胞缺失AD小鼠的表型、组织病理和2型炎症因子水平较野生型AD小鼠明显减轻;MC903可在体内和体外激活肥大细胞。肥大细胞在AD表型、免疫活化中均起到关键作用。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
特应性皮炎(atopic dermatitis,AD)是一种慢性反复发作的炎症性皮肤病,影响15%~20%的儿童和高达10%的成人[1]。AD常常伴有过敏性哮喘、过敏性鼻结膜炎和其他直接的过敏性疾病[2]。AD的发病机制复杂,涉及遗传和环境因素、免疫失调、微生物失衡、皮肤屏障功能紊乱和环境中的皮肤炎症诱因之间的相互作用。2型辅助型T(T helper 2,Th2)细胞主导的反应被认为是AD的炎症核心,相关的2型细胞因子包括白细胞介素(interleukin,IL)-4、IL-13和胸腺基质淋巴生成素(thymic stromal lymphopoietin,TSLP)[3]。
肥大细胞(mast cells,MCs)在过敏反应中起着关键作用,被认为是抵抗病原体的第一线防御。被激活的肥大细胞可以分泌介质并招募效应细胞,这对宿主防御和免疫功能至关重要[4]。MCs已被证明在AD病损中数目增加[5],并通过过敏原和IgE/高亲和力IgE受体(high affinity IgE Fc receptor,FcεRI)交叉激活参与AD发病机制[6]。然而,肥大细胞对AD表型影响,以及是否影响AD的Th2型炎症反应尚未完全阐明。本研究通过卡泊三醇(calcipotriol,MC903)-AD小鼠模型,并利用KitW-sh/W-sh肥大细胞缺失小鼠,以探究肥大细胞在AD表型及免疫活化中作用的初步研究。
9份皮肤样本来自西安交通大学第二附属医院皮肤科,根据Williams的诊断标准,被诊断为特应性皮炎,且无其他疾病的患者皮肤样本。9份健康皮肤对照样本来自西安交通大学第二附属医院骨外科手术切除多余正常皮肤,排除感染和免疫性疾病。本研究得到了西安交通大学第二附属医院伦理委员会的批准(批号:2022008),所有样本来源的患者签署了知情同意书。
成年雄性C57BL/6小鼠,年龄为8周,购自西安交通大学实验动物中心。C57BL/6 STOCK KitW-sh/HNihrJaeBsmJNju(KitW-sh/W-sh)小鼠购自南京大学模型动物研究中心。小鼠被安置在西安交通大学的无特定病原体(specific pathogen free,SPF)动物中心,温度为20 ℃~25 ℃,相对湿度为40%,昼夜周期为12/12 h,自由饮水,喂食标准干粮。本研究严格按照美国国立卫生研究院的《实验动物护理和使用指南》中的建议进行。
MC903(卡泊三醇,HY-10001)购自中国MedChemExpress公司。MC903由100%的乙醇制备,浓度为45 μmol/L。设置野生型对照组、野生型AD组和KitW-sh/W-sh肥大细胞缺失小鼠AD组,每组使用5只8周龄小鼠。通过腹腔注射80 mg/kg的1%戊巴比妥钠来进行麻醉。将25 μl MC903局部涂抹在小鼠背部皮肤,每天1次,连续14 d。对照使用相同体积的乙醇[7]。
小鼠的炎症表型是通过特应性皮炎指数(atopic dermatitis index,ADI)评估的。ADI分数是根据发红、干燥、肿胀和苔藓化4个方面表现进行评估的,评分由轻到重分别为0、1、2、3,总分是4个方面评分的总和[8]。最后的分数由3个受过训练的测试者的平均分数决定。组织学和免疫荧光染色的具体试剂及方法步骤见于文献[9]所述。
小鼠背部皮肤样本用液氮冷冻研磨,并加入0.5 ml生理盐水。然后用组织研磨机(中国Servicebio公司)研磨。小鼠IL-4、IL-13、IL-31和TSLP酶联免疫吸附实验(enzyme linked immunosorbent assay,ELISA)试剂盒均购自上海MLBIO生物技术有限公司。研磨背部组织的总蛋白使用BSA试剂盒(中国碧云天公司)测定。所有步骤均严格按照制造商的说明进行。
雄性C57BL/6小鼠通过腹腔注射80 mg/kg 1%戊巴比妥钠进行麻醉。麻醉诱导后15 min,每只小鼠尾静脉注射0.2 ml生理盐水中的0.4%埃文斯蓝染料(evans blue dye,EBD)。在注射之前,用游标卡尺测量爪子的厚度。5 min后,用微型注射器向左爪注射5 μl的10 μmol/L MC903,并仅向右爪注射生理盐水作为空白对照。15 min后,再次测量并记录爪子的厚度。然后用CO2处死小鼠,并获得每个爪子的照片。收集爪子组织,在50 ℃下干燥24 h,然后称重。用500 μl丙酮-盐水(7∶3)在37 ℃下孵化12 h,提取EBD。将组织切成碎片,在超声波机中放置10 min,并在1 000×g,离心半径为10 cm下离心20 min。将上清液以200 μl的等分量平均分配到96孔细胞培养板中,用分光光度计在620 nm处读取吸光度A值。
成年雄性C57BL/6小鼠通过吸入二氧化碳处死。共有12 ml肥大细胞解离培养基(15 ml 间充质干细胞软骨分化培养基(mesenchymal stem cell chondrogenic differentiation medium,MCDM),1.5 ml 10×汉克斯平衡盐溶液(Hank′s balanced salt solution,HBSS),450 μl胎牛血清,150 μl 1 mol/L 4-羟乙基哌嗪乙磺酸[4-(2-Hydroxyethyl)piperazine-1-ethanesulfonic acid solution,HEPES]缓冲液,12.9 ml无菌水,pH=7.2)用于两到三次连续的腹腔灌洗,然后在4 ℃下以200×g,离心半径为10 cm下离心10 ml。用抗小鼠CD117和抗R-Phycoerythrin(PE)磁珠(美国BD公司)来分离和纯化MPMC。收回颗粒中的MPMC,通过形态学检测,其纯度>95%。然后将MPMC重新悬浮在含有100 ng/ml重组小鼠干细胞因子的达尔伯克改良伊格尔培养基(Dulbecco′s modified Eagle medium,DMEM)中,并在4 h内使用。
每孔1×105个MPMC,在96孔板中进行接种,在每孔加入200 μl的DMEM完全培养基,置于37 ℃和5% CO2的培养箱过夜。次日,显微镜下确认细胞已贴壁并且状态良好后,用100 μl/孔钙成像缓冲液冲洗细胞两次。每孔加入100 μl孵育缓冲液,96孔板置于37 ℃和5%的CO2培养箱中孵育30 min。给予Tyrode溶液制备的10 μmol/L MC903刺激后,用荧光酶标仪表征细胞内钙离子浓度的变化。
每孔1×105个MPMC,在96孔板中进行培养。设置只包含Tyrode溶液的空白组,2.5、5.0、10.0 μmol/L的MC903溶液组(由Tyrode溶液配置),化合物48/80(compounds 48/80,C48/80)组,共五组。去除培养液,按指定浓度加入各组药物,在37 ℃、5% CO2下培养1 h,进行胰蛋白酶和β-氨基己糖苷酶检测,在8 h后进行细胞因子检测。小鼠单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)和趋化因子CXC配体-2(C-X-C motif chemokine ligand-2,CXCL-2)ELISA试剂盒购自中国Sino Biological Inc公司。小鼠胰蛋白酶和β-氨基己糖苷酶ELISA试剂盒购自上海MLBIO生物技术有限公司。所有步骤都严格按照制造商的说明进行。
将MC903作用后的MPMC总蛋白在4 ℃下提取到含有10%蛋白酶抑制剂和磷酸酶抑制剂(瑞士罗氏公司)的RIPA裂解缓冲液中。30 min后,在4 ℃下以13 500×g,离心半径为10 cm下离心10 min,除去不溶性蛋白裂解液。根据制造商的说明,用BCA蛋白质定量试剂盒(中国碧云天公司)测定蛋白质浓度。用购自美国Thermo Fisher Scientific公司的5×装载样品缓冲液煮沸5 min,使细胞裂解液中的蛋白质变性。使用抗体公司货号及浓度如下:抗细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK1/2)(1∶1 000,Cat#ab17942,英国Abcam公司),抗磷酸化细胞外调节蛋白激酶(phospho-Erk1/2,P-ERK1/2)(1∶1 000,Cat#ab214362,英国Abcam公司),抗丝裂原活化蛋白激酶P38(1∶1000,Cat#8690,美国Cell Signaling公司),抗磷酸化-丝裂原活化蛋白激酶P-P38(1∶1000,Cat#4511,美国Cell Signaling公司),抗甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)(1∶2 000,Cat#2118,美国Cell Signaling公司)。蛋白免疫印迹实验的具体步骤见于文献[9]所述。
使用SPSS 25.0软件进行数据整理和统计学分析。符合正态分布的数据以表示,2组间比较采用独立样本t检验,3组间比较采用单因素方差分析。组织学及荧光分析计数使用5个高倍镜视野下的平均值。所有数据采用GraphPad Prism 8软件(GraphPad software)进行绘图。双侧检验,检验水准α=0.05。
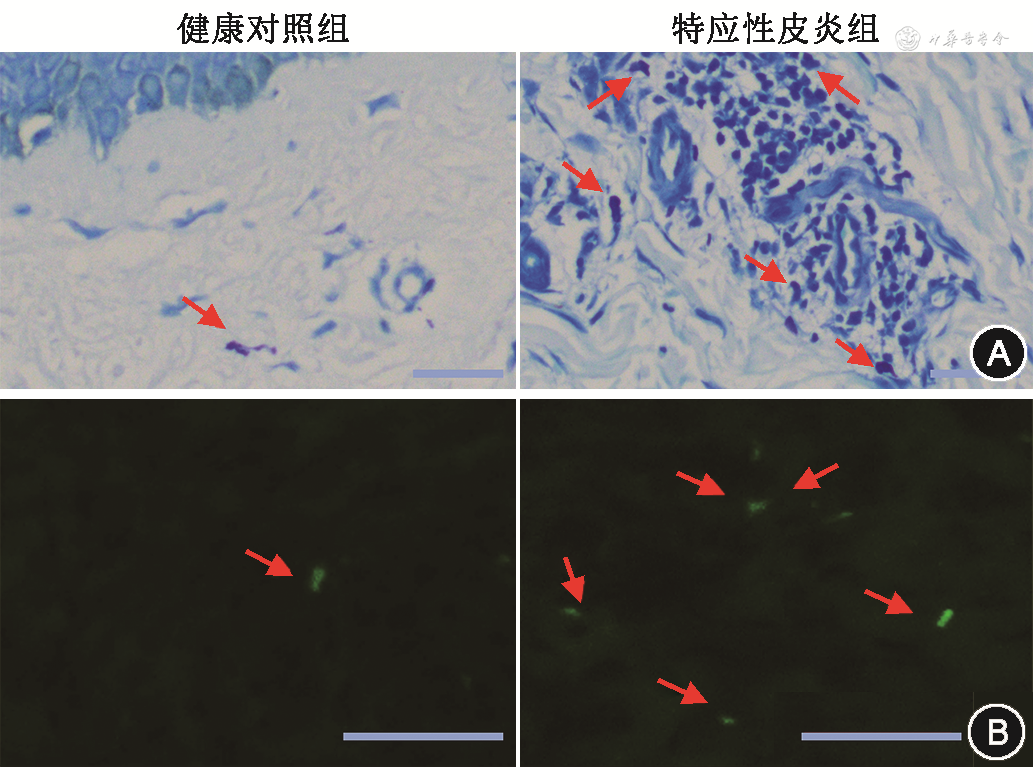
通过甲苯胺蓝染色,相对于健康对照,AD患者皮损中肥大细胞数目增加,每高倍视野下健康对照皮肤中肥大细胞数目为(2.20±0.84)个,AD患者皮损中肥大细胞的数目为(5.40±1.14)个,差异有统计学意义(t=5.06,P<0.001)(图1A)。通过Avidin免疫荧光染色,AD皮损中活化的肥大细胞数目也增加,每高倍视野下健康对照皮肤中脱颗粒肥大细胞数目为(1.00±0.71)个,AD患者皮损中脱颗粒肥大细胞的数目为(4.20±0.84)个,差异有统计学意义(t=6.53,P<0.001)(图1B)。

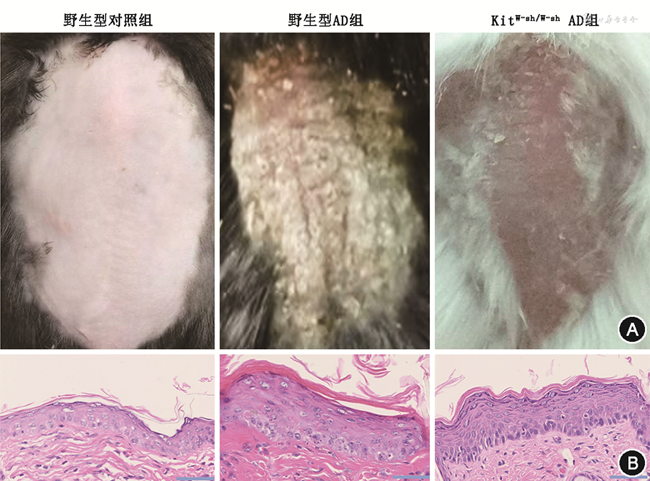
通过分别构建C57BL6/J野生型小鼠和KitW-sh/W-sh肥大细胞缺失小鼠AD皮炎模型,发现KitW-sh/W-sh小鼠的表型减轻,表现在干燥程度减弱,鳞屑减少,苔藓化程度减轻(图2A)。对照组小鼠ADI评分为(1.83±0.75),野生型AD小鼠ADI评分为(10.00±0.89),KitW-sh/W-shAD小鼠ADI评分为(5.50±1.05),差异有统计学意义(F=4.50,P<0.001)。通过苏木精-伊红染色法(hematoxylin-eosin staining,HE)染色,发现KitW-sh/W-shAD小鼠与野生型AD小鼠相比,表皮组织病理改变减轻,表现为真皮浸润炎症细胞减轻(图2B)。

通过对野生型AD小鼠和KitW-sh/W-shAD小鼠背部皮肤释放的2型炎症因子检测,发现KitW-sh/W-shAD小鼠释放的IL-4,IL-13、IL-31和TSLP明显减少。野生型对照组小鼠背部皮肤IL-4水平为(7.50±1.05)pg/mg,野生型AD小鼠背部皮肤IL-4水平为(29.50±1.87)pg/mg,KitW-sh/W-shAD小鼠背部皮肤IL-4水平为(15.33±1.86)pg/mg(F=277.50,P<0.001)。野生型对照组小鼠背部皮肤IL-13水平为(3.00±0.26)pg/mg,野生型AD小鼠背部皮肤IL-13水平为(6.32±0.25)pg/mg,KitW-sh/W-shAD小鼠背部皮肤IL-13水平为(3.93±0.22)pg/mg(F=298.6,P<0.001)。野生型对照组小鼠背部皮肤IL-31水平为(4.93±0.22)pg/mg,野生型AD小鼠背部皮肤IL-31水平为(9.73±0.38)pg/mg,KitW-sh/W-shAD小鼠背部皮肤IL-31水平为(6.89±0.27)pg/mg(F=397.7,P<0.001)。野生型对照组小鼠背部皮肤TSLP水平为(50.50±3.94)pg/mg,野生型AD小鼠背部皮肤TSLP水平为(206.00±4.43)pg/mg,KitW-sh/W-shAD小鼠背部皮肤TSLP水平为(99.00±4.86)pg/mg(F=1941.00,P<0.001)。
通过野生型小鼠的足趾肿胀实验,MC903可在体内激活肥大细胞。注射MC903的足趾相较于注射生理盐水的足趾更加肿胀,且有更多的伊文思蓝染料渗出(图3)。生理盐水组每毫克重量的OD620 mm为(0.14±0.02),MC903组每毫克重量的OD620 mm为(0.26±0.02)(t=9.62,P<0.001)。生理盐水组足趾厚度的增长率为(4.93±0.40)%,MC903组足趾厚度增长率为(19.80±1.73)%(t=14.45,P<0.001),说明注射的MC903可在体内快速引起肥大细胞活化。
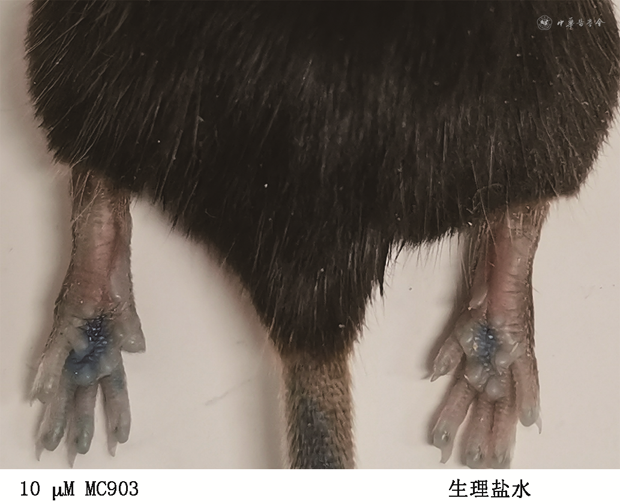

注:MC903为卡泊三醇
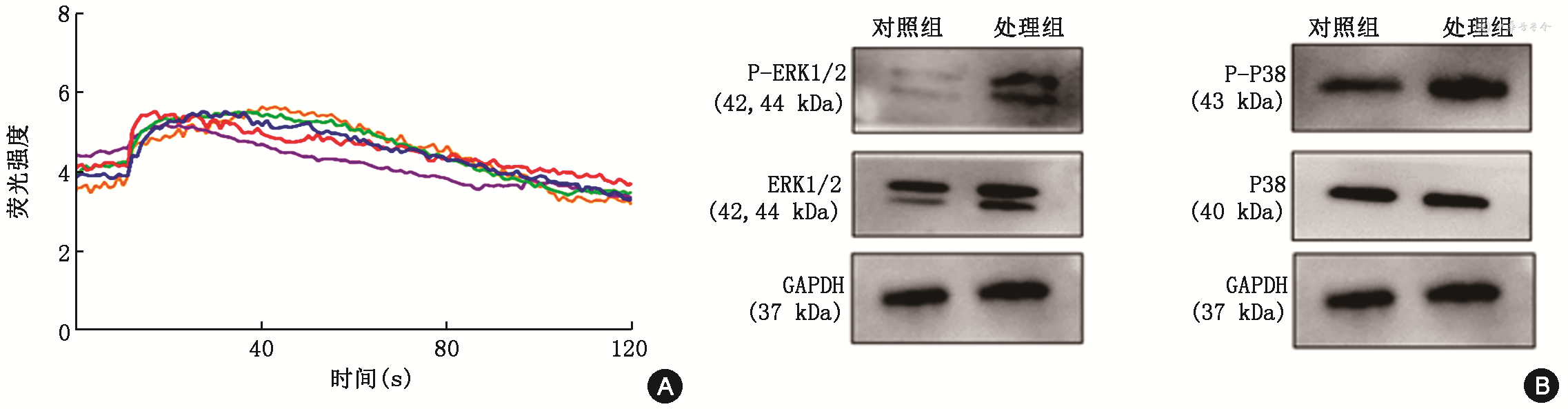
MC903可以激发肥大细胞钙内流信号(图4A)。MC903应用后,空白组、2.5 μM MC903组、5 μM MC903组、10 μM MC903组、C48/80组β-氨基己糖苷酶的释放率分别为(12.13±0.70)%、17.77±0.99)%、(21.05±1.16)%、(33.00±1.41)%、(39.50±0.55)%(F=745.31,P<0.001);释放的类胰蛋白酶β2浓度分别为(335.80±10.67)、(910.30±60.40)、(1 069.00±41.60)、(1 358.00±46.22)、(1 476.00±82.37)μg/ml(F=418.69,P<0.001),这表明MC903能使肥大细胞脱颗粒;释放CXCL-2的浓度分别为(11.75±0.65)、(12.75±0.49)、(14.65±0.58)、(15.90±0.74)、(17.82±0.77)μg/ml(F=82.39,P<0.001);释放MCP-1的浓度分别为(0.34±0.06)、(1.45±0.06)、(2.15±0.19)、(2.30±0.12)、(3.02±0.19)μg/ml(F=323.32,P<0.001),这表明MC903可以通过激活肥大细胞介导炎性细胞因子的释放。为了探索激活途径,进行了蛋白免疫印迹实验检测,结果表明MC903可以激活MAPK下游信号通路,并上调ERK1/2和P38的磷酸化水平(图4B)。

AD的发病机制涉及多种因素。表皮屏障的破坏、树突状细胞和先天性淋巴细胞的激活吸引并与浸润的Th2细胞相互作用,从而引发了AD的炎症。Th2细胞的失调导致相关释放细胞因子如IL-4、IL-13和IL-31,引起和促进湿疹性病变,并激活B细胞和浆细胞,导致抗原特异性IgE的产生。除免疫因素外,表皮因素如丝状蛋白基因(filaggrin,FLG)的突变、环境因素和微生物因素尤其是致病性金黄色葡萄球菌的定植等也与AD的发病相关[2, 3]。此外,近年来发现神经-免疫相互作用也是AD病理结果表现中的一个关键调节因素。
越来越多的证据表明,肥大细胞在特应性皮炎中起着至关重要的作用,而对肥大细胞的作用仍不完全了解。肥大细胞是先天性和适应性免疫的桥梁,它们有助于AD的串联[10]。研究表明,肥大细胞可以分泌IL-4[11]、IL-5[12]和IL-13[13],这被认为是与特应性皮炎有关的Th2细胞因子。同时,IL-4诱导MCs扩增,增加人类皮肤肥大细胞的FcεR1表达,这在IgE/Th2/Eos的恶性循环中非常重要[14, 15]。为了探究肥大细胞在AD中的作用,本研究使用了KitW-sh/W-sh肥大细胞缺失小鼠构建AD小鼠皮炎模型,更加直观地观察肥大细胞缺失后对于AD模型小鼠的影响,并探究了MC903模型小鼠激活肥大细胞的潜在机制。
MC903诱导的AD小鼠皮炎模型属于外源性药物诱导的模型,与其他AD动物模型如相比,可以很好地模拟特应性皮炎的特征,而且具有可在多种遗传背景小鼠中应用、可复性强的优点[16]。本研究采用的KitW-sh/W-sh肥大细胞缺失小鼠失SCF-Kit轴受损小鼠,被广泛应用于肥大细胞缺陷的模型,但因为Kit也在肥大细胞之外表达,具有一定的局限性,故本小鼠获取数据需要在体外实验中予以印证[17]。
本研究表明AD患者皮损中活化的肥大细胞数目增多,并通过KitW-sh/W-sh小鼠和野生型小鼠的AD皮炎模型构建以及小鼠足掌肿胀实验,证明MC903可在局部引起肥大细胞快速活化,肥大细胞缺失后,AD小鼠的表型和组织病理改变均明显减轻,且释放的2型炎症因子减少,通过提取MPMC并应用MC903,进一步明确MC903可在体外通过激活下游信号通路途径激活肥大细胞,导致肥大细胞脱颗粒,并释放炎症因子,进一步明确MC903-AD模型可用于AD中肥大细胞作用机制研究。
综上,本研究发现肥大细胞在AD致病的神经免疫机制中具有不可或缺的作用,以肥大细胞为代表的固有免疫细胞在AD中的作用是值得研究的,但其在AD中具体的作用机制尚需进一步探索。
贾韬, 车德路, 郑义, 等. 肥大细胞参与特应性皮炎表型及2型炎症因子释放的免疫活化中作用的初步研究[J]. 中华医学杂志, 2023, 103(32): 2502-2508. DOI: 10.3760/cma.j.cn112137-20230107-00041.
所有作者声明不存在利益冲突



























