
探讨p21活化激酶2(PAK2)在喉鳞状细胞癌中的表达情况及其与患者临床病理特征、化疗敏感性的关系。
从癌症基因组图谱(TCGA)数据库中下载喉鳞状细胞癌相关转录组测序(RNA-seq)数据,123例患者列入研究(12例有癌组织和正常组织数据,其余111例仅有癌组织数据);应用R软件分析PAK2在癌和癌旁组织中的差异表达,应用京都基因与基因组百科全书(KEGG)数据库信号通路富集分析PAK2在喉鳞状细胞癌中的潜在功能。回顾性选取2016年4月至2021年6月于朝阳市中心医院行手术切除的原发性喉鳞状细胞癌组织、对应癌旁组织标本各34例,另取喉正常黏膜组织20例作为对照;应用免疫组织化学法检测各组织中PAK2表达情况,分析其与临床病理因素的相关性。回顾性选取同期诱导化疗前行组织标本采集的声门上型原发性喉鳞状细胞癌患者35例,包括20例化疗敏感患者和15例化疗耐药患者;应用实时荧光定量聚合酶链反应(qRT-PCR)检测癌组织中PAK2 mRNA相对表达量。
TCGA数据库数据分析显示,与癌旁组织相比,癌组织中PAK2表达升高(P=0.012);KEGG数据库信号通路分析显示,喉鳞状细胞癌PAK2高表达与信号转导通路、细胞周期、癌症等相关。免疫组织化学法检测显示,34例喉鳞状细胞癌组织中PAK2阳性患者比例高于癌旁组织和正常组织[58.82%(20/34)比0.03%(1/34)、0(0/20),均P<0.001];不同分化程度[高分化比低、中分化:33.33%(6/18)比87.50%(14/16)]、淋巴结转移情况[有比无:90.91%(10/11)比43.48%(10/23)]、TNM分期[Ⅲ~Ⅳ期比Ⅰ~Ⅱ期:82.35%(14/17)比35.29%(6/17)]患者间PAK2阳性患者比例差异均有统计学意义(均P<0.05),PAK2阳性与临床分型、肿瘤大小、吸烟史、饮酒史、年龄均无关(均P>0.05)。qRT-PCR检测显示,化疗耐药组癌组织PAK2 mRNA相对表达量高于化疗敏感组(3.89±0.12比0.78±0.23,P<0.001)。
喉鳞状细胞癌组织PAK2表达水平升高,PAK2高表达与喉鳞状细胞癌患者恶性临床病理特征密切相关,其高表达可能提示对传统化疗方案不敏感;PAK2可能是靶向调节喉鳞状细胞癌化疗敏感性的潜在基因。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
喉癌是第二大常见头颈部恶性肿瘤,其中90%为喉鳞状细胞癌(LSCC)[1]。对于中晚期LSCC患者,我国主要采取手术切除联合放化疗的治疗方案,但由于中晚期病变范围广,肿瘤切除后对喉功能影响极大[2],并且对患者的生命质量、情感特征和社会关系产生不良影响[3],因此,通过诱导化疗缩小肿瘤体积后再同步放疗或手术切除以提高保喉率的综合治疗方式的应用逐渐增加[4]。但耐药成为诱导化疗效果不佳的主要障碍[5,6,7,8]。因此,寻找预测中晚期喉癌患者诱导化疗反应的分子标志物对提高患者诱导化疗的敏感性及改善预后有重要意义。p21活化激酶2(PAK2)是丝氨酸/苏氨酸激酶p21活化激酶(PAK)家族Ⅰ组成员。当PAK2过度表达、突变或被上游因子异常激活时,可以介导细胞中的致癌信号转导,包括细胞骨架的重塑、细胞分裂、生长信号的自主获得、促进肿瘤细胞的侵袭和转移以及逃避细胞凋亡等[9,10]。PAK2已被证实在多种肿瘤中过表达[11,12,13,14],并且能影响肿瘤细胞对化疗药物的敏感性[15]。但其在LSCC中是否异常表达及对化疗敏感性的影响目前尚无明确阐明。本研究旨在寻找PAK2在LSCC中上调的意义及其与诱导化疗敏感性之间的关系。
从美国国家癌症研究所(NCI)建立的癌症数据共享系统GDC(https://portal.gdc.cancer.gov/)的癌症基因组图谱(TCGA)数据库HNSC项目中筛选出laynx分类的转录组测序(RNA-seq)数据。选取123例喉癌患者,其中12例包括癌组织和正常组织数据,其余111例仅包括癌组织数据。利用非参数Wilcox秩和检验和R 4.2.1软件的limma程序包分析PAK2 mRNA在喉癌组织和癌旁组织中的表达差异,以P<0.05为差异有统计学意义。以喉癌组织中PAK2 mRNA中位相对表达量(13.23)为临界值,将患者分为高表达组(66例)和低表达组(57例)。利用基因集富集分析(GSEA)4.0.1软件对喉癌组织PAK2高表达组和低表达组间差异表达的基因进行比较,根据京都基因与基因组百科全书(KEGG)数据库7.4分析PAK2表达与细胞信号通路的关系,设置次数为1 000次,以归一化富集分数(NES)>2、q<0.01为差异有统计学意义的富集基因集。
纳入标准:(1)经活组织病理学检查诊断为LSCC;(2)经喉镜、CT等影像学检查判定LSCC临床分型;(3)有详细临床病理资料和随访信息。排除标准:(1)已有远处转移或严重感染、无法耐受手术及诱导化疗;(2)有其他系统恶性肿瘤病史,或已接受手术、放疗、化疗、免疫治疗或靶向治疗等;(3)有神经、精神方面疾病,存在认知障碍。
(1)手术组:回顾性选取2016年4月至2021年6月于朝阳市中心医院耳鼻咽喉头颈外科行手术切除的34例原发性LSCC患者癌组织及距离肿瘤边缘至少0.5 cm处相同大小癌旁组织,用于免疫组织化学法检测PAK2蛋白表达情况。患者均为男性,中位年龄59岁(42~84岁)。根据国际抗癌联盟(UICC)喉癌TNM分期标准(2002)分为Ⅰ~Ⅳ期,其中Ⅲ、Ⅳ期17例;淋巴结转移11例,无淋巴结转移23例;无远处转移者;病理分化程度:低、中分化16例,高分化18例;声门上型3例,声门型31例;另取于朝阳市中心医院行声带息肉切除患者的喉正常黏膜组织20例作为对照组。分析癌组织PAK2蛋白表达与患者临床病理特征的关系。(2)诱导化疗组:回顾性选取2016年4月至2021年6月于朝阳市中心医院耳鼻咽喉科确诊为声门上型原发性喉癌并经多学科会诊(MDT)后给予TPF(紫杉醇+顺铂+5-氟尿嘧啶)方案诱导化疗的患者35例,诱导化疗前所有患者行癌组织标本采集,并保证留取瘤体后不影响患者的病理学诊断及后续治疗。应用实时荧光定量聚合酶链反应(qRT-PCR)检测标本中PAK2表达情况。患者中男性33例,女性2例,中位年龄58岁(48~75岁);TNM分期均为Ⅲ~Ⅳ期;病理分化程度:低、中分化10例,高分化25例。35例患者接受TPF方案治疗2个周期:紫杉醇135 mg/m2,第1天;顺铂30 mg/m2,1次/d,第2天至第4天;5-氟尿嘧啶500 mg/m2,1次/d第2天至第6天;均为静脉注射给药,3周为1个周期。在第2个周期的第3周,影像检查,计算成像肿瘤体积,进行疗效评估。其中,原发肿瘤完全缓解(肿瘤完全消失)或明显缓解(肿瘤体积缩小>50%)的患者归为敏感组,原发缓解较小(肿瘤体积缩小<50%)、肿瘤进展[肿瘤体积增大>25%(进展)]或肿瘤稳定(肿瘤体积既不缩小也不进展)的患者归为耐药组。最终敏感组为20例,耐药组为15例。两组患者在性别、年龄、肿瘤分期和病理分化程度上的差异均无统计学意义(均P>0.05)(表1),有可比性。本研究通过朝阳市中心医院伦理委员会批准(批准文号:[2022]12),被选入的研究对象对本研究均知情并签署知情同意书。
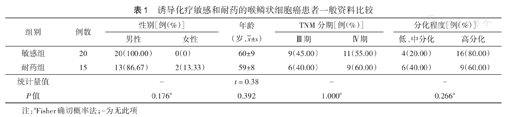
诱导化疗敏感和耐药的喉鳞状细胞癌患者一般资料比较
诱导化疗敏感和耐药的喉鳞状细胞癌患者一般资料比较
| 组别 | 例数 | 性别[例(%)] | 年龄(岁, ±s) ±s) | TNM分期[例(%)] | 分化程度[例(%)] | |||
|---|---|---|---|---|---|---|---|---|
| 男性 | 女性 | Ⅲ期 | Ⅳ期 | 低、中分化 | 高分化 | |||
| 敏感组 | 20 | 20(100.00) | 0(0) | 60±9 | 9(45.00) | 11(55.00) | 4(20.00) | 16(80.00) |
| 耐药组 | 15 | 13(86.67) | 2(13.33) | 59±8 | 6(40.00) | 9(60.00) | 6(40.00) | 9(60.00) |
| 统计量值 | - | t=0.38 | - | - | ||||
| P值 | 0.176a | 0.392 | 1.000a | 0.266a | ||||
注:aFisher确切概率法;-为无此项
兔抗人PAK2单抗购于英国Abcam公司;一抗稀释液购于北京酷来搏科技有限公司,免疫显色试剂、DAB染色液购于广州深达生物制品技术有限公司。对手术组34例患者癌组织、癌旁组织及20例喉正常黏膜组织标本行组织切片,常规石蜡包埋,脱蜡至水,加入免疫组织化学抗原修复缓冲液,高压修复抗原,10%过氧化氢去除内源性过氧化物酶,封闭20 min后加入兔抗人PAK2单抗(1∶400倍稀释),4 ℃过夜。加入生物素化二抗,DAB显色,苏木精对比染色,室温反应1 h。细胞中出现黄色或棕黄、褐色为阳性细胞;阳性细胞比例评分标准:无阳性为0分,阳性细胞比例<25%为1分,25%~50%为2分,51%~75%为3分,>75%为4分;染色强度评分标准:无染色为0分,淡黄色为1分,黄色为2分,棕黄色为3分;以阳性细胞比例评分和染色强度评分之和判断PAK2表达情况:0~4分为阴性,5~7分为阳性[16]。染色结果由2名病理医师独立双盲判断。
RNA提取试剂盒购于北京天根生化有限公司,HiScriptⅡQ RT SuperMix for qPCR(+gDNA Remover)Vazyme(R223-01)购自南京诺唯赞生物科技股份有限公司,KAPA SYBR FAST qPCR Kit Master Mix(2×)Universal试剂盒购自美国KAPA Biosystems公司。利用Trizol试剂提取35例诱导化疗患者样本组织的总RNA,利用KAPA SYBR FAST qPCR Kit Master Mix试剂盒反转录得到cDNA。PCR扩增PAK2的正向引物序列5'-TGAGCACACCATCCATGTTGG-3',反向引物序列5'-AGGTCTGTAGTAATCGAGCCC-3';内参照GAPDH正向引物序列5'-GGAGCGAGATCCCTCCAA AAT-3',反向引物序列5'-GGCTGTTGTCATACTTCTC ATGG-3';PCR条件:95 ℃ 3 min,95 ℃ 15 s、58 ℃ 15 s、72 ℃ 30 s,40个循环。应用PCR仪(美国KAPA Biosystems公司)自带ABI Prism 7500 SDS软件自动进行分析,收集数据,采用2-△△Ct法计算PAK2 mRNA相对表达量。实验重复3次。
生物信息学数据利用R 4.2.1软件进行整理和统计学分析,利用Wilcoxon检验比较PAK2在癌组织和癌旁组织间表达的差异。临床数据利用SPSS 26.0软件进行统计学分析。计数资料以频数(%)表示,组间比较采用Fisher确切概率法。计量资料符合正态分布,以 ±s表示,两组间比较采用独立样本t检验。应用GrapdhPad 8.0.2软件进行组间基因差异性绘图。以P<0.05为差异有统计学意义。
±s表示,两组间比较采用独立样本t检验。应用GrapdhPad 8.0.2软件进行组间基因差异性绘图。以P<0.05为差异有统计学意义。
喉癌组织中PAK2的相对表达量较正常组织高(13.31±0.67比12.66±0.25,t=2.642,P=0.012)(图1)。经KEGG数据库信息通路分析显示,PAK2显著富集在15条信号通路(表2),多条与信号转导通路、细胞周期、癌症等相关,除卵母细胞减数分裂通路外,其余14条与肿瘤发生、发展相关(图2)。
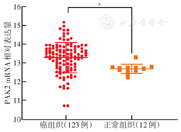

注:TCGA为癌症基因组图谱;PAK2为p21活化激酶2;aP=0.012
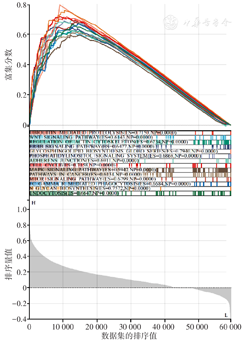

注:GSEA为基因集富集分析;PAK2为p21活化激酶2;KEGG为京都基因与基因组百科全书
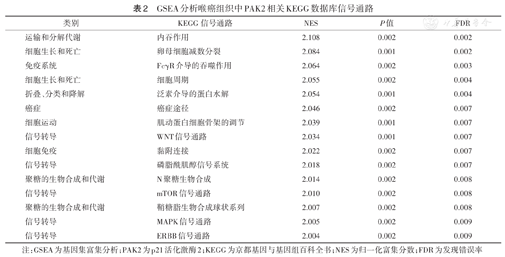
GSEA分析喉癌组织中PAK2相关KEGG数据库信号通路
GSEA分析喉癌组织中PAK2相关KEGG数据库信号通路
| 类别 | KEGG信号通路 | NES | P值 | FDR |
|---|---|---|---|---|
| 运输和分解代谢 | 内吞作用 | 2.108 | 0.002 | 0.002 |
| 细胞生长和死亡 | 卵母细胞减数分裂 | 2.084 | 0.001 | 0.002 |
| 免疫系统 | FcγR介导的吞噬作用 | 2.064 | 0.002 | 0.003 |
| 细胞生长和死亡 | 细胞周期 | 2.055 | 0.002 | 0.004 |
| 折叠、分类和降解 | 泛素介导的蛋白水解 | 2.054 | 0.001 | 0.004 |
| 癌症 | 癌症途径 | 2.046 | 0.002 | 0.007 |
| 细胞运动 | 肌动蛋白细胞骨架的调节 | 2.039 | 0.001 | 0.007 |
| 信号转导 | WNT信号通路 | 2.034 | 0.001 | 0.007 |
| 细胞免疫 | 黏附连接 | 2.022 | 0.002 | 0.007 |
| 信号转导 | 磷脂酰肌醇信号系统 | 2.018 | 0.002 | 0.007 |
| 聚糖的生物合成和代谢 | N聚糖生物合成 | 2.014 | 0.002 | 0.008 |
| 信号转导 | mTOR信号通路 | 2.010 | 0.002 | 0.008 |
| 聚糖的生物合成和代谢 | 鞘糖脂生物合成球状系列 | 2.007 | 0.002 | 0.008 |
| 信号转导 | MAPK信号通路 | 2.005 | 0.002 | 0.009 |
| 信号转导 | ERBB信号通路 | 2.004 | 0.002 | 0.009 |
注:GSEA为基因集富集分析;PAK2为p21活化激酶2;KEGG为京都基因与基因组百科全书;NES为归一化富集分数;FDR为发现错误率
免疫组织化学法检测显示,PAK2在喉癌组织中呈黄色或棕黄色颗粒,主要在胞质中广泛表达,在癌巢及肿瘤细胞集中区域表达较高;PAK2在正常黏膜鳞状上皮组织的基底层表达较为密集(图3)。34例LSCC患者中,癌组织PAK2阳性20例(58.82%),癌旁组织阳性1例(0.03%);20例喉正常黏膜组织中无阳性者;癌组织阳性患者比例较癌旁组织、正常组织均高(均P<0.001)。
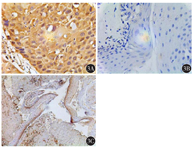

高分化、淋巴结转移、TNM Ⅲ~Ⅳ期患者癌组织PAK2阳性者比例均较高,差异均有统计学意义(均P<0.05),癌组织PAK2阳性与临床分型、肿瘤大小、吸烟史、饮酒史、年龄均无关(均P>0.05)(表3)。
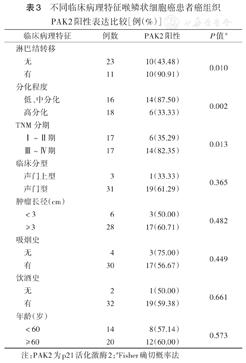
不同临床病理特征喉鳞状细胞癌患者癌组织PAK2阳性表达比较[例(%)]
不同临床病理特征喉鳞状细胞癌患者癌组织PAK2阳性表达比较[例(%)]
| 临床病理特征 | 例数 | PAK2阳性 | P值a |
|---|---|---|---|
| 淋巴结转移 | |||
| 无 | 23 | 10(43.48) | 0.010 |
| 有 | 11 | 10(90.91) | |
| 分化程度 | |||
| 低、中分化 | 16 | 14(87.50) | 0.002 |
| 高分化 | 18 | 6(33.33) | |
| TNM分期 | |||
| Ⅰ~Ⅱ期 | 17 | 6(35.29) | 0.013 |
| Ⅲ~Ⅳ期 | 17 | 14(82.35) | |
| 临床分型 | |||
| 声门上型 | 3 | 1(33.33) | 0.365 |
| 声门型 | 31 | 19(61.29) | |
| 肿瘤长径(cm) | |||
| <3 | 6 | 3(50.00) | 0.482 |
| ≥3 | 28 | 17(60.71) | |
| 吸烟史 | |||
| 无 | 4 | 3(75.00) | 0.449 |
| 有 | 30 | 17(56.67) | |
| 饮酒史 | |||
| 无 | 2 | 1(50.00) | 0.661 |
| 有 | 32 | 19(59.38) | |
| 年龄(岁) | |||
| <60 | 14 | 8(57.14) | 0.573 |
| ≥ 60 | 20 | 12(60.00) |
注:PAK2为p21活化激酶2;aFisher确切概率法
耐药组PAK2 mRNA相对表达量为3.89±0.12,高于敏感组的0.78±0.23(t=20.76,P<0.001)。
虽然已有大量的喉癌治疗研究,但患者5年生存率仍仅维持在50%~60%[17],这主要与确诊晚、复发、转移以及对化疗耐药相关[18]。PAK的激活与其下游效应分子的级联会改变肿瘤细胞表型[9],促进肿瘤的发生、发展,并影响肿瘤细胞对化疗药物的敏感性。目前PAK2在喉癌中的表达、与诱导化疗敏感性之间关系的研究甚少,进一步明确PAK2影响喉癌生物学进程及其预测诱导化疗效果对于提高患者化疗效率及改善预后有重要意义。
我们通过分析TCGA数据库中的喉癌微阵列芯片数据发现PAK2在喉癌组织中显著上调,并进行了KEGG数据库通路富集分析,推测PAK2上调可能通过细胞周期、细胞骨架重塑及细胞黏附、WNT和MAPK等多种肿瘤信号通路影响LSCC的发生、发展。有研究证明了PAK2可被抑癌性miRNA-4779负向调控,来诱导结肠癌细胞生长周期停滞[19];此外,乳腺癌细胞中PAK2可以通过磷酸化caspase-7来抑制化疗药物诱导的细胞凋亡[20]。CDK12能与PAK2结合,使之磷酸化并激活MAPK信号通路,促进胃癌细胞增殖和肿瘤生长[21];Reddy等[22]发现PAK2介导细胞骨架重塑,使造血干细胞和祖细胞归巢[23];PAK2也被证实可磷酸化Src,促进白血病贴壁细胞上皮至间充质的转变及黏附结构动力学和细胞运动[24],通常与肿瘤侵袭、转移和化疗耐药有关[25],对这种黏附信号的干扰可提高化疗效率[26]。在NF2缺陷的肿瘤中,PAK2表达上调,敲除PAK2可抑制WNT信号通路,抑制肿瘤进展并规避肿瘤细胞对PAK类药物的耐药性[27]。提示PAK2表达上调对LCSS的发生、发展和对化疗药物敏感性的改变可能是由多种机制共同作用的结果。
本研究采用免疫组织化学法检测验证了生物信息学分析结果,PAK2在LCSS组织中表达显著上调,并且与病理分期、分化程度和淋巴结转移存在正相关性。Gupta等[28]在头颈部癌研究中发现PAK2的表达与患者恶性临床特征呈正相关,且其高表达者有较差的预后。在前列腺癌和胰腺癌中也证实了这一点,PAK2的上调与淋巴结转移、血管浸润比例、肿瘤的转移和复发密切相关[11,13]。Zhao等[29]通过建立PAK2过表达的结直肠癌细胞株CMC7-KD,发现PAK2过表达能够促进癌细胞增殖及抑制癌细胞凋亡,而PAK2低表达则可逆转这种情况。Xia等[30]在黑色素瘤中发现SNHG16结合miRNA-205-5p增加PAK2表达,促进肿瘤的恶性进展,敲除SNHG16后,PAK2的表达下降,可逆转癌细胞增殖及转移。提示PAK2的上调可能通过促进癌细胞增殖、转移及抑制凋亡等促进LCSS的发生、发展,导致较差的临床结局,而敲除其表达则可能逆转这种情况。本研究还发现癌旁组织PAK2的表达水平较正常组织略高。有研究发现在正常上皮中存在较少的凋亡细胞及孤立性分布的增殖细胞,而在口腔鳞状细胞癌的癌旁组织中发现细胞凋亡受到抑制以及细胞增殖活性得到提高,此外p53蛋白过度表达,同时这种过度表达与癌旁组织异常改变程度相一致,证明其存在恶变的潜在可能[31]。由此推测,PAK2可能在癌旁组织中有诱导细胞恶变的倾向,进一步促进肿瘤的浸润和转移。
我们发现化疗耐药组患者肿瘤组织PAK2表达显著上调,提示PAK2的高表达可能会影响患者诱导化疗的效果,使其对传统诱导化疗敏感性下降。研究证明,在PAK2敲低的头颈癌细胞系中,用紫杉醇和二甲基氧酰甘氨酸处理的癌细胞凋亡显著增加[28];在卵巢癌化疗耐药患者癌组织中也发现PAK2高表达,且在敲低PAK2的卵巢癌细胞系中加入紫杉醇后,细胞凋亡明显增加[14]。因此,PAK2可能是提高喉癌诱导化疗效果的潜在治疗靶点。研究发现,顺铂耐药的喉癌患者使用紫杉醇联合西妥昔单抗可能是一种积极的保留器官的治疗政策[32]。本研究目前仅停留在PAK2与传统诱导化疗耐药方面,有待进一步研究靶向药物联合标准化疗方案后的药物敏感性改变,以使对PAK2靶向治疗更加精准化,疗效最大化。
综上,PAK2可能通过细胞周期、细胞骨架重塑等多种信号转导方式调控喉癌的发生、发展,并影响喉癌细胞对化疗药物的敏感性。提示PAK2可能为LCSS潜在的分子生物学标志物,对患者是否首选诱导化疗进而保留器官提供一定依据,对喉癌患者个性化治疗提供潜在的治疗策略。对于PAK2具体影响LCSS发生、发展的机制以及如何导致肿瘤耐药性增加还有待深入研究。
所有作者均声明不存在利益冲突



























