
报道1例直肠弯曲菌合并多种厌氧菌致脑脓肿患者。直肠弯曲菌是弯曲菌属的一种,主要从活动性牙周感染患者中分离,分离于脑脓肿者较少见。本例患者为中年男性,既往有下肢静脉血栓和脑动脉瘤手术病史,突发单侧肢体无力,头颅磁共振成像检查提示右侧额叶占位,诊断为脑脓肿,行头颅手术引流。脓液培养为直肠弯曲菌、具核梭杆菌、微小微单胞菌、牙龈卟啉单胞菌及福赛斯坦纳菌,考虑为直肠弯曲菌合并多种厌氧菌致脑脓肿。先后予美罗培南、万古霉素、青霉素、奥硝唑和氯霉素抗感染治疗后好转。临床医师应提高对该疾病的认识,早期诊断以合理用药。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者男,59岁,因"突发左上肢无力30 h"于2022年3月28日收入丽水市中心医院。患者30 h前在家中无明显诱因下突发左上肢无力,不能持物,伴头晕,无头痛,言语及行走如常,休息无好转,当时未重视,未诊治,症状无缓解。既往有下肢静脉血栓病史,脑动脉瘤手术史;高血压病史多年,氨氯地平片10 mg/次(1次/d)规律服药。入院体格检查:意识清楚,体温为36.8 ℃,脉率为99次/min,呼吸频率为20次/min,血压为170/96 mmHg(1 mmHg=0.133 kPa);双侧瞳孔等大等圆,对光反射灵敏,无眼震,双侧鼻唇沟对称,伸舌居中,左上肢肌力Ⅱ级,左下肢肌力Ⅳ级,右侧肢体肌力正常,四肢肌张力正常,左侧巴宾斯基征(+)。入院当天实验室检查示:白细胞计数为7.1×109/L,中性粒细胞比例为0.763,淋巴细胞比例为0.176,血红蛋白为165 g/L,血小板计数为174×109/L;快速超敏CRP为5.91 mg/L,降钙素原为0.04 μg/L,白蛋白为33.4 g/L,血钙为2.09 mmol/L;血脂、血糖、尿常规、粪便常规未见异常。3月28日头颅MRI检查示右侧额叶见一片状不规则肿块(图1),大小约2.3 cm×1.4 cm×1.8 cm,弥散明显受限,双侧侧脑室旁白质区多发腔隙性脑梗死,部分软化灶;动脉瘤术后;右侧额窦、双侧上颌窦炎症。予氨氯地平片10 mg(1次/d)降压、阿托伐他汀钙片20 mg(1次/d)调脂稳斑等对症治疗。4月1日,患者偶感头晕、头痛,体格检查:左上肢肌力0级,左下肢肌力0级,右侧肢体肌力Ⅴ级,四肢肌张力正常,左侧巴宾斯基征(+);头颅MRI增强检查示右侧额叶占位,团片状病灶增大,约4.5 cm×2.4 cm×2.1 cm。因左侧肢体无力进展较快,考虑脑脓肿,于当天行头颅引流手术,抽出黄色浓稠脓液约15 mL,脓液送细菌涂片及细菌培养检查,涂片检出革兰阴性杆菌和革兰阳性球菌(图2)。脑脓肿诊断明确,予美罗培南针2.0 g/次(每8 h 1次)静脉滴注联合万古霉素针1.0 g/次(每12 h 1次)静脉滴注,以及阿米卡星20 mg/次(1次/d)注入脓肿腔治疗。4月4日,脓液厌氧培养出5种细菌,经质谱鉴定为直肠弯曲菌、具核梭杆菌、微小微单胞菌、牙龈卟啉单胞菌和福赛斯坦纳菌;直肠弯曲菌及厌氧菌的药物敏感试验困难未检测。4月8日,脑脓肿脓液宏基因组学二代测序结果提示直肠弯曲菌(特异序列数为2 826)、具核梭杆菌(特异序列数为59 904)、微小微单胞菌(特异序列数为25 246)、牙龈卟啉单胞菌(特异序列数为8 953)、龈沟产线菌(特异序列数为6 471)、福赛斯坦纳菌(特异序列数为3 673),证实直肠弯曲菌合并多种厌氧菌感染。4月13日,头颅MRI检查示脓肿周围水肿加重,感染科会诊后改用青霉素480万U/次(每6 h 1次)静脉滴注联合氯霉素1.5 g/次(1次/d)静脉滴注治疗脑脓肿,因丽水市中心医院氯霉素缺货,用青霉素480万U/次(每6 h 1次)静脉滴注联合奥硝唑0.5 g/次(每12 h 1次)静脉滴注治疗脑脓肿。2022年4月20日,改用青霉素480万U/次(每6 h 1次)静脉滴注联合氯霉素1.5 g/次(1次/d)静脉滴注治疗脑脓肿。5月8日,患者体温正常,无咳嗽、咳痰,无头痛、呕吐,炎症指标恢复正常,停用抗菌药物,予康复治疗。2022年5月20日,患者住院54 d,脑脓肿经切开引流后抗菌药物治疗38 d,康复治疗2周后能独立站,室内步行,炎症指标正常,病情稳定,予以出院。
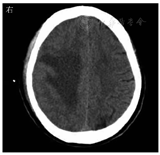

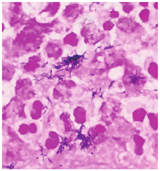

直肠弯曲菌是弯曲菌属的一种,微需氧或厌氧生长,革兰染色阴性,弯曲呈弧形、S形或螺旋形杆菌,在陈旧的培养物中或长时间暴露在空气中可形成球形。直肠弯曲菌为口腔定植菌群的一种[1],其较少引起口腔外感染,主要从活动性牙周感染患者中分离,但也有肺部感染的报道[2],亦有在乳腺囊肿患者中分离到该菌的报道[3],但是直肠弯曲菌引起颅内感染的报道非常少[4]。具核梭杆菌为梭杆菌属的一种,是口腔的定植菌群之一,是革兰染色阴性、无芽孢的专性厌氧菌。具核梭杆菌不仅可引起口腔感染性疾病[5],还与大肠癌及脑、肝、肺、脾等脏器感染密切相关[6]。微小微单胞菌为革兰阳性专性厌氧球菌,是口腔的定植菌,是牙周炎主要可疑病原菌之一,其还与腹部脓肿、肝脓肿、心内膜炎、化脓性关节炎、脑膜炎、菌血症、根尖周炎及冠周炎等相关[7,8,9]。牙龈卟啉单胞菌、龈沟产线菌及福赛斯坦纳菌均为口腔定植专性厌氧菌,且为重要的牙周炎致病菌,在牙周疾病的发生和发展中起着重要作用[10,11,12,13]。本例患者为中年男性,既往有下肢静脉血栓病史、动脉瘤术后,本次在家中无明显诱因下突发左上肢无力,不能持物,伴头晕;头颅MRI检查发现右侧额叶见一片状不规则肿块,头颅手术引流抽出黄色浓稠脓液,脓液标本涂片检查见革兰阴性杆菌和革兰阳性球菌,脓液培养检出5种细菌,故细菌性脑脓肿诊断明确。
本例脑脓肿患者共检测到6种病原微生物,包括1种弯曲菌(直肠弯曲菌)及5种厌氧菌(具核梭杆菌、微小微单胞菌、牙龈卟啉单胞菌、龈沟产线菌和福赛斯坦纳菌)。患者的脓液标本涂片经直接显微镜下检查见到革兰阴性弯曲菌、革兰阴性杆菌及革兰阳性球菌,脓液标本培养结果为直肠弯曲菌、具核梭杆菌、微小微单胞菌、牙龈卟啉单胞菌和福赛斯坦纳菌,同时脓液标本宏基因组学二代测序检出直肠弯曲菌、具核梭杆菌、微小微单胞菌、牙龈卟啉单胞菌和福赛斯坦纳菌,说明这5种菌参与了脑脓肿的发病,是其致病菌。龈沟产线菌通过分子生物学方法检出,并未在厌氧培养中培养到,尚不能确定其是否参与脑脓肿的感染及其所起到的作用。近年来,宏基因组学二代测序技术不断发展,其灵敏度较高,为感染性疾病特别是疑难病例的病原学诊断提供了很好的辅助诊断方法,但仍需结合病原学检查结果及临床症状进行诊断。
直肠弯曲菌、具核梭杆菌、微小微单胞菌、牙龈卟啉单胞菌和福赛斯坦纳菌均为口腔的定植菌群,可通过血液传播或经鼻咽、咽鼓管到达中耳扩散至大脑引起颅内感染[14],黄艳飞等[15]从1 050例鼻窦炎患者的窦腔内容物中分离出具核梭杆菌,提示具核梭杆菌可引起鼻窦炎。Kakuta等[16]报道直肠弯曲菌可能为中耳炎的病原体。本例患者4年前曾因颅内动脉瘤破裂行颅内动脉瘤夹闭术,而病原菌感染是颅内动脉瘤夹闭术后的常见并发症,结合头颅MRI检查结果(右侧额窦、双侧上颌窦炎症),考虑颅内脓肿的病原菌可能来源于右侧额窦及上颌窦炎症。
随着影像学检查、手术、细菌培养、病原学检查和宏基因组学二代测序等技术的发展,脑脓肿的病死率大幅下降,但致残率仍不容乐观,部分患者可遗留不同程度的神经功能障碍及癫痫发作[17,18]。脑脓肿的治疗有手术治疗和抗菌药物治疗,手术引流联合抗菌药物治疗效果为佳,在脑脓肿的抗菌药物经验治疗中推荐美罗培南联合万古霉素[19]。本例患者行头颅手术引流、阿米卡星脓腔冲洗,并经验性使用美罗培南联合万古霉素,由于病原菌为直肠弯曲菌和多种厌氧菌,治疗效果不佳,后根据脓液培养结果,调整抗菌药物为对弯曲菌更敏感的氯霉素联合青霉素,感染得到控制,好转出院。
总之,直肠弯曲菌较少引起脑脓肿,但在特殊情况下可合并厌氧菌引起脑脓肿,应引起重视。本例患者在手术引流的基础上经氯霉素、青霉素及奥硝唑抗感染治疗效果较理想,可为今后此类患者的治疗提供参考。
所有作者均声明不存在利益冲突



























