
近年来快速发展的抗体偶联药物(ADC)靶向生物制剂,是一类由单克隆抗体经由连接分子与细胞毒类药物偶联结合而组成的新型抗肿瘤药物。新型ADC药物的上新以及在临床上的推广应用,在改变人类表皮生长因子受体2(HER2)阳性以及三阴性乳腺癌的治疗格局的同时,对医护人员ADC药物的规范使用及管理提出新的要求。ADC药物的输注规范、不良反应的预防和管理等是保证药物疗效及安全的重要前提,因此,中国医药教育协会乳腺癌个案管理师分会及靶向药物输注规范共识制定小组共同制定了乳腺癌抗体偶联药物输注管理专家共识,旨在为临床医护人员提供恩美曲妥珠单抗、德曲妥珠单抗、戈沙妥珠单抗等ADC药物的输注规范以及相关不良反应的早期预防和及时管理的实践指导。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
近年来快速发展的抗体偶联药物(antibody-drug conjugates,ADC)靶向生物制剂,是一类由单克隆抗体经由连接分子与细胞毒类药物偶联结合而组成的新型抗肿瘤药物[1, 2],具有强杀伤作用和高度的靶向性,给部分乳腺癌以及多线治疗后的难治性乳腺癌患者带来了更加有效且安全的治疗方法,开启了乳腺癌分子分型精准诊疗的新时代[3, 4]。
目前,已经获美国食品药品监督管理局(FDA)批准上市用于治疗乳腺癌的ADC药物有恩美曲妥珠单抗(trastuzumab emtansine,T-DM1)、德曲妥珠单抗(trastuzumab deruxtecan,T-DXd)和戈沙妥珠单抗(sacituzumab govitecan,SG)3种,也均已获得中国国家药品监督管理局(NMPA)的批准在中国国内上市。治疗策略和诊疗方式的改变,需要医护人员及时了解和熟悉ADC药物的输注规范和输注过程中药物的不良反应的管理,降低并发症的发生,确保ADC药物输注的安全和有效性。基于此,本共识小组就T-DM1、T-DXd、SG这3种乳腺癌ADC药物的输注管理及输注过程中的不良事件的安全性管理展开讨论,采取专家投票方式形成共识推荐意见,为医护人员在ADC药物输注管理的临床实践中提供参考。
1. T-DM1:T-DM1商品名称为赫赛莱,是首个获批用于实体瘤的人类表皮生长因子受体2(HER2)的ADC[5]。T-DM1将抗体的高度靶向特异性(曲妥珠单抗)和小分子毒素(DM1)的高毒性相结合,实现对肿瘤细胞的精准高效杀伤,同时具有靶向作用,T-DM1分子中的曲妥珠单抗发挥靶向作用,DM1具有强效细胞毒性作用,硫醚连接体结构稳定;T-DM1具有曲妥珠单抗和DM1双重作用机制,疗效较靶向更强、耐受性较化疗更好[6]。
2. T-DXd:T-DXd商品名称为优赫得,又称DS-8201a,用于治疗HER2阳性乳腺癌。T-DXd是一种靶向HER2的ADC,由哺乳动物细胞(中国仓鼠卵巢细胞)生产的与曲妥珠单抗氨基酸序列相同的人源化抗HER2免疫球蛋白G1(IgG1)单克隆抗体(mAb),通过可裂解四肽连接子与DXd(依喜替康衍生物、拓扑异构酶Ⅰ抑制剂)共价连接而成。Deruxtecan由连接子和拓扑异构酶Ⅰ抑制剂组成,每个抗体分子大约连接8个deruxtecan分子。T-DXd被胞内的溶酶体吞噬,随后溶酶体酶切断多肽连接子,释放出负载的DXd,抑制拓扑异构酶Ⅰ的活性,进而引发DNA损伤和细胞凋亡,发挥有效的抗肿瘤作用[7, 8, 9]。
3. SG:SG商品名称为拓达维,用于治疗既往接受过至少两种系统治疗的不可切除的局部晚期或转移性三阴性乳腺癌患者。SG是第1个上市的靶向人滋养层细胞表面抗原2(human trophoblast cell surface antigen 2,Trop 2)的ADC类药物,由靶向Trop-2的人源化单克隆抗体通过连接子与伊立替康的活性代谢物SN-38组成[10]。Trop 2是一种参与细胞增殖和迁移等多种生物过程的膜糖蛋白,在乳腺癌、结肠癌和尿路上皮癌等上皮肿瘤中过表达,通过单克隆抗体与肿瘤细胞表达的Trop-2相结合,将SN-38运送至肿瘤细胞内部,发挥其细胞毒性作用。SN-38是一种拓扑异构酶抑制剂,在异种移植瘤模型中,毒性是前体伊立替康的20~136倍,能诱导DNA双链断裂和细胞凋亡[11, 12]。
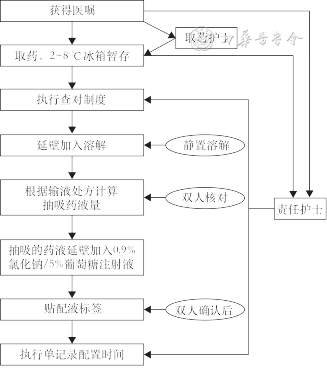
1. ADC药物的配置SOP:乳腺癌ADC药物静脉输注应遵循现用现配、无菌配置原则,配置流程见图1。其中,T-Dxd和SG配置时应避光。

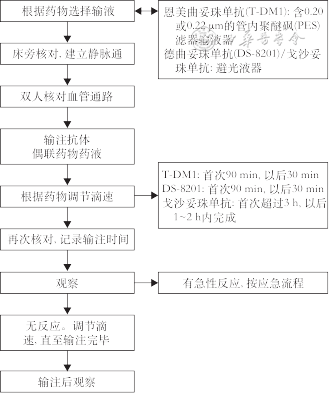
2.ADC药物的输注SOP:乳腺癌ADC药物整个输注过程遵循输液流程,输注流程见图2。

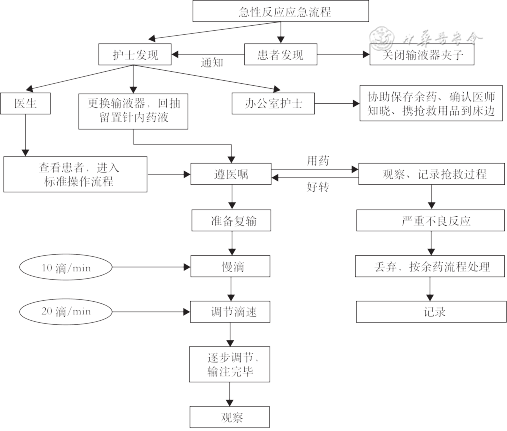
3.ADC药物输注急性反应应急SOP:乳腺癌ADC药物输注急性反应应急流程见图3。

推荐意见1:乳腺癌ADC药物输注应遵循现用现配、无菌配置原则,配置过程中严格执行查对制度,双人核对、确认后,单双人签字(共识度:100%)。
推荐意见2:根据临床需要,乳腺癌ADC药物建议在静脉药物配置中心(Pharmacy Intravenous Admixture Service,PIVAS)实行集中调配和供应,或在病房内具有生物安全柜或超净工作台条件下进行配置,以期降低毒性药物对医护人员的职业伤害(共识度:98%)。
推荐意见3:ADC药物输注SOP遵循静脉输液流程(共识度:100%)。
推荐意见4:药物输注过程中,如果患者发生输注反应,应立即采取急性反应应急流程(共识度:99%)。
推荐意见5:建议T-Dxd和SG在药物避光配置(共识度:97%)。
1. ADC药物规格及配置原则:(1)T-DM1:100 mg/瓶和160 mg/瓶两种规格;(2)T-DXd:100 mg/瓶;(3)SG:180 mg/瓶。T-DM1、T-DXd和SG虽同属ADC药物,但3种药物的分子结构特性各不相同,不能相互替换或者联用,为了防止用药错误,输注前应仔细检查、核对西林瓶标签,以确保正在制备和使用的药物正确。
2. T-DM1的注射液配置:(1)复溶溶液的配置:①使用无菌注射器,将5 ml无菌注射用水缓慢注入100 mg的T-DM1西林瓶中,或将8 ml无菌注射用水注入160 mg的T-DM1西林瓶中。②轻轻旋转西林瓶直至完全溶解,切勿用力甩动。③在2~8 ℃下贮藏复溶的T-DM1溶液;24 h后丢弃未使用T-DM1溶液(复溶制剂仅供一次性使用,未用完部分应及时销毁)。④复溶溶液使用前应进行外观检查,确保无微粒物质或者变色。通常情况下,复溶溶液无可见微粒,为澄清至微乳光溶液。复溶溶液的颜色应为无色至浅棕色。如果复溶溶液含有可见微粒、浑浊或变色,则请勿使用。(2)复溶溶液稀释说明:①从西林瓶中取出适量的溶液,然后将其添加到含有250 ml 0.45%氯化钠或0.9%氯化钠的输液袋中。②一旦做好输注准备,则应立即给药。③如果不立即使用,输注液可在2~8 ℃的冰箱中贮藏长达24 h。④贮藏期间切勿冷冻或甩动输注袋。
3. T-DXd的注射液配置:(1)T-Dxd的复溶液配置:①从储存中取出配制计划剂量所需数量的T-DXd药瓶,T-DXd溶液制备完成之前,需保留外包装盒。②取下无菌注射用水的盖子,并用酒精擦拭干净顶部。③每瓶T-Dxd使用无菌注射器缓慢注入5 ml无菌注射用水。④通过旋转、翻转小瓶使瓶中粉末充分溶解,不可摇晃。⑤配制成的溶液为无色至淡黄色的透明液体,最终浓度为20 mg/ml。⑥溶解后的复溶液如果没有马上使用,最多可在2~8 ℃冰箱中保存24 h,不可冰冻。⑦复溶制剂不含防腐剂,仅供一次性使用。(2)T-Dxd的复溶液稀释:①使用无菌注射器从西林瓶中取出计算出的量。检查复溶溶液是否有颗粒和变色。溶液应清澈无色至浅黄色。如果观察到可见颗粒或溶液混浊或变色,请勿使用。②将计算过体积的复溶的本品加入到含有100 ml 5%葡萄糖溶液的输液袋中进行稀释,不得使用氯化钠溶液。建议使用由聚氯乙烯或聚烯烃(乙烯和聚丙烯的共聚物)制成的输液袋。③轻轻翻转输液袋以充分混合溶液,请勿振摇。T-DXd制备以及给药期间,制备好的输液袋必须避光。④丢弃西林瓶中所有未使用的部分。
4. SG的注射液配置:(1)SG复溶溶液的配置:①使用无菌注射器,缓慢将20 ml 0.9%氯化钠注射液注入180 mg的SG西林瓶中,得到浓度为10 mg/ml的溶液。②轻轻旋转西林瓶,使其溶解15 min,切勿用力甩动。③配置好的复溶溶液应立即进行稀释配置。④复溶溶液给药前,应目视检查注射药物中是否有颗粒物和变色现象。溶液应无可见微粒,呈澄清的黄色。如果复溶溶液浑浊或变色,请勿使用。⑤复溶后立即制备本品稀释溶液用于输注。(2)SG复溶溶液稀释说明:①用注射器从西林瓶中取出适量的溶液,根据需要用0.9%氯化钠输注液调整输液袋中的体积,以使溶液浓度达到 1.1~3.4 mg/ml(总体积不应超过500 ml),仅可使用0.9%氯化钠稀释进行输注。②如果体重超过170 kg的患者,将SG总剂量均分于两个500 ml的输液袋中,按顺序缓慢输注。复溶制剂仅供一次性使用,未用完部分应及时销毁。③一旦做好输注准备,则应立即使用输注袋中的稀释溶液,输液袋应避光。④如果不立即使用,输注液可在2~8 ℃的冰箱中贮藏长达4 h。冷藏保存后,稀释溶液应在6 h内(包括输注时间)使用完。⑤贮藏期间切勿冷冻或甩动输注袋,并且需避光。
5. ADC药物给药方案:(1)T-DM1的给药方案:①T-DM1推荐剂量为3.6 mg/kg,1次/3周(21 d为1个周期)。给予起始剂量时采用90 min静脉输注,在输注期间应观察患者,并于初始剂量给药后至少90 min内观察发热、寒战或其他输液相关反应。给药期间应密切监测输注部位,防止可能出现皮下外渗的情况。如果既往输注时的耐受性良好,则给予T-DM1的后续剂量时可采用30 min输注。如果患者出现输注相关症状,应减慢本品的输注速率或中断给药。出现危及生命的输液反应时,应终止治疗。②T-DM1的典型不良反应剂量调整T-DM1引起的血小板减少不良事件剂量调整如表1所示。(2)T-DXd的给药方案:①T-DXd推荐剂量为5.4 mg/kg,采用静脉输注给药(请勿静推或静脉快速避光注射)。1次/3周(每周期21 d)静脉输注,直至疾病进展或出现无法耐受的毒性。首次输液:第1次滴注不少于90 min;后续输注:如果耐受性良好,第2次起滴注不少于30 min。如果患者出现输液相关症状,应减慢本品的输注速率或中断给药。出现严重输液反应时,应永久停用本品。②T-DXd典型不良反应剂量调整:T-DXd发生输注不良反应时,可能需要暂时停药、减少剂量或永久停药。针对不良反应,T-DXd推荐剂量减量,减少剂量后,请勿重新增加T-DXd剂量。T-DXd剂量降低方案为起始剂量5.4 mg/kg,第1次减量调整为4.4 mg/kg,第2次减量调整为3.2 mg/kg,从需要进一步地减量调整为终止治疗。T-DXd剂量及不良反应见表2。(3)SG给药方案:SG的推荐剂量为10 mg/kg,给药剂量不得超过10 mg/kg。每21 d为一个治疗周期,第1天和第8天静脉输注。一直持续治疗,直至出现疾病进展或不可接受的毒性。首次输注:输注时间应持续3 h以上,在输注过程中和输注结束后至少30 min观察患者是否出现输液反应。后续输注:如果之前输注可耐受,则输注时间可以为1~2 h以上。在输注过程中观察患者是否出现输液反应,并在输注结束后观察至少30 min。如果患者发生输液反应,需减慢本品的输注速率或中断本品输注。发生危及生命的输液反应时永久停用本品。在因不良反应降低剂量后,请勿重新上调剂量。暂停或永久停用SG的剂量调整见表3。

恩美曲妥珠单抗(T-DM1)引起的血小板减少不良事件剂量调整
恩美曲妥珠单抗(T-DM1)引起的血小板减少不良事件剂量调整
| 不良事件 | 严重程度 | 治疗调整 | 剂量降低方案 |
|---|---|---|---|
| 血小板减少症 | 计划治疗日时为2~3级(≥25 000~<75 000/mm3) | 切勿给予T-DM1直至血小板计数恢复至≤1级(≥75 000/mm3)恢复后以相同剂量水平进行治疗如果患者因血小板减少症需要延迟2次给药,应考虑降低一个剂量水平 | 起始剂量:3.6 mg/kg第1次降低剂量:3.0 mg/kg第2次降低剂量:2.4 mg/kg需要进一步降低剂量:终止治疗 |
| 任意时间达到4级(<25 000/mm3) | 切勿给予T-DM1直至血小板计数恢复至≤1级(≥75 000/mm3) 恢复后降低一个剂量水平进行治疗 |

德曲妥珠单抗(T-DXd)不良反应剂量调整
德曲妥珠单抗(T-DXd)不良反应剂量调整
| 不良反应 | 严重程度 | 治疗调整 | |
|---|---|---|---|
| 间质性肺疾病(ILD)/非感染性肺炎 | 无症状ILD/非感染性肺炎(1级) | 中断本品治疗,直至恢复至0级,然后:• 如果从发病之日起28 d或更短时间内恢复,则维持原剂量•如果从发病之日起超过28 d才恢复,则降低一个剂量水平进行治疗(见文中)•一旦怀疑ILD/非感染性肺炎,应考虑使用皮质类固醇治疗 | |
| 症状性ILD/非感染性肺炎(2级或以上) | •永久终止本品治疗•一旦怀疑ILD/非感染性肺炎,应立即开始皮质类固醇治疗 | ||
| 中性粒细胞减少症 | 3级(≥0.5×109/L~<1.0×109/L) | •中断本品给药,直至恢复至2级或以下,然后维持剂量 | |
| 4级(<0.5×109/L) | •中断本品给药,直至恢复至2级或以下,然后维持剂量•降低一个剂量水平进行治疗(见文中) | ||
| 发热性中性粒细胞减少症 | 中性粒细胞绝对计数<1.0×10⁹/L,体温>38.3 ℃或体温≥38 ℃持续1 h以上 | •中断本品治疗直至恢复•降低10个附量水平进行治疗(见文中) | |
| 左心室射血分数(LVEF)降低 | LVEF>45%且相对基线下降10%~20%(绝对值) | •继续本品治疗 | |
| LVEF为40%~≤45% | 相对基线下降<10%(绝对值) | •继续本品治疗•在3周内重复评估LVEF | |
| 相对基线下降10%~≤20%(绝对值) | •中断本品治疗• 3周内重复评估LVEF• 如果LVEF相对基线未恢复至10%之内,则永久停用本品•如果LVEF相对基线恢复至10%之内,则恢复本品治疗,剂量不变 | ||
| LVEF<40%或相对基线下降>20%(绝对值) | •中断本品治疗•3周内重复评估LVEF•如果确认LVEF<40%或相对基线下降>20%(绝对值),则永久停用本品 | ||
| 有症状的充血性心脏衰竭(Congestive heart failure,CHF) | •永久终止本品治疗 | ||
注:根据美国国立癌症研究所不良事件通用术语标准5.0版(NCI-CTCAE v.5.0)进行毒性分级
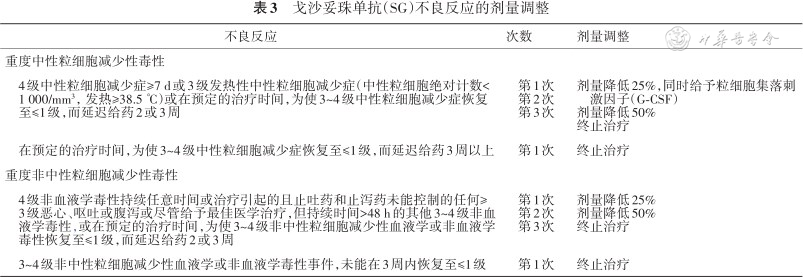
戈沙妥珠单抗(SG)不良反应的剂量调整
戈沙妥珠单抗(SG)不良反应的剂量调整
| 不良反应 | 次数 | 剂量调整 |
|---|---|---|
| 重度中性粒细胞减少性毒性 | ||
| 4级中性粒细胞减少症≥7 d或3级发热性中性粒细胞减少症(中性粒细胞绝对计数<1 000/mm³,发热≥38.5 ℃)或在预定的治疗时间,为使3~4级中性粒细胞减少症恢复至≤1级,而延迟给药2或3周 | 第1次 第2次 第3次 | 剂量降低25%,同时给予粒细胞集落刺激因子(G-CSF) 剂量降低50% 终止治疗 |
| 在预定的治疗时间,为使3~4级中性粒细胞减少症恢复至≤1级,而延迟给药3周以上 | 第1次 | 终止治疗 |
| 重度非中性粒细胞减少性毒性 | ||
| 4级非血液学毒性持续任意时间或治疗引起的且止吐药和止泻药未能控制的任何≥3级恶心、呕吐或腹泻或尽管给予最佳医学治疗,但持续时间>48 h的其他3~4级非血液学毒性,或在预定的治疗时间,为使3~4级非中性粒细胞减少性血液学或非血液学毒性恢复至≤1级,而延迟给药2或3周 | 第1次 第2次 第3次 | 剂量降低25% 剂量降低50% 终止治疗 |
| 3~4级非中性粒细胞减少性血液学或非血液学毒性事件,未能在3周内恢复至≤1级 | 第1次 | 终止治疗 |
6. ADC药物输注:(1)输液装置和输液通路的选择:①输液通路选择:ADC药物建议优先选择经外周静脉置入的中心静脉导管(PICC)或输液港进行输注。②输液装置选择:T-DM1如果使用0.9%氯化钠进行输注,则需要0.20或0.22 μm的管内聚醚砜(PES)滤器;T-DXd输液袋可使用聚氯乙烯、聚乙烯或者聚丙烯材质,过滤器仅可使用0.20或0.22 μm的PES或聚砜(PS)过滤器;SG输注时使用常规输液器即可。(2)注意事项:①T-DXd和SG在配置和输注时,输液袋和输液器均需避光。②如果已制备的T-DXd输注液贮藏于冰箱中(2~8 ℃),应将输注液在避光条件下回温至室温再给药。
7. ADC药物保存:T-DM1、T-DXd、SG这3种ADC药物保存条件见表4。
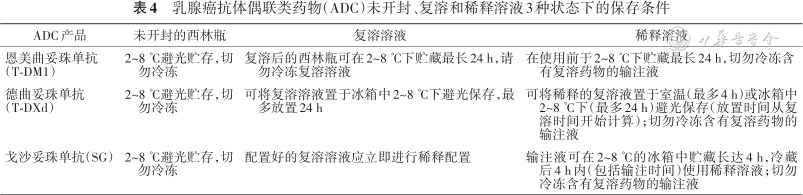
乳腺癌抗体偶联类药物(ADC)未开封、复溶和稀释溶液3种状态下的保存条件
乳腺癌抗体偶联类药物(ADC)未开封、复溶和稀释溶液3种状态下的保存条件
| ADC产品 | 未开封的西林瓶 | 复溶溶液 | 稀释溶液 |
|---|---|---|---|
| 恩美曲妥珠单抗(T-DM1) | 2~8 ℃避光贮存,切勿冷冻 | 复溶后的西林瓶可在2~8 ℃下贮藏最长24 h,请勿冷冻复溶溶液 | 在使用前于2~8 ℃下贮藏最长24 h,切勿冷冻含有复溶药物的输注液 |
| 德曲妥珠单抗(T-DXd) | 2~8 ℃避光贮存,切勿冷冻 | 可将复溶溶液置于冰箱中2~8 ℃下避光保存,最多放置24 h | 可将稀释的复溶液置于室温(最多4 h)或冰箱中2~8 ℃下(最多24 h)避光保存(放置时间从复溶时间开始计算);切勿冷冻含有复溶药物的输注液 |
| 戈沙妥珠单抗(SG) | 2~8 ℃避光贮存,切勿冷冻 | 配置好的复溶溶液应立即进行稀释配置 | 输注液可在2~8 ℃的冰箱中贮藏长达4 h,冷藏后4 h内(包括输注时间)使用稀释溶液;切勿冷冻含有复溶药物的输注液 |
8. ADC药物输注前预防用药:(1)T-DM1:输注前无需预防用药。(2)T-DXd:具有致吐性[包括迟发性恶心和(或)呕吐],每次使用前应预先使用两种或三种药物组合[例如,地塞米松与 5-HT3受体拮抗剂和(或)NK1受体拮抗剂,以及其他适用的药物],用于预防化疗引起的恶心和呕吐。(3)SG:每次SG输注前,建议预先使用退烧药、H1和H2阻滞剂,既往有输注反应的患者可使用糖皮质激素来预防“输液反应”;预先使用两种或者三种药物联合治疗方案(例如:地塞米松与5-HT3)预防恶心和呕吐。
9. ADC药物配伍禁忌:(1)T-DM1:不应使用葡萄糖(5%)溶液,其会引起蛋白质聚集;不得与其他药物混合或稀释。(2)T-DXd:不可使用0.9% 氯化钠溶液进行稀释,其可能会导致颗粒形成;(3)SG:只能使用0.9%的氯化钠溶液配置,请勿将SG替换成含有伊立替康或其活性代谢物SN-38的其他药物,或与此类药物联用。
10. 未使用/过期药品的销毁:(1)应尽量减少药物在环境中释放。(2)药品不得经废水处理,应避免经家庭垃圾销毁。如适用,采用特定“收集系统”进行处理;(3)应严格遵守以下几点有关使用和销毁注射器和其他药用利器的要求:①注射器和针头不能重复使用;②将用过的所有针头和注射器置于尖锐物品容器中(防刺穿的一次性容器)。(4)应根据当地相关规定处置任何未使用/过期的药品或废料。
11. 给药延迟或者漏用处理原则:(1)延迟给药/漏用:如果计划用药延迟或漏用,请尽快给药,无需等到下一个计划的周期。(2)下次给药:调整给药时间表,按正常间隔给药,以维持两次给药之间的3周间隔。(3)以患者在最近一次输液中耐受的剂量和速率进行输液。
推荐意见6:T-DM1、T-DXd及SG 3种ADC药物必须严格按照无菌技术进行溶解配置与稀释,不能相互替换或者联用,为了防止用药错误,输注前应仔细检查、核对西林瓶标签,以确保正在制备和使用的药物正确;药物的配置和用法、用量应严格按照医嘱和使用说明书的要求执行(共识度:100%)。
推荐意见7:ADC药物输注建议优先选择PICC/输液港(共识度98%)。
推荐意见8:如果使用0.9%氯化钠进行T-DM1输注,则需要0.20或0.22 μm的管内PES滤器;T-DXd过滤器仅可使用0.20 或0.22 μm的PES或PS过滤器;SG输注时使用常规输液器即可(共识度:99%)。
推荐意见9:T-DXd和SG输注时输液袋需避光;建议输液装置也需选择避光,输注时尽量关闭窗帘和灯光(共识度:98%)。
推荐意见10:T-DM1和T-DXd输注液可在2~8 ℃的冰箱中贮藏长达24 h;SG输注液可在2~8 ℃的冰箱中贮藏最多4 h,冷藏保存后,应在6 h内(包括输注时间)使用完(共识度:98%)。
推荐意见11:T-DXd和SG具致吐性[包括迟发性恶心和(或)呕吐],每次使用前应预防用药(共识度:100%)。
推荐意见12:T-DM1不应使用葡萄糖(5%)溶液稀释,其会引起蛋白质聚集;不得与其他药物混合或稀释。T-DXd不可使用0.9% 氯化钠溶液进行稀释,其可能会导致颗粒形成;SG只能使用0.9%的氯化钠溶液配置,请勿将SG替换成含有伊立替康或其活性代谢物SN-38的其他药物,或与此类药物联用(共识度:100%)。
推荐意见13:如果计划用药延迟或漏用,请尽快给药,无需等到下一个计划的周期;下次给药时,调整给药时间表,按正常间隔给药,以维持两次给药之间的3周间隔;以患者在最近一次输液中耐受的剂量和速率进行输液(共识度:97%)。
推荐意见14:ADC药物输注前应监测血常规、血生化等指标,输液中严密观察是否有发热、寒战等输液反应,输液后根据观察时间监测不良反应(共识度:98%)。
做好患者健康教育,使用ADC药物前患者遵医嘱充分评估,详细汇报自身情况,包括基础疾病、家族史、化疗史、曾经的化疗不良反应等,遵医嘱按时复查血常规、血生化、心脏超声等,出现不适及时报告医生[13, 14, 15]。
1.ADC药物不良反应:(1)T-DM1:主要不良反应为血小板减少症、转氨酶升高;(2)T-DXd:主要不良反应包括恶心和呕吐、中性粒细胞减少症、输液相关反应、脱发、疲劳、间质性肺疾病(ILD)/肺炎和左心室功能障碍[16, 17]。(3)SG:常见的≥3级不良事件为中性粒细胞减少和腹泻[13,15]。
2. ADC药物常见不良反应的健康教育
(1)血液系统不良反应:血液系统不良反应是ADC药物常见的不良反应,包括全血细胞减少、发热性中性粒细胞减少症(febrile neutropenia,FN)、血小板减少症等[13, 14,18],在治疗期间应遵医嘱,定期监测血常规和体温,若体温>38 ℃时及时就诊[13]。
当出现FN不良反应时,患者应注意:减少外出,活动轻、慢,避免去人群聚集的公共场所,避免因受伤而增加感染机会,如若外出规范佩戴口罩;每日开窗通风2次,每次30 min[19],且养成良好的个人习惯,勤洗手,饮食要加强消毒,勿食生冷、不洁的食物[15,20];监测血常规变化,必要时遵医嘱注射粒细胞集落刺激因子(G-CSF),注射后可能会出现发热、全身肌肉骨骼疼痛等不适症状;住院期间应减少探视并监测体温。
注意血小板减少症,血小板低于100×109/L为血小板减少,当血小板低于50×109/L时会有出血危险,当血小板低于10×109/L时容易发生中枢神经系统出血、胃肠道出血及呼吸道出血[13,21, 22]等不良反应。当出现血小板减少症时,患者生活中应注意尽量卧床,避免磕碰以及抓挠、剔牙、抠鼻等容易带来损伤的动作;饮食宜软,易消化,温度不宜过高,可以选择流食或半流食,避免进食骨头、鱼刺、粗纤维等较硬的食物,以免划伤胃肠道;口腔护理,刷牙时使用软毛刷,进餐后用清水漱口;各种穿刺拔针后加长按压时间;观察大小便颜色,注意有无消化系统和泌尿系统出血,女性月经期注意月经量[23]。如有异常出血,及时报告医护人员遵医嘱监测血常规变化,必要时遵医嘱使用升血小板药物。如患者出现视力模糊、头痛、头晕、呕吐等不适提示有颅内出血的可能,应立即就诊或报告医生。
(2)输液反应:输液反应主要症状包括发热、寒战,偶尔会有恶心、呕吐、疼痛、头痛、晕眩、呼吸困难、低血压、皮疹和乏力。严重的输液相关反应(IRR)症状则包括呼吸困难、低血压、哮鸣、支气管痉挛、心动过速、呼吸窘迫、室上性快速性心律失常和荨麻疹[13,15]。患者禁止自行调节输液器,当出现主观反应时及时关闭输液器上端的夹子,同时报告给护士或医生。
(3)周围神经病变:周围神经病变主要症状表现为感觉减退、感觉过敏、感觉倒错和烧灼性疼痛等各种神经痛的症状,严重者可出现四肢无力,蹲起困难,无法行走,甚至卧床[13]。患者接受治疗时,如出现手足麻木、刺痛症状及时报告医护人员[13,24];若患者出现因肢体无力步态不稳,需要辅助工具方可行走,或因肢体麻木导致疼痛等周围神经病变时,遵医嘱使用各种B族维生素营养神经治疗[24]。
周围神经病变引起感觉缺失、位置觉减退、感觉性共济失调等不良反应,增加了患者跌倒风险,因此患者需做到五防:防跌倒、防磕碰、防烫伤、防冻伤、防锐器伤[24]。饮食选择易于消化并富有营养的软食,补充维生素B1含量高的食物,如胚粉、大麦、青稞、小米等杂粮,大豆等豆类,白菜和坚果等。遵医嘱口服一些营养神经的药物,如甲钴胺、维生素B1、叶酸等[14,24]。
(4)肺毒性:①患者在出现咳嗽、呼吸困难、发烧和(或)任何新的恶化的呼吸道症状[13,25]时应立即报告医生。常见的有间质性肺炎症如呼吸困难、干咳、发热或原有呼吸系统症状加重[23,26];体征有干湿啰音、呼吸频率增加[16,27]。当患者出现间质性肺炎不良反应时,应及时告知医生进行识别诊断,遵从“早发现、早识别、早诊断、早治疗”的“四早”原则,并进行呼吸功能训练和运用训练[28, 29]。②腹式呼吸:患者可以每天进行练习,每次5~15 min,每次训练5~7次,逐渐养成平稳而缓慢的腹式呼吸的习惯。需要注意的是,呼吸要深长而缓慢,用鼻吸气,嘴呼气[26];呼吸体操:蹲站呼吸:双手自然放松,做下蹲动作同时吸气,站立时缓慢呼气等[23,25]。③运动训练:骑车、步行[30]。耐力训练过程中以自己不感到疲劳为准。间歇训练:该训练是耐力训练的改进,高强度运动与定期休息或低强度运动,呼吸训练和运动训练可穿插进行,适合因呼吸困难、疲劳或其他症状而难以达到目标强度或持续时间的肺损伤患者[15]。
(5)消化道不良反应:轻度消化道反应是ADC药物常见的不良反应,包括恶心、呕吐和腹泻等[17,31],通常不会产生严重后果,若发生严重消化道反应需及时就诊。出现或恶化的胃肠道症状,包括严重的腹痛,请立即就医。
(6)心脏毒性:心脏毒性表现为左心室射血分数(LVEF)下降[13,16]。用药之前,按医生要求进行全面评估,包括个人史和家族史,充分纠正心血管病等危险因素。治疗期间遵医嘱动态定期复查心电图和心脏超声。
推荐意见15:为保证患者用药安全,应向患者进行自身情况评估、遵医嘱按时复查和常见不良事件反应注意和观察等宣教,嘱咐患者不适及时报告医生(共识度:100%)。
推荐意见16:需对患者进行输注常见不良反应的健康宣教,包括血液系统不良反应、输注反应、周围神经病变、肺毒性、消化道不良反应、心脏毒性等(共识度:97%)。
随着ADC发展势头不断增强,兼具抗体药物精准靶向和小分子细胞毒药物高效杀伤优势的“生物导弹”已逐渐改变乳腺癌领域治疗格局。ADC药物的规范化输注以及不良反应的预防和管理对于ADC药物治疗连续性及患者预后转归极为重要。乳腺癌领域主要ADC药物(T-DM1、SG、T-DXd)由于分子结构特性各不相同,临床操作时应根据各产品的剂量、配置、贮藏、给药方式和用药时间等流程规范操作,本文中,中国医药教育协会乳腺癌个案管理师分会尽可能全面地就T-DM1、SG、T-DXd三种ADC药物的输注及不良反应健康教育进行总结,希望能够为国内医护人员在ADC药物输注方面提供标准化的指导和建议,从而使患者获得最大受益。
共识制定委员会及专家组
顾问:王建东(解放军总医院第一医学中心普通外科)
执笔者:黄利虹(解放军总医院第一医学中心普通外科)
参与编写及讨论专家组成员(按姓氏汉语拼音排序):陈波(中国医科大学附属第一医院乳腺外科);陈燕(杭州爱倍生综合门诊部);陈莹(广西医科大学附属肿瘤医院乳腺及骨软组织肿瘤内科);方群英(浙江省肿瘤医院乳腺科);甘泉(解放军总医院第一医学中心门诊部);郭凌云(山西省肿瘤医院乳腺外科);郭丝锦(空军军医大学第一附属医院甲乳血管外科);黄利虹(解放军总医院第一医学中心普通外科);季静芬(中南大学湘雅二医院普外科);金自卫(中南大学湘雅二医院乳腺外科);李丽莉(中国医科大学附属第一医院乳腺外科);李倩(中山大学孙逸仙纪念医院);凌穗欣(敦复医疗集团);刘芳(青岛大学附属医院乳腺病诊疗中心崂山院区乳腺病诊疗中心);罗凤(重庆医科大学第一附属医院乳甲外科);梅志红(中国医学科学院肿瘤医院内科);彭爱荣(山东省淄博市中心医院肿瘤科);彭昕(华中科技大学同济医学院附属协和医院肿瘤中心);裘佳佳(上海复旦大学附属肿瘤医院护理部);单会莲(中国医科大学盛京医院乳腺肿瘤外科);王海波(青岛大学附属医院乳腺中心);王建新(河北医科大学第四医院河北省肿瘤医院);王萍(解放军总医院第一医学中心日间诊疗科);王欣(中国医科学院肿瘤医院乳腺外科);王影新(北京大学第一医院护理部);王垣晓(云南省肿瘤医院护理部);吴加花(广东省中医院);徐卫英(江西省肿瘤医院);颜其临(桂林市中医医院乳腺科);杨春敏(广东省中医院大学城医院);尤渺宁(北京大学肿瘤医院);于新颖(北京大学肿瘤医院);张惠婷(中山大学肿瘤防治中心乳腺科);张静(解放军总医院第一医学中心乳腺外科);张男(上海交通大学附属瑞金医院乳腺疾病诊治中心);张志茹(吉林大学白求恩第一医院乳腺外科);赵岚(解放军总医院第一医学中心);赵权萍(北京大学人民医院乳腺中心);周毅(贵州医科大学附属医院)
中国医药教育协会乳腺癌个案管理师分会. 乳腺癌抗体偶联药物输注管理专家共识[J]. 中华医学杂志, 2023, 103(34): 2704-2712. DOI: 10.3760/cma.j.cn112137-20230522-00831.
所有编写者声明不存在利益冲突


























