
中国的胃癌负担沉重,新发病例及死亡人数居世界首位。通过风险评估、筛查、减少危险因素,可有效预防胃癌,但中国目前尚缺乏循证指南来指导普通大众进行胃癌风险管理。本指南由中国抗癌协会胃癌专业委员会及中国医师协会外科医师分会上消化道外科医师委员会联合发起,通过系统梳理胃癌风险评估及预防相关证据,结合专家意见,针对17个指南问题形成了推荐意见。本指南将为普通大众提供全面的胃癌预防指导建议,以期推动胃癌防治关口前移,降低发病、减少疾病负担。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
胃癌是起源于胃黏膜上皮的恶性肿瘤,占胃部恶性肿瘤的95%以上。国际癌症研究机构报告显示2020年全球约有108.9万胃癌新发病例,发病率在所有癌症中排名第4位[1]。胃癌少见于50岁以下人群,发病率随年龄增长而增长,在55~80岁年龄段达到最高,男性是女性的两倍[1, 2, 3]。全球范围内,东亚、东欧和南美洲是胃癌高发地区,东亚地区以中国、日本和韩国发病率最高[2]。中国的胃癌负担尤其沉重,2022年胃癌新发病例约为50.9万,死亡人数约为40万,居全球首位[3]。
胃癌的发生与遗传、生活方式、幽门螺旋杆菌(Helicobacter pylori,Hp)感染等紧密相关。得益于人们在根治Hp感染、胃癌早筛等方面工作的开展,全球胃癌发病率逐年下降[1]。胃癌的临床治疗效果与其诊断的早晚紧密相关,早期胃癌经积极治疗可达到治愈,进展期胃癌即使经过手术,5年生存率也仅为35%左右。而胃癌早期症状不明显,大部分患者出现相应症状首诊时已进入进展期[4]。确定胃癌高危人群并提高早期诊断率,对改善治疗效果有着重要意义。
目前,我国早期胃癌的诊治率低于10%,远不如日本(70%)和韩国(50%)[5]。2005、2007及2012年,我国分别开展了在农村、淮河流域以及城市地区的恶性肿瘤早期诊断和治疗项目[6]。2018年,国家消化系统疾病临床医学研究中心联合中华医学会消化内镜学分会等制定了《中国早期胃癌筛查流程专家共识意见》[7],2022年,国家癌症中心受国家卫生健康委疾病控制预防局委托,制定了《中国胃癌筛查早诊早治指南》[8],为我国胃癌的早筛工作奠定了基础。
胃癌筛查对于查找早期肿瘤并积极治疗,提高治疗效果具有重要意义。一般人群通过减少有害因素可预防胃癌。但由于卫生资源是有限的,对全人群实施预防难度巨大,只有通过危险分层策略,精准个体化预防才具有成本效益。就胃癌而言,中国目前尚缺乏循证指南来指导公众进行胃癌风险评估并个体化预防。因此,本项目通过对胃癌风险评估及预防措施的相关证据进行系统梳理总结,结合专家意见,形成公众指南,来指导普通大众进行有效的胃癌预防。
本指南由中国抗癌协会胃癌专业委员会(Chinese Gastric Cancer Association,CGCA)、中国医师协会外科医师分会上消化道外科医师委员会(Chinese Society of Upper Gastrointestinal Surgeons,CSUGS)联合发起,由中山大学附属第七医院组织实施,由兰州大学循证医学中心/世界卫生组织(WHO)指南实施与知识转化合作中心提供方法学支持。指南的制定步骤参考2014年发布的《世界卫生组织指南制定手册》及中华医学会发布的《中国制定/修订临床诊疗指南的指导原则(2022版)》,并参考指南研究与评价工具(Appraisal of Guidelines for Research and Evaluation Ⅱ,AGREE Ⅱ)和卫生保健实践指南的报告条目(Reporting Items for Practice Guidelines in Healthcare,RIGHT)制定指南计划书和正式指南文件。本指南已在国际实践指南注册平台进行注册(PREPARE- 2022CN454)。本指南制定方法已成熟应用于其他临床领域[9, 10]。本指南适用于各级医院、基层社康中心、疾病预防控制中心等卫生机构。指南的使用人群为全国各民族、地区的一般人群,尤其是潜在罹患胃癌的高风险人群。
1. 指南工作组组建:指南工作组包括指导委员会、共识专家组、指南制定组及外审组4个小组。各小组成员共同组成中国人群健康风险管理协作组-胃癌专业组(Chinese Health Risk Management Collaboration-Gastric Cancer Group,CHRIMAC-GC)。指导委员会由5位国内权威消化外科专家及指南方法学专家组成。指导委员会的主要职责是:(1)确定指南主题和范围;(2)组建其他指南工作组,管理其利益声明;(3)批准指南计划书;(4)监督指南制定流程;(5)批准推荐意见和指南全文;(6)监测并评估指南的更新需求。共识专家组由40名成员组成,具有地域、学科和性别的代表性,专业涵盖消化病学、预防医学、健康管理学和营养学等。指南制定组包括秘书组和证据评价组,成员数量为30名,主要由发起机构的人员组成,全面负责指南的协调、证据和资料的收集、合成及评价,用GRADE分级系统制作决策各项工作的安排和记录,专家的联络与沟通及其他工作组未涵盖的所有事宜。外审组含成员6名,由与该指南相关,但未参与本指南制定的专家或人员组成,主要负责对指南初稿进行评审。所有成员将按要求填写相关利益冲突声明表。
2. 问题形成:指南指导委员会根据专家经验并调查国内胃癌风险管理的相关指南、系统评价,初步确定可纳入的指南问题。2022年7月20日在中山大学附属第七医院消化医学中心召开讨论会进行内部讨论,初步形成指南问题框架。2022年8月1~5日,指南小组对全国140多名消化医师、预防医学专家、健康管理专家进行在线问卷调查,对指南问题进行了补充。2022年8月20日,中山大学附属第七医院召开第一次全国指南讨论会议,对指南问题的重要性按照GRADE工作组推荐的Delphi方法进行评估,最终确定17个核心问题。
3. 证据检索:证据评价组首先针对共识问题检索相关共识指南及系统评价/荟萃分析。检索的数据库包括PubMed、Embase、Cochrane Library、中国生物医学文献数据库(CBM)、万方数据和中国知网(CNKI)。同时检索了常用的临床指南网站:美国国立指南文库、国际指南协作网、世界卫生组织网站,并检索Google学术等网站进行补充。检索时间为从建库时间到2022年8月,限定语言为英文或中文。此外,对于纳入的文献进一步追溯参考文献进行补充。
4. 系统评价:本指南纳入系统评价/荟萃分析作为各个指南问题。当没有合适的系统评价/荟萃分析,或方法学质量较低,或发表时间>3年时,证据评价小组将开展新的系统评价/荟萃分析。
制定快速系统评价的方法参考Cochrane系统评价手册[11]。新的系统评价针对具体问题纳入随机对照试验、队列研究、病例对照研究等类型的原始研究。证据评价小组将依据研究问题制定检索策略,检索PubMed、Embase、CNKI等主要数据库,并进行补充检索会议文献、参考文献等。根据题目、摘要和全文顺序逐级筛选文献,根据预先设计的资料提取表提取信息。根据原始研究类型,使用Cochrane偏倚风险评价工具、纽卡斯尔-渥太华量表(Newcastle-Ottawa Scale,NOS)进行偏倚风险评估。每篇文献的筛选、信息提取和质量评价工作均由两人独立完成,若存在分歧,则共同讨论解决。证据小组评估纳入研究的临床异质性、方法学异质性及统计学异质性。符合荟萃合并条件下,采用随机效应模型综合研究获得合并效应量,并评估发表偏倚风险。
5. 证据质量评价与证据体形成:针对每一个指南问题,基于已有的或者新制作的系统评价/荟萃分析进行证据质量评价。依据GRADE方法[12, 13],证据质量将被分为高、中、低和极低4个等级。在证据分级过程中,考虑5个降级因素(局限性、不精确性、不一致性、间接性以及发表偏倚)和3个升级因素(效应量大、剂量反应关系以及可能的混杂因素)。完成证据分级后,通过证据总结表呈现证据,形成指南证据体。
6. 推荐意见形成:共识小组依据前期形成的证据体,针对每个指南问题,讨论形成1条或多条初步推荐意见。指南专家于2022年12月3日在中山大学附属第七医院召开第2次全国专家共识会议,通过3轮Delphi法调查,就推荐意见达成共识。共识专家通过考虑干预的利弊平衡、对效应估计的把握程度、价值观及偏好以及医疗资源等因素,对推荐意见进行表决[13]。表决步骤分两步实施[13]:第一,推荐或反对某一干预措施至少需要50%的专家认可,且选择替代措施的专家少于20%。未满足此项标准将不产生推荐意见。第二,一个推荐意见被列为强推荐而非弱推荐,则需要得到至少70%的专家认可。“强推荐”意见使用“推荐……”进行表述。若未达到上述标准,则定义为“弱推荐”,使用“建议……”进行表述。
7. 指南撰写、发布与更新:推荐意见完成后,由秘书组撰写指南全文,提交外审小组进行评审。为提高公众的可读性,我们邀请了7名不同教育程度、职业背景的公众代表对指南进行审阅。最后由指南指导委员会审核定稿。本指南参考卫生保健实践指南的报告条目进行报告。通过学术期刊论文、学术会议、网络媒体等进行传播。计划在2025年左右对推荐意见进行更新。
本指南针对17个临床问题形成了推荐意见,具体如下:
指南问题1:普通大众如何进行胃癌风险评估及筛查?
推荐意见1:推荐40岁以上普通大众,按胃癌风险自评➝生物标志物初步筛查➝内镜下精查的次序,逐级进行胃癌风险评估及筛查(强推荐,证据级别:低)。
1. 胃癌筛查意义:胃癌的恶性程度高,患者的生存时间与其临床诊断的早晚密切相关。胃癌风险的评估和筛查可提高人群胃癌早期病变检出率,改善患者预后,延长生存时间。
现有较为常见的筛查手段包括血清生物标志物检查[胃蛋白酶原(PG)、胃泌素-17(G-17)及胃癌相关抗原(MG7-Ag)]及内镜筛查等。指南小组开展了系统评价,综合分析截至2022年全球10项研究数据的结果显示,内镜筛查组与不筛查组相比,胃癌死亡率下降了42%。研究显示PG指标异常也与胃癌死亡率显著相关(表1)[14]。此外,幽门螺杆菌感染与胃癌密切相关(详见指南问题2),其检测也是胃癌筛查及风险评估的重要组成部分。
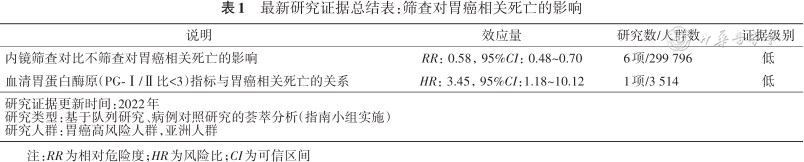
最新研究证据总结表:筛查对胃癌相关死亡的影响
最新研究证据总结表:筛查对胃癌相关死亡的影响
| 说明 | 效应量 | 研究数/人群数 | 证据级别 |
|---|---|---|---|
| 内镜筛查对比不筛查对胃癌相关死亡的影响 | RR:0.58,95%CI:0.48~0.70 | 6项/299 796 | 低 |
| 血清胃蛋白酶原(PG-Ⅰ/Ⅱ比<3)指标与胃癌相关死亡的关系 | HR:3.45,95%CI:1.18~10.12 | 1项/3 514 | 低 |
| 研究证据更新时间:2022年研究类型:基于队列研究、病例对照研究的荟萃分析(指南小组实施)研究人群:胃癌高风险人群,亚洲人群 | |||
注:RR为相对危险度;HR为风险比;CI为可信区间
胃癌筛查也存在一定负面影响,包括过度诊断、假阳性导致的不必要的检查、治疗和心理压力、假阴性导致的病情延误以及筛查操作本身可能导致的并发症(如内镜导致的感染等)等。同时,考虑到筛查所需要的医疗资源和收益,推荐胃癌筛查遵循从非侵入初筛(胃癌风险自评,生物标志物筛查)到侵入性精查(内镜)的策略进行。
2. 胃癌风险评估:《中国胃癌筛查与早诊早治指南(2022,北京)》推荐我国年龄45岁及以上,且符合下列任一条件者为胃癌高风险人群[8]:(1)长期居住于胃癌高发区(高发地区:辽东半岛、山东半岛、长江三角洲、太行山脉等;高发省份:辽宁、福建、甘肃、山东、江苏等);(2)幽门螺杆菌感染;(3)既往患有慢性萎缩性胃炎、胃溃疡、胃息肉、手术后残胃、肥厚性胃炎、恶性贫血等胃癌前疾病;(4)一级亲属有胃癌病史;(5)存在胃癌其他高危因素(高盐、腌制饮食、吸烟、重度饮酒等)。
基于常规危险因素资料建立风险自评工具有助于更加精确自评胃癌风险,如基于中国人群的胃癌风险评分系统(Gastric Cancer Risk Scoring System,GC-RSS)评分,根据年龄、性别、家族史、吸烟、饮酒、等因素来评估胃癌风险(表2)[15]。该风险评估分数总分13分,评分≥5分建议进一步进行胃癌筛查。在医疗资源比较匮乏的地区,可将筛查评分标准定义为≥8分[15]。该评分系统还需要进一步验证。

中国人群胃癌风险评分系统(GC-RSS)
中国人群胃癌风险评分系统(GC-RSS)
| 变量 | 分数 |
|---|---|
| 年龄 | |
| 45~49 | 0 |
| 50~54 | 1 |
| 55~59 | 2 |
| 60~64 | 3 |
| 65~69 | 4 |
| 性别 | |
| 女 | 0 |
| 男 | 2 |
| 胃癌家族史a | |
| 否 | 0 |
| 是 | 1 |
| 吸烟b | |
| 否 | 0 |
| 是 | 1 |
| 饮酒c | |
| 否 | 0 |
| 是 | 1 |
| 体质指数(kg/m2) | |
| ≥18.5 | 0 |
| <18.5 | 1 |
| 食用含盐食物(每周1次) | |
| <1 | 0 |
| ≥1 | 1 |
| 饮食不规律 | |
| 否 | 0 |
| 是 | 1 |
| 食用腌制食品(每周1次) | |
| <1 | 0 |
| ≥1 | 1 |
注:a为胃癌家族史定义为直系亲属及三代以内亲属有胃癌病例;b为吸烟被定义为每年至少吸烟18包;c为饮酒定义为每周至少两次饮用中国白酒(含>40%酒精),持续时间≥12个月
本指南为公众指南,对血清学及内镜筛查的检测方法、频率、结果解读等临床相关信息不作深入介绍,推荐大众在医疗机构由临床专家指导开展胃癌筛查并进行解读,具体可参考《中国胃癌筛查与早诊早治指南(2022,北京)》《中国早期胃癌筛查专家共识(2017年)》等临床实践指南或共识。
指南问题2:根除幽门螺杆菌是否能够降低胃癌发生风险?
推荐意见2:推荐幽门螺杆菌感染阳性患者接受根除幽门螺杆菌治疗,以降低胃癌发病及相关死亡风险(强推荐,证据级别:中)。
幽门螺杆菌是一种可在胃中生存的微生物,中国人群个体感染率达40.6%,家庭感染率达71.2%[16]。幽门螺杆菌感染可引起慢性胃炎,导致胃溃疡和胃萎缩,严重者则发展为胃癌。研究表明,幽门螺杆菌感染是胃癌发生的明确诱因,感染者的胃癌发生风险约为非感染者的3倍[17]。国际癌症研究机构报告显示,约78%的胃癌发生与幽门螺杆菌感染有关[18]。
幽门螺杆菌可通过药物治疗清除,有效率可达75%~90%。根除幽门螺杆菌能够降低胃癌发生和相关死亡风险。综合分析截至2019年全球10项随机对照试验数据的结果[19]显示,根除幽门螺杆菌治疗能够使胃癌发生风险降低46%,使胃癌相关死亡风险降低39%(表3)。此外,对接受内镜治疗的早期胃癌进行根除治疗,能够使胃癌的复发风险降低51%。
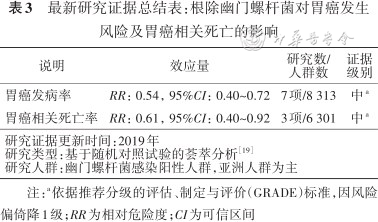
最新研究证据总结表:根除幽门螺杆菌对胃癌发生风险及胃癌相关死亡的影响
最新研究证据总结表:根除幽门螺杆菌对胃癌发生风险及胃癌相关死亡的影响
| 说明 | 效应量 | 研究数/人群数 | 证据级别 |
|---|---|---|---|
| 胃癌发病率 | RR:0.54,95%CI:0.40~0.72 | 7项/8 313 | 中a |
| 胃癌相关死亡率 | RR:0.61,95%CI:0.40~0.92 | 3项/6 301 | 中a |
| 研究证据更新时间:2019年研究类型:基于随机对照试验的荟萃分析方正汇总行[19]研究人群:幽门螺杆菌感染阳性人群,亚洲人群为主 | |||
注:a依据推荐分级的评估、制定与评价(GRADE)标准,因风险偏倚降1级;RR为相对危险度;CI为可信区间
指南问题3:戒烟是否能够降低胃癌发生风险?
推荐意见3:推荐戒烟来降低胃癌发生风险(强推荐,证据级别:中)。
烟草是一级致癌物,烟草中含上千种有害化学物质,据美国食品和药物管理局统计,全世界共有11.4亿吸烟者,烟草在20世纪造成1亿人死亡,在21世纪,死亡人数可能会再增加10亿[20]。
已有大量研究证实吸烟会增加胃癌发病风险。综合截至2020年全球95项相关研究数据的分析结果显示,和从不吸烟的人相比,当前吸烟者的胃癌发生风险增加了61%,曾经吸烟者的胃癌发生风险增加43%(表4)[21],且吸烟所导致的胃癌风险在男性中相对在女性中更高[22]。因此,推荐普通大众戒烟,预防胃癌的发生。
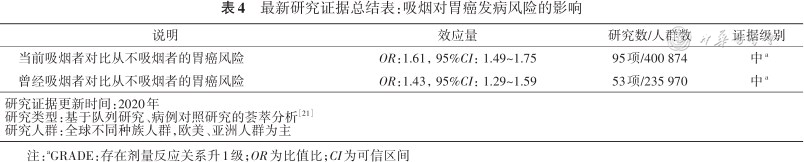
最新研究证据总结表:吸烟对胃癌发病风险的影响
最新研究证据总结表:吸烟对胃癌发病风险的影响
| 说明 | 效应量 | 研究数/人群数 | 证据级别 |
|---|---|---|---|
| 当前吸烟者对比从不吸烟者的胃癌风险 | OR:1.61,95%CI:1.49~1.75 | 95项/400 874 | 中a |
| 曾经吸烟者对比从不吸烟者的胃癌风险 | OR:1.43,95%CI:1.29~1.59 | 53项/235 970 | 中a |
| 研究证据更新时间:2020年研究类型:基于队列研究、病例对照研究的荟萃分析方正汇总行[21]研究人群:全球不同种族人群,欧美、亚洲人群为主 | |||
注:aGRADE:存在剂量反应关系升1级;OR为比值比;CI为可信区间
指南问题4:控制食用盐摄入是否能够降低胃癌发生风险?
推荐意见4:推荐控制食用盐摄入来降低胃癌发生风险(强推荐,证据级别:中)。
人体摄入过量的食盐会导致胃黏膜损伤和萎缩,增加基因突变的可能性,升高胃癌发生风险[23]。
研究证据显示过多的食盐摄入能显著升高人群胃癌发生风险。综合分析截至2021年全球相关26项前瞻性队列研究的结果[24]显示:与较低的钠盐摄入量人群相比,中等钠盐摄入量人群胃癌的风险增加20%,较高钠盐摄入量人群胃癌的风险增加25%(表5)。进一步分析发现钠盐与胃癌的关系在亚洲人群中尤为明显。
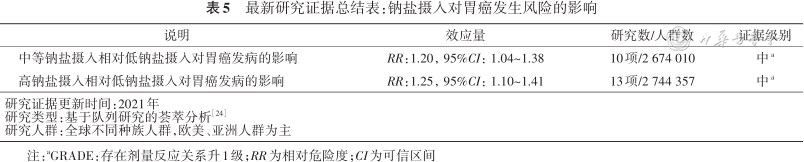
最新研究证据总结表:钠盐摄入对胃癌发生风险的影响
最新研究证据总结表:钠盐摄入对胃癌发生风险的影响
| 说明 | 效应量 | 研究数/人群数 | 证据级别 |
|---|---|---|---|
| 中等钠盐摄入相对低钠盐摄入对胃癌发病的影响 | RR:1.20,95%CI:1.04~1.38 | 10项/2 674 010 | 中a |
| 高钠盐摄入相对低钠盐摄入对胃癌发病的影响 | RR:1.25,95%CI:1.10~1.41 | 13项/2 744 357 | 中a |
| 研究证据更新时间:2021年研究类型:基于队列研究的荟萃分析方正汇总行[24]研究人群:全球不同种族人群,欧美、亚洲人群为主 | |||
注:aGRADE:存在剂量反应关系升1级;RR为相对危险度;CI为可信区间
《中国居民膳食指南(2022)》建议成年人每天摄入食盐不超过5 g,并减少腌制蔬菜、咸鱼等高盐食物的单次摄入量和摄入频率[25]。
指南问题5:限制油炸、烧烤、腌制和烟熏食品的摄入是否能够降低胃癌发生风险?
推荐意见5:推荐限制油炸、烧烤、腌制和烟熏食品的摄入来降低胃癌发生风险(强推荐,证据级别:低)。
腌制、烧烤、烟熏和油炸等是常见的食物加工方式,然而长期食用这类食品存在健康危害。经熏烤腌制的禽肉、畜肉、鱼肉等,豆制品、蔬菜瓜果经过腌制发酵而制成的腌制食品,不仅是高盐食物的典型代表,同时这些食品还产生Ⅰ类致癌物N-亚硝基化合物等。烧烤、油炸等烹饪过程会破坏维生素、蛋白质等营养成分,食物脂肪焦化产生的热聚合反应与蛋白质的结合也易产生苯并芘等高致癌物。
研究显示经常摄入油炸、烧烤、腌制、烟熏等食物可升高胃癌风险[26]。综合分析截至2022年全球相关28项观察性研究数据显示,与较少摄入此类食物人群相比,常吃腌制食品人群胃癌发生风险增加2.21倍,常吃烧烤食物人群风险增加2.64倍,常吃烟熏食品人群风险增加1.99倍,常吃油炸食品人群风险增加2.82倍(表6)。《中国居民膳食指南2022》也推荐少吃腌制、烟熏食品,限制深加工肉制品的摄入量[25]。

最新研究证据总结表:高腌制、烧烤、烟熏和油炸食品的摄入人群相对低摄入人群的胃癌发生风险
最新研究证据总结表:高腌制、烧烤、烟熏和油炸食品的摄入人群相对低摄入人群的胃癌发生风险
| 说明 | 效应量 | 研究数/人群数 | 证据级别 |
|---|---|---|---|
| 腌制食品摄入与胃癌发生的关联 | OR:2.21,95%CI:2.03~2.38 | 28项/13 580 | 低 |
| 烟熏食品摄入与胃癌发生的关联 | OR:1.99,95%CI:1.46~2.70 | 15项/9 385 | 低 |
| 烧烤食品摄入与胃癌发生的关联 | OR:2.64,95%CI:2.02~3.44 | 7项/2 128 | 低 |
| 油炸食品摄入与胃癌发生的关联 | OR:2.82,95%CI:1.94~4.09 | 5项/2 790 | 低 |
| 研究证据更新时间:2021年研究类型:基于病例对照研究的荟萃分析方正汇总行[26]研究人群:中国人群 | |||
注:OR为比值比;CI为可信区间
指南问题6:摄入足量的蔬菜水果是否能够降低胃癌发生风险?
推荐意见6:推荐每天摄入足量新鲜的蔬菜水果来降低胃癌的发生风险(强推荐,证据级别:低)。
新鲜的蔬菜和水果富含类黄酮、维生素C、番茄红素等生物活性物质,具有抗氧化、预防癌症等作用。摄入足够的新鲜水果和蔬菜可以降低高血压、糖尿病、心脑血管疾病、癌症等多种疾病的发生风险。
综合分析截至2020年全球17项相关研究数据的结果显示,每周摄入水果≥3次与<3次的人群相比,胃癌风险降低62%[21];每周摄入蔬菜≥3次与<3次的人群相比,胃癌风险降低38%[21](表7)。
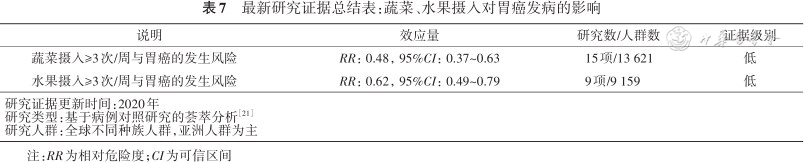
最新研究证据总结表:蔬菜、水果摄入对胃癌发病的影响
最新研究证据总结表:蔬菜、水果摄入对胃癌发病的影响
| 说明 | 效应量 | 研究数/人群数 | 证据级别 |
|---|---|---|---|
| 蔬菜摄入≥3次/周与胃癌的发生风险 | RR:0.48,95%CI:0.37~0.63 | 15项/13 621 | 低 |
| 水果摄入≥3次/周与胃癌的发生风险 | RR:0.62,95%CI:0.49~0.79 | 9项/9 159 | 低 |
| 研究证据更新时间:2020年研究类型:基于病例对照研究的荟萃分析方正汇总行[21]研究人群:全球不同种族人群,亚洲人群为主 | |||
注:RR为相对危险度;CI为可信区间
蔬菜对胃癌的保护作用与其种类有关。韭菜、大蒜、洋葱、葱类蔬菜、十字花科蔬菜等可以显著降低胃癌发生风险[27],而腌制蔬菜则与胃癌的风险增加有关。《中国居民膳食指南(2022)》建议成年人每天都应吃蔬菜和水果,每天至少摄入300 g新鲜蔬菜(深色蔬菜应占一半)和200~350 g新鲜水果[25]。
指南问题7:增加体力活动是否能够降低胃癌发生风险?
推荐意见7:建议保持适量的体力活动来降低胃癌发生风险(弱推荐,证据级别:中)。
体力活动泛指任何由骨骼肌收缩引起的能量消耗的身体运动,包括职业活动(如生产、搬运等)、交通出行(步行、自行车等)、家务活动、业余活动等。身体活动不足会影响人的身体发育、心理状况、睡眠质量和骨骼健康,是很多疾病共同的致病因素。
研究显示体力活动缺乏与胃癌发病紧密相关。综合分析截至2021年全球相关研究数据的结果显示,高体力活动人群相对低体力活动人群,胃癌风险相对降低了17%(表8)[28]。
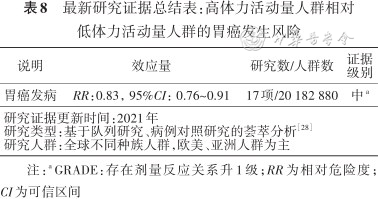
最新研究证据总结表:高体力活动量人群相对低体力活动量人群的胃癌发生风险
最新研究证据总结表:高体力活动量人群相对低体力活动量人群的胃癌发生风险
| 说明 | 效应量 | 研究数/人群数 | 证据级别 |
|---|---|---|---|
| 胃癌发病 | RR:0.83,95%CI:0.76~0.91 | 17项/20 182 880 | 中a |
| 研究证据更新时间:2021年研究类型:基于队列研究、病例对照研究的荟萃分析[28]研究人群:全球不同种族人群,欧美、亚洲人群为主 | |||
注:a GRADE:存在剂量反应关系升1级;RR为相对危险度;CI为可信区间
世界卫生组织最新发布的《关于身体活动和久坐行为指南》推荐健康成年人每周应至少进行150~300 min的中等强度有氧运动(如步行、骑车等),或75~150 min的高强度有氧活动(如跑步、游泳等),或等量的中等强度和高强度有氧活动组合。大众应该在身体条件容许的情况下,适当增加体力活动量。中老年居民和慢性病患者,如身体允许,可参照上述的身体活动推荐;如身体不允许,仍鼓励根据自身情况进行规律的身体活动。
指南问题8:控制体重是否能够降低胃癌发生风险?
推荐意见8:建议控制体重来降低胃癌的发生风险(弱推荐,证据级别:中)。
肥胖被认为是一种诱发炎症和致癌的状态,也是一个可改变的致病因素。研究证据表明,身体脂肪分布,尤其是腹部肥胖与多种慢性疾病的发生有关,腹部肥胖对健康的威胁比一般肥胖更大。
指南小组对该问题研究进行了系统评价,综合分析截至2022年全球相关8项研究数据的结果显示,腹型肥胖可以显著增加人群发生胃癌的风险,腰围越大胃癌的风险越高,与腰围较小的人群相比,腰围较大的人群胃癌发生风险升高了38%(表9)。
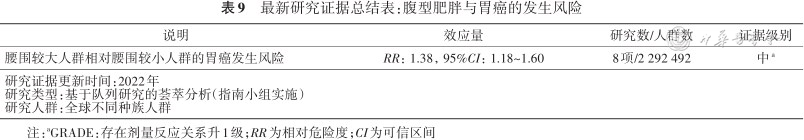
最新研究证据总结表:腹型肥胖与胃癌的发生风险
最新研究证据总结表:腹型肥胖与胃癌的发生风险
| 说明 | 效应量 | 研究数/人群数 | 证据级别 |
|---|---|---|---|
| 腰围较大人群相对腰围较小人群的胃癌发生风险 | RR:1.38,95%CI:1.18~1.60 | 8项/2 292 492 | 中a |
| 研究证据更新时间:2022年研究类型:基于队列研究的荟萃分析(指南小组实施)研究人群:全球不同种族人群 | |||
注:aGRADE:存在剂量反应关系升1级;RR为相对危险度;CI为可信区间
因此,推荐控制体重,减少腹部肥胖,保持腰围在健康范围内(男性腰围<90 cm,女性腰围<80 cm)来降低胃癌的发生风险。
指南问题9:减少饮酒是否能够降低胃癌发生风险?
推荐意见9:建议减少饮酒或戒酒来降低胃癌的发生风险(弱推荐,证据级别:中)。
酒精可刺激胃肠道,导致恶心、呕吐、腹痛等症状,引起胃黏膜损伤与出血。同时,酒精对肝脏、神经系统和内分泌系统等也会造成一定的损伤。
酒精摄入与胃癌的发生密切相关。综合分析截至2021年全球相关81项研究数据的结果显示,相比不饮酒人群,饮酒人群(≥14 g酒精/d)的胃癌发生风险增加了20%,而酗酒人群(≥42 g酒精/d或140 g纯酒精/周)的胃癌发生风险增加了30%(表10)[29]。进一步分析显示胃癌风险明显随饮酒量增加而增加,且饮酒对胃癌风险的影响在中国人群中尤其明显[29]。

最新研究证据总结表:饮酒相对不饮酒人群的胃癌发生风险
最新研究证据总结表:饮酒相对不饮酒人群的胃癌发生风险
| 说明 | 效应量 | 研究数/人群数 | 证据级别 |
|---|---|---|---|
| 饮酒与胃癌发生的关联 | OR:1.21,95%CI:1.12~1.27 | 81项/25 116 302 | 中a |
| 研究证据更新时间:2021年研究类型:基于队列研究、病例对照研究的荟萃分析[29]研究人群:全球不同种族人群,欧美、亚洲人群为主 | |||
注:aGRADE:存在剂量反应关系升1级;OR为比值比;CI为可信区间
《中国居民膳食指南(2022)》建议成年人每天最大酒精摄入量不得超过15 g,相当于酒精度4%vol的啤酒450 ml、酒精度12%vol的葡萄酒150 ml、酒精度38%vol的白酒50 ml或酒精度52%vol的高度白酒30 ml[25]。因此,推荐减少酒精摄入或戒酒以降低胃癌的发生风险。全球疾病负担工作组2018 年发表的研究认为饮酒不存在安全阈值,不饮酒的总健康风险最低[30]。
指南问题10:保持规律饮食是否能够降低胃癌发生风险?
推荐意见10:建议保持规律饮食来降低胃癌发生风险(弱推荐,证据质量:低)。
规律饮食包括时间和频率两方面,特指定时定量进食。饮食不规律可导致低血糖、营养不良、肥胖、消化道疾病等。
综合分析截止至2022年中国人群10项相关研究数据的结果显示[31],饮食不规律是胃癌的重要危险因素,饮食不规律者患胃癌的风险是保持规律饮食者的3倍以上(表11)。
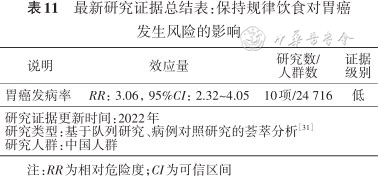
最新研究证据总结表:保持规律饮食对胃癌发生风险的影响
最新研究证据总结表:保持规律饮食对胃癌发生风险的影响
| 说明 | 效应量 | 研究数/人群数 | 证据级别 |
|---|---|---|---|
| 胃癌发病率 | RR:3.06,95%CI:2.32~4.05 | 10项/24 716 | 低 |
| 研究证据更新时间:2022年研究类型:基于队列研究、病例对照研究的荟萃分析[31]研究人群:中国人群 | |||
注:RR为相对危险度;CI为可信区间
《中国居民膳食指南(2022)》推荐健康成年人合理安排1日3餐,定时定量,不漏餐,每天吃早餐,规律进餐、饮食适度,不暴饮暴食、不偏食挑食、不过度节食[25]。本指南亦建议个体应养成良好的饮食习惯,规律饮食,促进健康。
指南问题11:控制红肉、白肉摄入是否能够降低胃癌发生风险?
推荐意见11:建议限制红肉摄入量,增加白肉摄入量,以降低胃癌发病风险(弱推荐,证据级别:中)。
肉类主要包括畜肉和禽肉,含有丰富的优质蛋白,易消化吸收,还可以提供矿物质和维生素B族等多种营养元素。其中,畜肉是牛、猪、羊肉等肉类的总称,也称为红肉。禽肉包括鸡、鸭、鹅等肉类,也称为白肉。
肉类摄入与胃癌发生密切相关,其中摄入过多红肉可显著增加胃癌的发生风险,而白肉对胃癌具有一定保护作用。综合分析截至2019年全球43篇观察性研究数据的结果显示[32],长期摄入高水平红肉的亚洲人群胃癌的发生风险升高了40%,而长期摄入白肉的人群胃癌的风险降低了30%(表12)。进一步分析发现胃癌风险与摄入量有明显关系,摄入红肉量每增加100 g/d,其胃癌的风险将增加50%,而白肉摄入量每增加100 g/d,胃癌的发生风险降低43%。
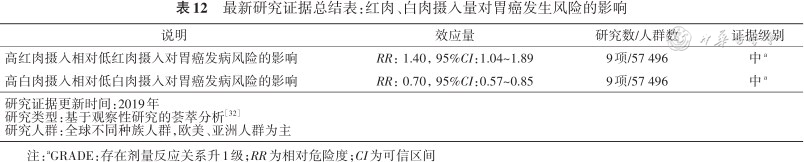
最新研究证据总结表:红肉、白肉摄入量对胃癌发生风险的影响
最新研究证据总结表:红肉、白肉摄入量对胃癌发生风险的影响
| 说明 | 效应量 | 研究数/人群数 | 证据级别 |
|---|---|---|---|
| 高红肉摄入相对低红肉摄入对胃癌发病风险的影响 | RR:1.40,95%CI:1.04~1.89 | 9项/57 496 | 中a |
| 高白肉摄入相对低白肉摄入对胃癌发病风险的影响 | RR:0.70,95%CI:0.57~0.85 | 9项/57 496 | 中a |
| 研究证据更新时间:2019年研究类型:基于观察性研究的荟萃分析方正汇总行[32]研究人群:全球不同种族人群,欧美、亚洲人群为主 | |||
注:aGRADE:存在剂量反应关系升1级;RR为相对危险度;CI为可信区间
考虑到红肉的潜在致癌效应,2015年国际癌症研究机构将“食用红肉”归类为“可能对人类致癌物”。根据世界癌症研究基金会的饮食建议,成年人每周食用红肉次数应低于3次,总量不超过350 g,且可通过食用白肉来替代部分红肉,这有助于降低胃癌的发生风险。
指南问题12:增加全谷物、杂粮、杂豆和薯类的摄入是否能够降低胃癌发生风险?
推荐意见12a:建议增加全谷物、减少精致谷物摄入降低胃癌发生风险(弱推荐,证据级别:低)。
谷物是人类的传统主食,富含大量的蛋白质、脂肪、矿物质、维生素和膳食纤维。谷物家族包括大米、大麦、小麦、小米、玉米、高粱、燕麦和荞麦等。全谷物由胚芽,胚乳和麸皮组成。全麦面包、燕麦片和其他全谷物食品可以归类为全谷物;而去壳、研磨和抛光等精炼过程后仅保留胚乳的谷物称为精制谷物,如精米、精麦等。
谷物摄入与胃癌风险之间存在显著关联。综合分析截止至2020年全球2项队列研究和17项病例对照数据的结果[33]显示,大量食用全谷物可将胃癌风险降低13%,大量食用精制谷物会使胃癌的风险增加36%(表13)。
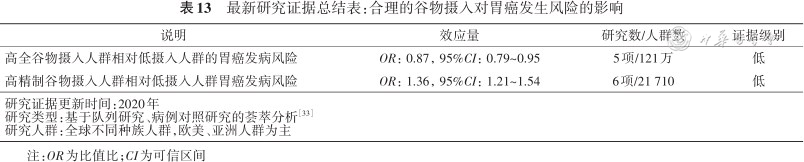
最新研究证据总结表:合理的谷物摄入对胃癌发生风险的影响
最新研究证据总结表:合理的谷物摄入对胃癌发生风险的影响
| 说明 | 效应量 | 研究数/人群数 | 证据级别 |
|---|---|---|---|
| 高全谷物摄入人群相对低摄入人群的胃癌发病风险 | OR:0.87,95%CI:0.79~0.95 | 5项/121万 | 低 |
| 高精制谷物摄入人群相对低摄入人群胃癌发病风险 | OR:1.36,95%CI:1.21~1.54 | 6项/21 710 | 低 |
| 研究证据更新时间:2020年研究类型:基于队列研究、病例对照研究的荟萃分析方正汇总行[33]研究人群:全球不同种族人群,欧美、亚洲人群为主 | |||
注:OR为比值比;CI为可信区间
《全谷物与健康的科学共识(2021)》鼓励公众养成食用全谷物的膳食习惯。《中国居民膳食指南》建议日常饮食要以谷物为主,其中每天摄入全谷物、杂豆类食物50~150 g[25]。
推荐意见12b:推荐增加豆类摄入降低胃癌发生风险(弱推荐,证据级别:低)。
豆类食品主要包括大豆、蚕豆、红豆、绿豆、黄豆和黑豆等,豆类中的主要营养成分包括碳水化合物、蛋白质和脂肪等。
豆制品可分为发酵豆制品(如腐乳、豆豉等)和非发酵豆制品。综合分析截止至2021年全球10项队列研究和21项病例对照数据的结果[34]显示,摄入大豆可以使胃癌风险降低36%,而大量摄入发酵豆制品会使胃癌的风险增加19%(表14)。这表明大豆食品的有益作用可能与是否发酵有关。大豆的这种有益作用可能归因于一些有益化学成分,例如皂苷和异黄酮。而发酵豆制品含有大量的盐分和致癌的亚硝酸盐化合物,可能会抵消其有益成分的抗癌作用,也会损伤胃黏膜和改变胃内细菌环境。因此,建议多吃非发酵豆制品,少吃发酵豆制品。
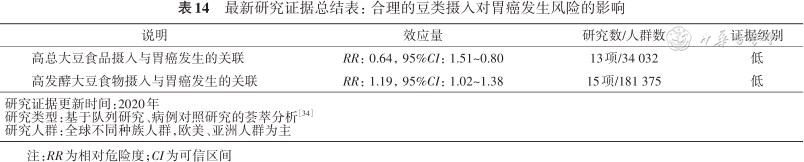
最新研究证据总结表:合理的豆类摄入对胃癌发生风险的影响
最新研究证据总结表:合理的豆类摄入对胃癌发生风险的影响
| 说明 | 效应量 | 研究数/人群数 | 证据级别 |
|---|---|---|---|
| 高总大豆食品摄入与胃癌发生的关联 | RR:0.64,95%CI:1.51~0.80 | 13项/34 032 | 低 |
| 高发酵大豆食物摄入与胃癌发生的关联 | RR:1.19,95%CI:1.02~1.38 | 15项/181 375 | 低 |
| 研究证据更新时间:2020年研究类型:基于队列研究、病例对照研究的荟萃分析方正汇总行[34]研究人群:全球不同种族人群,欧美、亚洲人群为主 | |||
注:RR为相对危险度;CI为可信区间
指南问题13:维持良好睡眠是否能够降低胃癌发生风险?
推荐意见13:建议保持适度睡眠时间(7~8 h/d)来降低胃癌的发生风险(弱推荐,证据质量:低)。
适当的睡眠是保持身心健康的必要条件。睡眠过短或过长、睡眠障碍(如呼吸异常和失眠等)等与肥胖、糖尿病、癌症等风险增加有关。
指南小组综合分析了截至2022年全球2项研究数据,发现与睡眠时间在7~8 h的人群相比,睡眠时间较短的人群(<7 h)胃癌风险增加16%,而睡眠时间>9 h的人群胃癌风险无显著变化(表15)。但考虑到睡眠时间过长会增加心脑血管疾病的发生风险,因此推荐睡眠时间不宜过长或过短,建议睡眠时间保持在7~8 h以降低胃癌的发生风险。
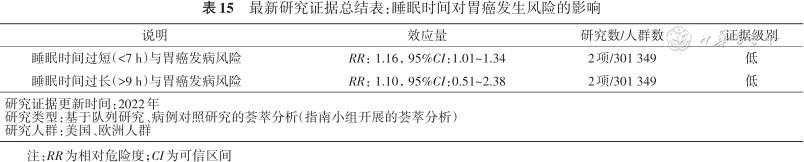
最新研究证据总结表:睡眠时间对胃癌发生风险的影响
最新研究证据总结表:睡眠时间对胃癌发生风险的影响
| 说明 | 效应量 | 研究数/人群数 | 证据级别 |
|---|---|---|---|
| 睡眠时间过短(<7 h)与胃癌发病风险 | RR:1.16,95%CI:1.01~1.34 | 2项/301 349 | 低 |
| 睡眠时间过长(>9 h)与胃癌发病风险 | RR:1.10,95%CI:0.51~2.38 | 2项/301 349 | 低 |
| 研究证据更新时间:2022年研究类型:基于队列研究、病例对照研究的荟萃分析(指南小组开展的荟萃分析)研究人群:美国、欧洲人群 | |||
注:RR为相对危险度;CI为可信区间
指南问题14:饮茶是否能够降低胃癌发生风险?
推荐意见14:建议适量饮用绿茶来降低胃癌的发生风险,冷茶、温茶以及清茶最佳(弱推荐,证据质量:极低)。
茶叶中富含茶多酚等多种生物活性物质,有抗氧化、抗癌等作用,适度饮茶可以调节血脂、血压,降低卒中、结直肠癌等疾病风险。
研究显示适量饮用绿茶可以降低胃癌风险。综合分析截至2020年全球相关41项研究数据的结果显示,饮用绿茶最多的人群相对饮用绿茶最少的人群,胃癌风险相对降低了14%[35](表16)。进一步分析发现冷茶、温茶以及茶的浓度正常或较低的茶可以降低胃癌风险,而热茶、浓茶无效果[36]。饮茶温度非常高时(55~67 ℃),胃癌风险可增加7.6倍[37]。未发现饮用红茶可以降低胃癌风险。因此,建议一般成年人适量饮用绿茶,每个月喝茶50 g以上。
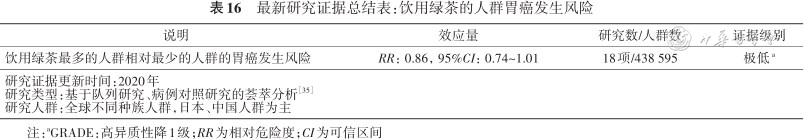
最新研究证据总结表:饮用绿茶的人群胃癌发生风险
最新研究证据总结表:饮用绿茶的人群胃癌发生风险
| 说明 | 效应量 | 研究数/人群数 | 证据级别 |
|---|---|---|---|
| 饮用绿茶最多的人群相对最少的人群的胃癌发生风险 | RR:0.86,95%CI:0.74~1.01 | 18项/438 595 | 极低a |
| 研究证据更新时间:2020年研究类型:基于队列研究、病例对照研究的荟萃分析[35]研究人群:全球不同种族人群,日本、中国人群为主 | |||
注:aGRADE:高异质性降1级;RR为相对危险度;CI为可信区间
指南问题15:控制辛辣食品的摄入是否能够降低胃癌发生风险?
推荐意见15:不建议通过控制辛辣食品的摄入来降低胃癌发生风险(弱推荐,证据级别:低)。
辣椒含有丰富的辣椒素、胡萝卜素、维生素C等。然而,过量摄入辣椒与胃黏膜糜烂、溃疡有关,还可能影响化学致癌物的代谢。
目前关于辛辣食品摄入与胃癌风险的研究存在争议。指南小组对截止2022年全球发表的17项观察性研究进行了合并分析,综合16项病例对照研究发现,高辛辣食品摄入可升高人群胃癌发病率(OR:1.51,95%CI:1.02~2.00),但1项基于中国人群设计更为严格的大型队列研究[38]得出了相反的结论,认为辣椒摄入对胃癌有保护作用(HR:0.89,95%CI:0.80~0.99)(表17)。综合不同来源的研究结果及质量,我们认为目前没有足够的证据证明辣椒摄入与胃癌发生风险之间存在显著相关性,不建议居民通过控制辛辣食品的摄入来降低胃癌发生风险。但是,大量的辣椒摄入可以引起胃黏膜损伤,应合理控制每日辣椒摄入量,不宜过多。

最新研究证据总结表:辣椒摄入对胃癌发生风险的影响
最新研究证据总结表:辣椒摄入对胃癌发生风险的影响
| 说明 | 效应量 | 研究数/人群数 | 证据级别 |
|---|---|---|---|
| 高频率辣椒摄入相对低辣椒摄入对胃癌发病的影响 | HR:0.89,95%CI:0.80~0.99 | 1项/510 101 | 低 |
| 研究证据更新时间:2022年研究类型:队列研究[38]研究人群:中国人群 | |||
注:HR为风险比;CI为可信区间
指南问题16:减少含糖饮料的摄入是否能够降低胃癌发生风险?
推荐意见16:不建议通过减少含糖饮料的摄入来降低胃癌的发生风险(弱推荐,证据质量:低)。
含糖饮料是添加热量甜味剂(蔗糖、果糖、人工甜味剂等)的饮料,包括碳酸饮料、人工甜味饮料和果汁饮料等。研究显示含糖饮料的摄入水平与2型糖尿病、乳腺癌、结直肠癌等发病相关[39, 40, 41]。
综合分析截止至2021年全球相关2项前瞻性队列研究和5项病例对照研究数据的结果[39]显示,含糖饮料的摄入量与胃癌的发生风险无显著相关性,也没有证据表明两者之间存在剂量反应关系(表18)。因此,目前没有证据表明含糖饮料摄入会影响胃癌发生风险。

最新研究证据总结表:高糖饮料摄入水平人群相对低摄入人群的胃癌发生风险
最新研究证据总结表:高糖饮料摄入水平人群相对低摄入人群的胃癌发生风险
| 说明 | 效应量 | 研究数/人群数 | 证据级别 |
|---|---|---|---|
| 胃癌发生风险 | RR:0.99,95%CI:0.79~1.29 | 7项/40 182 | 低 |
| 研究证据更新时间:2021年研究类型:基于队列研究、病例对照研究的荟萃分析[39]研究人群:全球不同种族人群,欧美、亚洲人群为主 | |||
注:RR为相对危险度;CI为可信区间
指南问题17:增加奶类及乳制品的摄入是否能够降低胃癌发生风险?
推荐意见17:不建议通过增加奶类及乳制品的摄入来减少胃癌发生风险(弱推荐,证据质量:低)。
奶类和乳制品营养成分齐全,组成比例适宜,易消化吸收,可提供优质蛋白质、维生素A、核黄素和钙等多种营养成分。
目前尚无充分研究证据说明奶类和乳制品摄入与胃癌发生存在关系[42, 43]。本指南专家小组对该问题的荟萃分析进行了更新,纳入了截至2022年9月全球完成的5项前瞻性队列研究,总共537 394人。合并数据分析发现,按摄入奶类及乳制品量水平分组,摄入量最多的人群相对摄入最低的人群在胃癌发病率方面差异无统计学意义(表19)。因此,不建议把增加奶类及乳制品摄入作为胃癌的预防措施。
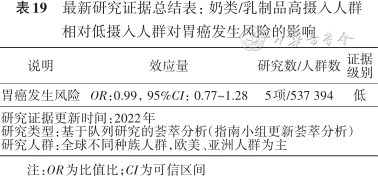
最新研究证据总结表:奶类/乳制品高摄入人群相对低摄入人群对胃癌发生风险的影响
最新研究证据总结表:奶类/乳制品高摄入人群相对低摄入人群对胃癌发生风险的影响
| 说明 | 效应量 | 研究数/人群数 | 证据级别 |
|---|---|---|---|
| 胃癌发生风险 | OR:0.99,95%CI:0.77~1.28 | 5项/537 394 | 低 |
| 研究证据更新时间:2022年研究类型:基于队列研究的荟萃分析(指南小组更新荟萃分析)研究人群:全球不同种族人群,欧美、亚洲人群为主 | |||
注:OR为比值比;CI为可信区间
胃癌的风险评估及控制对于胃癌预防具有重要意义。本指南总结了中国胃癌筛查和危险因素研究的最新相关证据,为普通大众提供明确的、可实际操作的胃癌预防指导建议,为胃癌关口前移发挥作用,降低中国人群的胃癌发病,减少疾病负担。
本指南存在一定不足:(1)支持本指南问题推荐意见的证据大多为观察性研究,证据级别较低,对效应量估计的把握欠佳;(2)本指南主要针对中国人群,而相当部分证据主要基于欧美等其他人群获得,外部推广性需要进一步核实;(3)中国人群有许多独特饮食习惯、生活方式可能与胃癌发病相关,如大蒜摄入等,但目前流行病学证据相对缺乏,未纳入到本指南进行讨论。(4)本指南未对内因性因素,比如心理因素(压力、焦虑等)对胃癌发生的影响进行深入阐述。有研究显示这些因素也是胃癌的危险因素,进行适当控制可能对胃癌预防有益[44]。此外,本指南也可能存在其他不足,笔者欢迎广大读者提出宝贵意见,以便在未来的版本中进行完善。
本指南制定工作组成员名单
执笔:袁金秋(中山大学附属第七医院临床医学研究中心);李明哲(中山大学附属第七医院消化医学中心);杨东杰(中山大学附属第七医院消化医学中心)
首席临床专家:何裕隆(中山大学附属第七医院消化医学中心)
首席方法学家:杨克虎(兰州大学循证医学中心)
指导委员会:何裕隆(中山大学附属第七医院消化医学中心);陈凛(解放军总医院普通外科);梁寒(天津医科大学肿瘤医院胃部肿瘤科);徐惠绵(中国医科大学附属第一医院肿瘤中心);杨克虎(兰州大学循证医学中心)
共识专家组(按姓氏汉语拼音排序):蔡世荣(中山大学附属第一医院胃肠外科中心);陈环球(江苏省肿瘤医院普外科);陈俊强(广西医科大学第一附属医院胃肠外科);陈路川(福建省肿瘤医院胃肠肿瘤外科);邓志刚(绵阳市中心医院普外科);郜永顺(郑州大学第一附属医院胃肠外科);侯冰宗(中山大学附属第五医院胃肠外科);胡明(广州医科大学附属第一医院胃肠外科);黄昌明(福建医科大学附属协和医院胃外科);黄陈(上海交通大学医学院附属上海市第一人民医院胃肠外科);黄宗海(南方医科大学珠江医院普通外科);江志伟(江苏省中医院普外科);揭志刚(南昌大学第一附属医院普外科);雷平光(深圳市宝安区松岗人民医院消化内科);李琛(上海交通大学医学院附属瑞金医院胃肠外科);李威(汕头大学医学院第一附属医院普外科);刘非(四川大学华西医院肝胆胰外科);孟文勃(兰州大学第一医院普外科);潘逸航(副组长,中山大学附属第七医院科研中心);祁兴顺(北部战区总医院消化内科);秦长江(河南大学淮河医院普通外科);秦希文(香港大学药剂学与药理学院,西澳大利亚大学公共卫生与全球卫生学院);宋武(中山大学附属第一医院胃肠外科中心);宋新明(中山大学附属第一医院胃肠外科中心);所剑(吉林大学第一附属医院胃肠外科);万进(广东省中医院胃肠外科);王灏(海军军医大学第一附属医院普外科);卫勃(解放军总医院第一医学中心胃肠外科);卫洪波(中山大学附属第三医院胃肠外科);魏哲威(中山大学附属第一医院胃肠外科中心);文刚(安徽医科大学第三附属医院胃肠外科);吴心音(中南大学湘雅公共卫生学院流行病与卫生统计学系);鲜于剑波(绵阳市中心医院普外科);向军(中山大学附属第六医院胃肠外科);谢少华(福建医科大学公共卫生学院);徐建波(中山大学附属第一医院胃肠外科);薛万江(南通大学附属医院普外科);杨丽平(兰州大学护理学院);周应生(中国科学院大学深圳医院消化内科);张常华(组长,中山大学附属第七医院消化医学中心)
制定小组(按姓氏汉语拼音排序):证据评价组:毕卓畅(中山大学公众卫生学院);蔡美琪(中山大学公共卫生学院);曹薇(中山大学公共卫生学院);何强生(副组长,中山大学附属第七医院);胡琳敏(中山大学公共卫生学院);黎文婧(中山大学附属第七医院);李鸿略(中山大学医学院);李艳飞(兰州大学循证医学中心);梁瑞琪(中山大学公共卫生学院);林宇慧(中山大学公共卫生学院);刘铠婕(中山大学公共卫生学院);刘松林(中山大学医学院);刘伟锋(中山大学公共卫生学院);马子喻(中山大学医学院);米宁宁(兰州大学第一医院);钱群英(中山大学医学院);田辉东(广州医科大学公共卫生学院);田玉洁(中山大学医学院);汪曼婷(中山大学医学院);王丹彤(中山大学医学院);王妮(中山大学医学院);魏莉莉(兰州大学循证医学中心);吴思庆(中山大学医学院);夏斌(组长,中山大学附属第七医院);詹泽凯(中山大学医学院);赵海通(兰州大学循证医学中心);朱欣彦(中山大学医学院)
秘书组:陆葵青(组长,中山大学附属第七医院);王丹妮(中山大学附属第七医院);张仰婷(中山大学附属第七医院)
外审组(按姓氏汉语拼音排序):胡付兰(深圳大学公共卫生学院);黄雅芳(首都医科大学公共卫生与家庭医学学院);李江(国家癌症中心、国家肿瘤临床医学研究中心、中国医学科学院北京协和医学院肿瘤医院);吕跃斌(中国疾控预防控制中心);王子昕(香港中文大学基层医疗与公共卫生学院);邹华春[中山大学公共卫生学院(深圳)]
公众代表:陈佳如、段丹枫、郭哲男、李安然、潘怡婷、杨驰、曾广华
中国抗癌协会胃癌专业委员会,中国医师协会外科医师分会上消化道外科医师委员会,中国人群健康风险管理协作组-胃癌专业组. 中国人群胃癌风险管理公众指南(2023版)[J]. 中华医学杂志, 2023, 103(36): 2837-2849. DOI: 10.3760/cma.j.cn112137-20230608-00968.
所有作者及项目基金资助方声明不存在利益冲突



























